아지드화은
Silver azide | |
| 이름 | |
|---|---|
| IUPAC 이름 은(I) 아지드화물 | |
| 기타 이름 아지드화물 | |
| 식별자 | |
3D 모델(JSmol) | |
| 켐스파이더 | |
| ECHA 정보 카드 | 100.034.173 |
PubChem CID | |
| 유니 | |
CompTox 대시보드 (EPA ) | |
| |
| |
| 특성. | |
| AGN3 | |
| 몰 질량 | 149.888 g/140 |
| 외모 | 무색의 결정 |
| 밀도 | 4.42 g/cm3 |
| 녹는점 | 250°C(482°F, 523K) 폭약 |
| 비등점 | 분해하다 |
| 다른 용제의 용해성 | 2.0×10g−8/L |
| 구조. | |
| 정형외과 oI16[1] | |
| 이밤, 72호 | |
| 위험 요소 | |
| 산업안전보건(OHS/OSH): | |
주요 위험 요소 | 매우 독성이 높고 폭발성이 있다 |
| NFPA 704(파이어 다이아몬드) | |
달리 명시되지 않은 한 표준 상태(25°C[77°F], 100kPa)의 재료에 대한 데이터가 제공됩니다. | |
아지드화은 화학식이 AgN인3 화합물이다.그것은 히드라조산의 은염이다.그것은 무색의 결정을 형성한다.그것은 잘 알려진 폭발물이다.
구조와 화학
질산은 수용액을 [2]아지드화나트륨으로 처리함으로써 아지드화은을 제조할 수 있다.은 아지드는 백색 고체로 침전되어 질산나트륨을 용액에 남깁니다.
X선 결정학상 AgN은3 4개의 아지드 배위자에 의해 배위된 정사각형 평면+ Ag를 가진 배위 고분자임을 알 수 있다.이에 대응하여 각 아지드 배위자의 양끝은 한 쌍의+ Ag중심에 접속되어 있다.이 구조는 2차원3 AgN 층으로 구성되어 있으며 층간 결합이 약하다.Ag의+ 배위는 또는 고도로 왜곡된 4 + 2 팔면체로 설명될 수 있으며, 더 멀리 있는 두 질소 원자는 [3]위와 아래 층의 일부입니다.
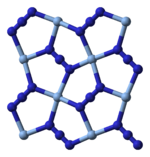 |  | 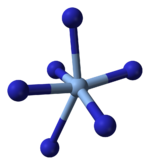 |  |
| 레이어의 일부 | 레이어 스태킹 | Ag의+ 4+2 조정 | N-3에서 N의 2+1 조정 |
가장 특징적인 반응으로 고체는 폭발적으로 분해되어 질소 가스를 방출합니다.
- 2 AgN3(s) → 3 N(g) + 2 Ag2(s)
이 분해의 첫 번째 단계는 자유 전자와 아지드화 라디칼의 생산입니다. 따라서 반도체 [4]산화물을 첨가하면 반응 속도가 증가합니다.순수한 은 아지드는 340°C에서 폭발하지만 불순물이 있으면 270°[5]C로 낮아집니다.이 반응은 해당 [6]아지드화납의 분해보다 활성화 에너지와 초기 지연이 낮습니다.
안전.
AgN은3 대부분의 중금속 아지드화물과 마찬가지로 위험한 1차 폭발물입니다.분해는 자외선에 노출되거나 [2]충격에 의해 유발될 수 있습니다.산화제로서 질산세릭암모늄[2NH][Ce3(6NO)]를4 사용하여 AgN을 [5]액체로 파괴한다3.
「 」를 참조해 주세요.
레퍼런스
- ^ Marr H.E. III.; Stanford R.H. Jr. (1962). "The unit-cell dimensions of silver azide". Acta Crystallographica. 15 (12): 1313–1314. doi:10.1107/S0365110X62003497.
- ^ a b Robert Matyas, Jiri Pachman (2013). Primary Explosives (1st ed.). Springer. p. 93. ISBN 978-3-642-28435-9.[1]
- ^ Schmidt, C. L. Dinnebier, R.; Wedig, U.; Jansen, M. (2007). "Crystal Structure and Chemical Bonding of the High-Temperature Phase of AgN3". Inorganic Chemistry. 46 (3): 907–916. doi:10.1021/ic061963n. PMID 17257034.
{{cite journal}}: CS1 maint: 여러 이름: 작성자 목록(링크) - ^ Andrew Knox Galwey; Michael E. Brown (1999). Thermal decomposition of ionic solids (vol.86 of Studies in physical and theoretical chemistry. Elsevier. p. 335. ISBN 978-0-444-82437-0.
- ^ a b Margaret-Ann Armour (2003). Hazardous laboratory chemicals disposal guide, Environmental Chemistry and Toxicology (3rd ed.). CRC Press. p. 452. ISBN 978-1-56670-567-7.
- ^ Jehuda Yinon; Shmuel Zitrin (1996). Modern Methods and Applications in Analysis of Explosives. John Wiley and Sons. pp. 15–16. ISBN 978-0-471-96562-6.



