관상동맥우회술
Coronary artery bypass surgery| 관상동맥우회술 | |
|---|---|
 | |
| 기타이름 | 관상동맥 우회 이식술 |
| ICD-10-PCS | 021209W |
| ICD-9-CM | 36.1 |
| MeSH | D001026 |
| 메드라인플러스 | 002946 |
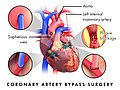
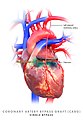
관상동맥우회술은 관상동맥우회술(CABG, "배추"로 발음됨)이라고도 하며, 심장의 동맥에 플라크가 쌓이는 관상동맥질환(CAD)을 치료하기 위한 외과적 절차입니다. CAD로 인한 흉통을 완화하고 CAD의 진행 속도를 늦추며 기대 수명을 늘릴 수 있습니다. 동맥이나 신체의 다른 부분에서 채취한 정맥을 사용하여 심장 동맥의 협착을 우회하여 이전의 허혈성(혈액이 부족한) 심장에 적절한 혈액 공급을 회복하는 것을 목표로 합니다.
크게 두 가지 접근 방식이 있습니다. 첫 번째는 심폐 바이패스 기계, 혈액과 산소를 순환시켜 수술 중 심장과 폐의 기능을 이어받는 기계를 사용합니다. 심장이 심장마비로 정지된 상태에서 채취된 동맥과 정맥은 문제가 있는 부위를 가로질러 연결하는 데 사용됩니다. 이 구조를 외과적 문합이라고 합니다. 두 번째 접근법인 오프 펌프 관상동맥 바이패스(OPCAB)는 심장이 여전히 뛰고 있는 동안 이러한 문합을 구성합니다. 좌측 전방 하행 가지를 공급하는 문합이 가장 중요하며, 일반적으로 좌측 내부 유방동맥을 채취하여 사용합니다. 다른 일반적으로 사용되는 소스는 오른쪽 내부 유선 동맥, 요골 동맥 및 대정맥입니다.
흉통(특히 CAD의 일반적인 증상인 협심증)을 치료하는 효과적인 방법이 20세기 초부터 모색되어 왔습니다. 1960년대에 CABG는 현대적인 형태로 도입되었으며 그 이후로 중요한 CAD에 대한 주요 치료법이 되었습니다. 수술의 심각한 합병증으로는 출혈, 심장 문제(심장마비, 부정맥), 뇌졸중, 감염(종종 폐렴) 및 신장 부상이 있습니다.

사용하다
관상동맥우회술은 흉통의 동반된 느낌인 협심증을 완화하여 관상동맥질환으로 인한 사망을 예방하고 삶의 질을 향상시키는 것을 목적으로 합니다.[1] 수술 결정은 병변의 해부학적 구조나 심장이 얼마나 잘 작동하는지에 따라 다양한 환자 하위 그룹에서 CABG의 효능에 대한 연구에 의해 알려집니다. 이러한 결과는 다른 전략, 가장 중요한 경피적 관상동맥 중재술(PCI)의 결과와 비교됩니다.[2][3]
관상동맥질환

관상동맥질환은 심장의 관상동맥이 죽상성 플라크를 축적해 하나 이상의 동맥에 협착(협착)을 일으키고 심장에 혈액 공급이 중단되는 심근경색 위험이 있을 때 발생합니다. CAD는 관상동맥 순환의 주요 혈관인 좌측 주간, 좌측 상행동맥, 원주형 동맥, 우측 관상동맥 및 그 가지에서 발생할 수 있습니다. CAD 증상은 운동을 할 때만 흉통(안정협심증), 휴식을 취할 때도 흉통(안정협심증) 등 다양합니다. 심근경색으로 나타나기도 하는데, 심장으로 가는 혈류가 몇 시간 안에 회복되지 않으면 심장의 혈액이 부족한 부분이 괴사(죽는)가 되어 흉터가 생깁니다. 부정맥, 심장 유두근육 파열, 돌연사 등 다른 합병증을 유발할 수 있습니다.[4]
CAD를 감지하고 평가하는 다양한 방법이 있습니다. 병력과 임상 검사 외에 비침습적인 방법으로는 휴식 시나 운동 중 심전도(ECG), 흉부 X선 촬영 등이 있습니다. 심장 초음파 검사는 예를 들어 좌심실의 비대, 박출률, 심장 판막의 상황 등을 측정하여 심장 기능을 정량화할 수 있습니다. CAD를 검출하는 가장 정확한 방법은 관상동맥 조영술과 관상동맥 CT 조영술입니다.[4] 혈관 조영술은 관상동맥 순환 및 병변에 대한 자세한 해부학적 구조를 제공할 수 있습니다. 각 병변의 유의성은 직경 손실에 따라 결정됩니다. 직경 50%의 손실은 대부분의 그룹에서 중간 정도로 간주되는 75%의 단면적 손실로 해석됩니다. 심한 협착은 직경 손실이 2/3 이상으로 단면적 손실의 90% 이상입니다.[5] 협착의 중증도를 보다 정확하게 판단하기 위해 중재적 심장 전문의는 중증도를 판단하고 죽상성 플라크의 구성에 대한 정보를 제공할 수 있는 혈관 내 초음파도 사용할 수 있습니다. 프랙셔널 플로우 리저브의 기술로 협착 후의 압력을 평균 대동맥압과 비교합니다. 비율이 0.80 미만이면 협착이 유의한 것으로 간주됩니다.[5]
CABG 표시
안정환자
운동 중 협심증이 있는 사람들은 대개 먼저 의학적 치료를 받습니다. 비침습적 검사는 관상동맥 조영술을 시행함으로써 어떤 환자가 이득을 볼 수 있는지 추정하는 데 도움이 됩니다. 일반적으로 심장벽의 일부가 정상보다 적은 양의 혈액을 받고 있는 경우 관상동맥 조영술이 표시됩니다. 그런 다음 병변을 식별하고 PCI 또는 CABG를 받기로 결정한 사항을 알려줍니다.[6]
CABG는 일반적으로 생존 이익으로 인해 관상 동맥에 광범위하고 복잡한 플라크의 상당한 부담이 있는 경우 PCI보다 선호됩니다. PCI보다는 CABG로 인해 환자가 더 많은 이득을 볼 수 있는 다른 지표로는 왼쪽-심실 기능 저하, 왼쪽 주 질환, 당뇨병, 그리고 특히 LAD의 병변이 근위부에 있을 때 복합 삼중 시스템 질환(LAD, Cx 및 RCA 포함)이 있습니다.[2][3]
급성관상동맥증후군
급성 관상동맥 증후군으로 알려진 급성 심장 사건 동안 심장 조직으로의 혈류를 빠르게 회복시키는 것이 무엇보다 중요합니다. 일반적으로 환자는 흉통으로 병원에 도착합니다. 이들은 우선 약물, 특히 혈관 내의 혈전을 예방하는 가장 강력한 약물(이중 항혈소판 요법: 아스피린과 클로피도그렐)로 치료됩니다. 허혈이 지속될 위험이 있는 환자들은 혈류를 회복하기 위해 PCI를 받고, 따라서 힘든 심장에 산소가 전달됩니다.[7] PCI가 해부학적 고려 사항이나 기타 기술적 문제로 인해 혈류를 복원하지 못한 경우 심장 조직을 저장하기 위해 긴급 CABG가 표시됩니다. 수술 시기는 생존에 중요한 역할을 합니다. 가능하면 수술을 미루는 것이 좋습니다(흉부근의 전체 두께에 영향을 주는 경색은 3일, 그렇지 않은 경우는 6시간).[2]
CABG는 또한 경색의 기계적 합병증(심실 중격 결손, 유두근 파열 또는 심근 파열)이 있을 때 표시됩니다.[8] CABG의 절대적인 금기사항은 없으나 간이나 뇌 등 다른 장기의 중증질환, 제한된 기대수명, 환자의 취약성 등이 고려됩니다.[8]
기타 심장수술
CABG는 또한 환자가 다른 심장 수술 절차(가장 일반적으로 판막 질환)를 받아야 할 때 수행되며 혈관 조영술에서 관상 동맥의 중요한 병변이 발견됩니다.[9] CABG는 또한 관상 동맥의 박리를 해결할 수 있으며, 관상 동맥 층의 파열은 유사 내강(공동)을 생성하고 심장으로의 혈액 전달을 감소시킵니다. 이러한 해부는 임신, Enhler-Danlos 증후군 및 Marfan 증후군과 같은 조직 질환, 코카인 남용 또는 PCI로 인해 발생할 수 있습니다. 관상 동맥류는 CABG를 나타낼 수도 있습니다. 혈관 내에 혈전이 발생하여 하류로 이동할 수도 있습니다.[10]
CABG 대 PCI
CABG와 경피적 관상동맥중재술(PCI)은 관상동맥의 협착성 병변으로 인한 혈류를 회복시키는 두 가지 방법입니다. 방법의 선택은 여전히 논쟁의 여지가 있지만 복잡한 병변, 중요한 좌측 주 질환 또는 당뇨병이 있는 경우 CABG가 더 나은 장기 생존 및 결과를 산출한다는 것은 분명합니다.[11][10] CABG의 강력한 적응증에는 증상이 있는 환자와 좌심실 기능 장애도 포함됩니다.[10] CABG는 심장의 고유 동맥에 제공되는 보호 동맥 도관 때문에 혈관 확장기 인자를 생성하고 플라크의 진행을 방지함으로써 좌측 주 질환 및 여러 혈관에 영향을 미치는 CAD에서 PCI보다 더 나은 결과를 제공합니다. 2023년에 발표된 연구에 따르면 왼쪽 주 질환 환자의 CABG는 PCI에 비해 사망률이 낮고 부작용이 적습니다.[12][13]
이전 CABG 수술 이후 왼쪽 주동맥의 유출이 특허 이식편에 의해 보호되지 않는 비보호 왼쪽 주질환 환자를 그룹으로 연구했습니다. 2016년 유럽 연구에 따르면 이러한 환자에서 CABG는 장기적으로(5년) PCI를 능가하는 것으로 나타났습니다. 또 다른 2016년 연구에서는 PCI가 3년 후에는 CABG와 비슷한 결과를 보이지만 4년 후에는 CABG가 PCI보다 더 좋아진다는 결과를 발견했습니다.[14][15]
당뇨병 환자를 대상으로 한 2012년 시험 및 후속 조치는 PCI보다 CABG에 상당한 이점이 있음을 보여주었습니다. 상대적인 이점은 3.8년과 7.5년의 추적 관찰에서 분명히 나타났는데, 흡연자와 젊은 환자들에게서 특별한 이점을 발견했습니다.[16] 2015년 실험에서는 CABG와 다혈관 질환에서 2세대 약물 용출 스텐트인 PCI의 최신 기술 발전을 비교했습니다. 그들의 결과는 CABG가 CAD 환자에게 더 나은 선택임을 나타냅니다.[17] 2021년에 발표된 시험에서도 1년 후 결과를 비교한 결과 CABG가 PCI보다 안전한 옵션이라는 결론이 나왔습니다.[18] 2023년 발표된 대규모 연구에 따르면 PCI 환자는 좌측 주 관상동맥 질환이 있는 CABG 환자보다 사망률이 높았습니다.[19]
절차.

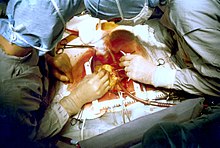
수술 전 검사 및 전략
일상적인 수술 전 검사는 심장 외에 시스템과 장기의 상태를 확인하는 것이 목적입니다. 검사에는 일반적으로 폐를 확인하기 위한 흉부 X선 검사, 전체 혈구 수, 신장 및 간 기능 검사가 포함됩니다. 이식편의 품질이나 다리의 정맥류와 같은 제거의 안전성을 확인하기 위한 신체 검사 또는 팔의 알렌 테스트를 수행하여 팔에 혈액 공급이 심각하게 방해받지 않도록 합니다.[20]
항응고제(아스피린, 클로피도그렐, 티카그렐 등)를 복용하는 환자는 수술 중 및 수술 후 과도한 출혈을 방지하기 위해 며칠 전에 복용을 중단합니다. 와파린도 같은 이유로 중단되고 INR이 2.0 이하로 떨어진 후 환자가 헤파린 제품을 복용하기 시작합니다.[20][21]
혈관 조영술을 수술 팀에서 검토한 후 대상(즉, 어떤 고유 동맥을 우회할 것인지, 문합을 배치할 위치)이 선택됩니다. 이상적으로 중요한 혈관의 모든 주요 병변을 해결해야 합니다. 가장 일반적으로 왼쪽 내부 흉부 동맥(LITA; 이전에는 왼쪽 내부 유방 동맥, LIMA)은 왼쪽 전방 하행 동맥(LAD)에 문합됩니다. LAD는 심장의 가장 중요한 동맥이며 다른 동맥보다 더 많은 부분의 심근에 혈액을 공급하기 때문입니다.[21]
도관은 하나 이상의 고유 동맥을 이식하는 데 사용될 수 있습니다. 후자의 경우에는 엔드 투 사이드 문합을 수행합니다. 전자의 경우, 순차적인 문합을 사용하여 이식편은 혈액을 심장의 두 개 이상의 고유 혈관으로 전달할 수 있습니다.[21] 또한 도관의 근위부는 다른 도관의 측면에 문합될 수 있습니다. 도관을 너무 많이 수확하지 않는 것이 좋습니다. 왜냐하면 재작업이 필요할 수 있기 때문입니다.[21]
심폐 바이패스 기계(온 펌프) 사용
삽관 환자는 수술실로 옮겨집니다. 약물 투여 및 모니터링을 위해 라인(예: 주변 IV 캐뉼라, 내부 경정맥 캐뉼라와 같은 중심 라인)이 삽입됩니다. 전통적인 CABG에 대한 설명은 다음과 같습니다.
- 하베스팅
흉골을 절개하는 것은 혈관을 채취하는 동안 팔이나 가슴 또는 다리에서, 대개 내부 유선 동맥이나 사구체 정맥에서 절개합니다.[22][23] LITA는 흉골 절제술을 통해 수확됩니다. LITA를 동원하는 일반적인 방법에는 두 가지가 있습니다. 즉, 척추경(동맥과 주변 지방 및 정맥으로 구성된 척추경)과 골격화된(즉, 다른 조직으로부터 해방된) 두 가지 방법이 있습니다. LITA가 더 원위부로 분할되기 전에 항응고제 헤파린은 혈전을 예방하기 위해 주변 라인을 통해 환자에게 투여됩니다.[21]
- 카테터 삽입 및 심폐 바이패스 확립
채취가 끝나면 심장을 감싸고 있는 주머니인 심낭을 열고 봉합사를 놓아 열어놓습니다. 대동맥에 주머니 끈 봉합사를 넣어 캐뉼라를 대동맥에 삽입할 수 있도록 준비하고, 칼륨이 높은 용액을 사용해 심장을 일시적으로 정지시키는 카테터를 사용합니다. 정맥 캐뉼라를 위해 오른쪽 심방에 또 다른 지갑 끈이 놓여 있습니다. 캐뉼라와 카테터가 배치되면 심폐 바이패스(CBP)가 시작됩니다. 정맥에서 심장으로 도착한 탈산소화된 혈액은 CBP 기계로 전달되어 산소화된 후 대동맥으로 전달되어 신체의 나머지 부분을 포화 상태로 유지합니다. 혈액은 종종 신진대사를 늦추고 산소 수요를 최소화하기 위해 32~34°C(90~93°F)로 냉각됩니다. 심장마비 카테터와 대동맥 캐뉼라 사이의 대동맥에 클램프를 배치하여 클램프를 조정하여 심장마비액의 흐름을 제어할 수 있습니다. 몇 분 안에 심장 박동이 멎습니다.[21][24]
- 문합(접합)
심장을 가만히 둔 상태에서 심장의 끝을 심낭 밖으로 빼내어 심장 뒤쪽에 누운 고유 동맥이 접근할 수 있도록 합니다. 일반적으로 원위부 문합은 먼저(우선 오른쪽 관상동맥 시스템으로, 그 다음에 원주방향으로) 구성된 다음 필요한 경우 순차적 문합을 구성합니다. 외과의사들은 문합 부위가 열려 있는지(충분히 열려 있는지) 또는 누출이 있는지 확인합니다. 그런 다음 심낭 내에 이식편을 삽입하고 때로는 심장마비 카테터에 부착합니다. LAD에 대한 LIMA의 문합은 일반적으로 구성되는 마지막 원위부 문합이며, 구성되는 동안 혈액 재가열 과정이 시작됩니다(CPB에 의해).[21] 문합이 완료되고 누출이 있는지 확인한 후에는 도관의 근위 문합이 다음에 나타납니다. 클램프를 계속 켜놓은 상태에서 또는 부분 클램프를 배치하여 대동맥 클램프를 제거하고 대동맥의 작은 부분을 분리한 후에 수행할 수 있습니다. 즉, 플라크로 인해 부담을 주는 대동맥이 손상되거나 과도하게 취급되어 혈전성 파편이 방출될 수 있습니다.[21][25]
- 심폐 바이패스 및 폐쇄로부터 이유
근위 문합이 끝나면 클램프가 제거되고 대동맥과 도관의 공기가 제거됩니다. 심장박동을 돕기 위해 전류를 공급하는 페이싱 와이어가 배치될 수 있습니다. 심장 및 기타 시스템이 작동하면 CBP가 중단되고 캐뉼라가 제거됩니다. 항응고제인 헤파린의 효과를 역전시키기 위해 프로타민을 투여합니다. 출혈 가능성이 있는 부위를 확인한 후 흉관을 배치하고 흉골을 폐쇄합니다.[21][25]
오프 펌프
OPCB(Off-pump Coronary Bypass) 수술은 심장의 작은 부분을 동시에 안정화하여 CPB 기계를 사용하지 않습니다. 수술팀과 마취과 의사는 혈류의 안정성을 저해하지 않도록 조정하고 심장을 너무 많이 조작하지 않도록 세심한 주의를 기울여야 합니다. 즉시 타협을 감지하고 적절한 조치를 취해야 합니다.
건강한 심장박동을 유지하려면 서맥으로부터 보호하기 위해 심방 와이어를 배치하거나 노출을 돕기 위해 심낭에 꿰매거나 절개하는 것과 같은 동작이 포함될 수 있습니다. 올가미와 테이프를 사용하여 노출을 용이하게 합니다. 목적은 좌심실의 원위 부분을 공급하는 혈관이 막혀서 발생하는 원위 허혈을 피하는 것입니다. 따라서 일반적으로 LITA에서 LAD로 가는 것이 가장 먼저 문합되고 다른 것들이 그 뒤를 따릅니다. 문합을 위해 가습된 CO를2 불어주는 미세한 튜브가 수술 부위를 혈액으로부터 깨끗하게 유지합니다. 또한 혈액이 문합 부위를 통과할 수 있도록 션트를 사용할 수도 있습니다. 원위부 문합이 완료된 후 부분적으로 닫힌 대동맥 클램프로 대동맥 근위부 문합을 구성합니다. 나머지 공정은 온 펌프 CABG와 유사합니다.[26]
대안적 접근 및 특수 상황
심근경색으로 응급으로 CABG를 시행할 때는 고전하는 심근을 구제하는 것이 최우선입니다. 수술 전에는 혈액을 펌핑하는 부담을 일부 덜어주기 위해 대동맥 내 풍선 펌프(IABP)를 삽입하여 심근에 필요한 산소의 양을 효과적으로 줄일 수 있습니다. 수술 중에는 환자를 가능한 한 빨리 CPB에 올려놓고 세 개의 사구체 정맥으로 심장을 재관류하는 것이 표준 관행입니다. 석회화된 대동맥도 클램핑이 매우 위험하기 때문에 문제가 있습니다. 이 경우 수술은 하부 장간막 동맥(IMA) 또는 Y, T 및 순차 이식을 모두 사용하여 오프 펌프 CAB로 수행할 수 있습니다. 저체온증으로 깊은 정지가 유발되어 신체의 온도가 20°C(68°F)를 약간 상회할 수 있습니다.[27] 중요한 동맥이 완전히 막힌 경우에는 플라크를 제거하고 동맥의 동일한 구멍을 이용하여 문합술을 시행하는 것이 가능할 수 있습니다.·이 기법을 심장내절제술이라고 하며, 보통 오른쪽 관상동맥에서 시행합니다.[28]
CABG(이전의 CABG 작업 이후의 또 다른 CABG 작업)의 재작동은 어려움을 초래합니다. 심장이 흉골에 너무 가까이 위치하여 흉골을 다시 절단할 때 위험할 수 있으므로 진동톱을 사용합니다. 심장은 구조를 조정하기 위한 강한 접착제로 덮일 수 있습니다. 의사는 노화된 이식편을 교체해야 하는지 여부를 결정해야 합니다. 정맥 이식술의 조작은 플라크 이탈의 위험이 있기 때문에 피합니다.[29]
최소 침습적 직접 관상동맥 우회술(MIDCAB)은 흉골의 큰 절개를 피하기 위해 노력합니다. 오프 펌프 기술을 활용하여 일반적으로 LAD에 LIMA의 이식편을 배치합니다. LIMA는 왼쪽 갈비뼈 사이를 절개하거나(흉부 절제술), 심지어 왼쪽 가슴에 배치된 내시경을 사용하여 해방됩니다.[30] 아직 널리 사용되지 않는 로봇 보조 관상동맥 재관류술은 흉골 절개를 피하고 감염과 출혈을 예방합니다. 도관 채취와 문합은 모두 로봇의 도움을 받아 개흉술을 통해 수행됩니다. 일반적으로 이 절차는 CABG와 PCI의 방법이 모두 사용되는 하이브리드 관상동맥 재혈관화와 결합됩니다. LAD에 대한 LIMA의 문합은 수술실에서 수행되며 다른 병변은 문합 직후 수술실에서 또는 며칠 후 PCI로 치료됩니다.[31]
-
관상동맥 우회 이식술
-
관상동맥 바이패스 이식, 단일 바이패스
-
관상동맥 우회 이식, 이중 우회술.
-
관상동맥우회술, 삼중우회술
-
관상동맥우회술, 4중우회술
수술후관리
시술 후 환자는 일반적으로 중환자실(ICU)로 이송되며, 수술실에서 아직 시행되지 않은 경우에는 삽관이 제거됩니다. 대개 다음날까지 중환자실을 빠져나가고, 나흘 뒤 합병증이 발생하지 않으면 퇴원합니다.[32]
일련의 약물은 수술 후 초기 치료에 일반적으로 사용됩니다. 베타제인 도부타민은 심박출량을 증가시킬 수 있으며 수술 후 몇 시간 후에 투여됩니다. 베타 차단제는 심방세동 및 기타 심실상 부정맥을 예방하는 데 사용됩니다. 수술 중에 삽입된 양쪽 심방에 부착된 와이어를 고정하면 심방세동을 예방하는 데 도움이 될 수 있습니다. 아스피린(80mg)은 이식 실패를 예방하기 위해 사용됩니다.[32] 안지오텐신 전환 효소(ACE) 억제제 및 안지오텐신 수용체 차단제(ARBs)는 특히 심장 기능이 낮은 환자(<40%)에서 혈압을 조절하는 데 사용됩니다. 칼슘 통로 차단제인 암로디핀은 요골동맥이 이식재로 사용된 환자에게 사용됩니다.[2]
퇴원 후 환자는 불면증, 식욕부진, 성욕 저하, 기억력 문제 등을 경험할 수 있습니다. 이 효과는 일반적으로 일시적이며 6주에서 8주 동안 지속됩니다.[32] 맞춤형 운동 계획이 일반적으로 도움이 됩니다.[32]
결과.
CABG는 심각한 CAD로 인한 사망률을 줄이고 삶의 질을 향상시키는 가장 좋은 절차입니다.[33] 수술 사망률은 환자의 나이와 밀접한 관련이 있습니다. Eagle et al. 의 연구에 따르면 50-59세 환자의 수술 사망률은 1.8%인 반면 80세 이상 환자의 수술 사망률은 8.3%[34]입니다. 사망률을 높이는 다른 요인으로는 여성, 재수술, 좌심실 기능이상, 좌주질환 등이 있습니다.[34] CABG는 일반적으로 협심증을 완화하지만 일부 환자에서는 다시 발생합니다. 수술 후 10년이 지나면 60% 정도의 환자가 협심증이 없어집니다.[34] 심근경색은 CABG 후 5년이 지나면 드물지만 시간이 지날수록 위험도가 높아집니다.[35] CABG 환자의 돌연사 위험은 낮습니다.[35] 삶의 질 또한 최소 5년 동안 높아지다가 서서히 저하되기 시작할 수 있습니다.[36] 그러나 젊은 연령의 환자와 특정 동반 질환(당뇨병, 비만, 스테로이드 사용)이 없는 환자에게 양측 유방 동맥을 사용하면 우수한 장기 생존 및 삶의 질을 제공할 수 있습니다.
CABG의 유익한 효과는 심장 수준에서 명확합니다. 좌심실 기능이 향상되고 심장의 기능 부전(비능동적으로 움직이거나) 심지어 운동 부전(움직이지 않음)이 개선될 조짐을 보일 수 있습니다. 수축기 기능과 이완기 기능이 모두 개선되어 경우에 따라 최대 5년까지 계속 개선됩니다.[38] 운동 중 좌심실 기능과 심근 관류도 CABG 후 호전됩니다. 그러나 수술 전에 좌심실이 심하게 손상된 경우(박리율이 30% 미만), LV 기능이 향상됨에 따라 다른 매개변수가 개선될 수 있기 때문에 이점은 분절벽 이동 측면에서 덜 인상적이지만 여전히 중요합니다. 폐 고혈압이 완화되고 생존 기간이 길어질 수 있습니다.[38][39]
CABG를 받는 환자의 다양성 때문에 시술의 총 위험을 결정하는 것은 어렵습니다. 하위 그룹마다 위험이 다르지만 젊은 환자는 나이 든 환자보다 더 나은 결과를 봅니다. 한 개가 아닌 두 개의 내부 유선 동맥(IMA)을 사용하는 CABG는 CAD로부터 더 큰 보호 기능을 제공할 수 있지만 결과는 아직 결정적이지 않습니다.[34][40]
그라프트
CABG에 사용할 수 있는 도관은 동맥 또는 정맥일 수 있습니다. 동맥은 장기 지속성(확장성)이 우수하지만 실용성 때문에 정맥이 더 많이 사용됩니다.[41]
동맥 이식술은 흉골 가장자리 근처를 달리는 내부 흉부 동맥(ITA) 부분에서 비롯되며, 심장의 고유 목표 혈관에 쉽게 동원되고 문합될 수 있습니다. 왼쪽 동맥은 심장과 더 가깝기 때문에 가장 많이 사용되지만 환자와 외과의사의 선호도에 따라 오른쪽 동맥이 사용되기도 합니다. ITA는 내피 세포 때문에 유리합니다. 내피 세포는 내피 유래 이완 인자와 프로스타사이클린을 생성하여 동맥을 동맥경화로부터 보호하여 협착이나 폐색으로부터 보호합니다. 단점으로는 일부 환자의 하위 그룹(주로 비만 및 당뇨병 환자)에서 깊은 흉골 상처 감염과 같은 합병증 비율이 높습니다. 좌측 요골동맥과 좌측 위내시경동맥도 사용할 수 있습니다. 장기적인 인내는 사용되는 동맥의 종류와 심장 동맥 순환의 고유 요인에 의해 영향을 받습니다.[42]
사용되는 정맥은 대부분 큰 사구체 정맥이고 경우에 따라 작은 사구체 정맥입니다. 그들의 인내율은 동맥보다 낮습니다. 아스피린은 폐색으로부터 이식편을 보호합니다. 클로피도그렐을 추가해도 속도가 향상되지 않습니다.[42]
PCI와 비교하여
CABG와 PCI는 심장 동맥의 협착성 병변을 재혈관화하는 두 가지 방법입니다. 각 환자의 선호도는 여전히 논쟁의 여지가 있지만 복잡한 병변과 중요한 왼쪽 주 질환이 있는 경우 당뇨병 환자의 경우 CABG가 PCI보다 환자에게 더 나은 결과를 제공하는 것으로 보입니다.[11][10] CABG에 대한 강력한 징후에는 증상이 있는 환자와 LV 기능이 손상된 환자도 포함됩니다.[10]
합병증
CABG의 가장 흔한 합병증은 수술 후 출혈, 심부전, 심방세동(부정맥의 한 형태), 뇌졸중, 신장 기능 장애, 흉골 근처 상처의 감염입니다.[39]
수술 후 출혈의 경우 2~5%에서 발생하며 수술실로 복귀해야 할 [43]수도 있습니다. 가장 일반적인 지표는 수술 중에 삽입되어 흉부 튜브를 통해 배출되는 혈액의 양입니다. 출혈은 대동맥, 문합, 도관의 불충분하게 밀봉된 가지 또는 흉골에서 발생할 수 있습니다. 다른 원인으로는 혈소판 이상이나 응고에 실패하는 경우가 있는데, 아마도 수술 초기에 항응고제 헤파린을 투여하고 프로타민에 의해 중화된 후 혈액에 다시 나타날 때 발생하는 바이패스 또는 리바운드 헤파린 효과 때문일 것입니다.[44]
저심장출력증후군(LCOS)은 CABG 환자의 최대 14%에서 발생할 수 있습니다. LCOS는 중증도에 따라 inotropes, IABP(대동맥 내 풍선 펌프), 사전 부하 및 사후 부하의 최적화 또는 혈액 거즈 및 전해질의 보정으로 치료됩니다. 목표는 수축기 혈압을 90mmHg 이상으로 유지하고 심장 지수를 2.2L/min/m2 이상으로 유지하는 것입니다.[39] LCOS는 종종 일시적입니다.[43] 심근경색은 기술적 또는 환자별 요인으로 인해 수술 후에 발생할 수 있습니다. 정의가 다양하기 때문에 발생률을 추정하기 어렵지만 대부분의 연구에서는 발생률을 2%에서 5% 사이로 설정합니다. 발생률은 또한 격리된 CABG(평균, 4% 범위, 0.3%–10%)인지 아니면 복합 작업(평균, 2.0% 범위, 0.7%–12%)[45]인지에 따라 달라집니다. Q파 또는 초음파로 기록된 심장벽 움직임의 교대와 같은 새로운 심전도 기능이 대표적입니다. 진행 중인 허혈은 응급 혈관 조영술 및 PCI 또는 재수술을 유발할 수 있습니다.[46][43] 즉각적인 관상동맥 조영술은 진단뿐만 아니라 잠재적인 재해석에도 가장 신속한 촬영 방식을 제공합니다.[47] 심장 초음파 검사는 수술 후 심근 허혈의 발견이나 확인에 대한 가치가 떨어집니다.[48] 부정맥도 발생할 수 있는데, 가장 일반적인 심방세동(발생률 20-40%)은 전해질 균형 교정과 율동 조절로 치료됩니다.[43][39] 하지만 심실빈맥이나 세동과 같은 부정맥은 원인에 따라 치료되는 수술 후 심근허혈의 징후가 될 수 있습니다.[49]
CABG 후 환자의 약 1.5%에서 신경학적 부작용이 발생합니다.[43] 그들은 뇌졸중이나 혼수상태와 같은 제1형 결손 또는 CPB에 의한 섬망, 저관류 또는 뇌색전증과 같은 제2형 글로벌 결손으로 나타날 수 있습니다.[39] 퇴원 시 CABG 후 최대 80%에서 인지 장애가 보고되었으며 최대 40%에서 1년 동안 지속됩니다. 원인은 여전히 불분명합니다. CPB가 없는 CABG 환자에서도 펌프 밖 CABG와 PCI 환자와 마찬가지로 발병률이 동일하기 때문에 CPB는 가능성이 낮은 원인입니다.[39][40]
흉골의 상처 감염과 같은 감염은 황색포도상구균에 의해 가장 흔하게 발생하며 수술 후 과정을 복잡하게 할 수 있습니다. 흉골을 통한 혈액의 관류를 크게 저해하기 때문에 두 흉부 동맥의 채취는 위험 요소입니다.[39] 폐렴도 발생할 수 있습니다.[43] 위장관의 합병증은 설명되었으며 수술 중에 투여된 약물로 인한 것이 가장 일반적입니다.[40]
역사
CABG 전

20세기 초, 협심증을 완화하고 사망을 예방하기 위한 외과적 개입은 심장을 공급하는 교감신경 사슬의 절단인 교감신경절개술 또는 유착이 상당한 부수적 순환을 일으킬 것이라는 희망을 가지고 있었습니다. 교감신경 절제술은 실망스럽고 일관성 없는 결과를 낳았습니다.[51] 프랑스 외과의사 알렉시스 카렐은 개의 심장에 있는 고유 동맥에 경동맥의 한 갈래인 혈관을 문합한 최초의 사람이었지만, 실험을 재현할 수 없었습니다.[52] 20세기 중반에도 재관류 노력은 계속되었습니다. Beck C. S.는 경동맥 도관을 이용하여 하행 대동맥과 심장의 가장 큰 정맥인 관상동맥을 연결했습니다. "바인버그 절차"에서 아서 바인버그는 골격화된 LITA를 사용하여 LAD 옆에 만든 작은 터널에 넣고 자발적인 부수적 순환이 형성되기를 희망했습니다. 이것은 개 실험에서는 발생했지만 사람에게는 발생하지 않았습니다. Goetz RH는 1960년에 봉합사 없는 기술을 사용하여 ITA에서 LAD로 문합을 수행한 최초의 환자였습니다.[51]
1962년 메이슨 손스(Mason Sones)에 의해 관상동맥 조영술이 개발되면서 의사들은 수술이 필요한 환자를 확인하고, 어떤 고유의 심장 혈관을 우회해야 하는지 확인하는 데 도움이 되었습니다.[53] 1964년, 소련의 심장 외과 의사 바실리 콜레소프(Vasili Kolesov)는 최초의 성공적인 내흉동맥-관상동맥 문합술을 시행했고, 이어서 미국의 마이클 드베이키(Michael DeBakey)도 시행했습니다. 아르헨티나의 외과의사 르네 파발로로는 이 절차를 표준화했습니다. 그들의 발전은 CABG를 CAD 환자의 치료 표준으로 만들었습니다.[54]
CABG 시대
CABG의 현대 시대는 1964년 소련의 심장 외과 의사 바실리 콜레소프(Vasili Kolesov)가 최초로 성공적인 내흉동맥-관상동맥 문합술을 시행하면서 시작되었습니다. 같은 해 마이클 드베이키는 대동맥-관상동맥 우회술을 만들기 위해 사구체 정맥을 사용했습니다. 아르헨티나 출신의 외과의사 르네 파발로로는 환자의 무정맥을 이용한 CABG 기법을 발전시키고 표준화시켰습니다.[54]
수술 중 심장을 체포하는 것(심근통)의 도입으로 CABG는 훨씬 덜 위험해졌습니다. CABG의 주요 장애물은 심장이 정지된 상태에서 발생하는 허혈과 경색으로 외과의사가 원위부 문합을 구성할 수 있었습니다. 1970년대에는 칼륨계 심근통이 사용되었습니다. 심장마비는 심장의 산소 요구량을 최소화하여 허혈의 영향을 줄여줍니다. 1980년대에 심장통이 개선되면서 CABG는 위험도가 낮아졌고 수술 중 사망률이 낮아졌습니다.[55]
1960년대 후반 르네 파발로로의 수술 후, 수술은 몇몇 센터에서만 이루어졌지만, 관상동맥 질환의 결과를 더 광범위하게 바꿀 것으로 기대되었습니다. 1979년까지 미국에는 연간 114,000건의 시술이 있었습니다. PCI의 도입은 CABG를 소멸시키지 않았습니다. 두 절차의 속도는 계속 증가했지만 PCI는 더 빠르게 증가했습니다. 이후 수십 년 동안 CABG는 광범위하게 연구되었으며 PCI와 비교되었습니다. PCI에 비해 CABG의 장점이 뚜렷하지 않았기 때문에 2000년까지 일부 국가(미국 등)에서 CABG의 수가 약간 감소했습니다. 유럽에서는, 주로 독일에서는,CABG는 점점 더 많이 수행되었습니다. 2023년[update] 현재 두 기법을 비교하는 연구가 계속되고 있습니다.[56] 2023년에 발표된 메타 분석에 따르면 CABG는 약물 용출 스텐트(DES)로 PCI보다 일관된 생존 이점을 제공합니다.
Favaloro의 작업은 이식 선택의 역사의 기본입니다. 그는 정맥 이식보다 우수한 양방향 ITA 사용을 확립했습니다. 외과의사들은 비장, 위장 장간막, 비갑하 등 다른 동맥 이식편의 사용을 조사했지만 ITA의 인내율과 일치하는 것은 없었습니다. 1971년 카르펜티어는 처음에는 실패하기 쉬웠던 요골동맥의 사용법을 도입했지만, 그 후 20년 동안의 수확 기술의 발전으로 인내력이 크게 향상되었습니다.[58]
다른 동물들
CABG의 개발을 위해 돼지, 양, 개가 실험 모델로 사용되었습니다.[59] 병든 동물을 치료하기 위해 CABG를 수행하는 것은 매우 드문 일입니다.
참고 항목
참고문헌
- ^ Al-Atassi et al. 2016, pp. 1553–1554.
- ^ a b c d Al-Atassi et al. 2016, p. 1554.
- ^ a b Kouchoukos et al. 2013, p. 405.
- ^ a b Kouchoukos et al. 2013, p. 356.
- ^ a b Kouchoukos et al. 2013, p. 357.
- ^ 보자르 2021, 4~9쪽.
- ^ 보자르 2021, 7-10쪽.
- ^ a b Smith & Schroder 2016, 페이지 549.
- ^ Al-Atassi et al. 2016, p. 1556.
- ^ a b c d e Kouchoukos et al. 2013, p. 409.
- ^ a b 2022년, 185~186쪽.
- ^ Persson, J; Yan, J; Angerås, O; Venetsanos, D; Jeppsson, A; Sjögren, I; Linder, R; Erlinge, D; Ivert, T; Omerovic, E (8 June 2023). "PCI or CABG for left main coronary artery disease: the SWEDEHEART registry". European Heart Journal. 44 (30): 2833–2842. doi:10.1093/eurheartj/ehad369. PMC 10406339. PMID 37288564.
- ^ Farina, Gaudino & Taggart 2020, pp. 1 & 6.
- ^ Farina, Gaudino & Taggart 2020, pp. 1-2.
- ^ Ngu, Sun & Ruel 2018, pp. 527–531.
- ^ Farina, Gaudino & Taggart 2020, pp. 4-5.
- ^ Ngu, Sun & Ruel 2018, pp. 529.
- ^ Fearon et al. 2022, pp. 128–129.
- ^ Persson, J; Yan, J; Angerås, O; Venetsanos, D; Jeppsson, A; Sjögren, I; Linder, R; Erlinge, D; Ivert, T; Omerovic, E (8 June 2023). "PCI or CABG for left main coronary artery disease: the SWEDEHEART registry". European Heart Journal. 44 (30): 2833–2842. doi:10.1093/eurheartj/ehad369. PMC 10406339. PMID 37288564.
- ^ a b Al-Atassi et al. 2016, 수술 기법.
- ^ a b c d e f g h i Kouchoukos et al. 2013, p. 367.
- ^ "Coronary Artery Bypass - MeSH - NCBI". www.ncbi.nlm.nih.gov. Retrieved 27 November 2023.
- ^ "Coronary Artery Bypass Grafting - What Is Coronary Artery Bypass Grafting? NHLBI, NIH". www.nhlbi.nih.gov. 24 March 2022. Retrieved 27 November 2023.
- ^ Al-Atassi et al. 2016, p. 1562.
- ^ a b Al-Atassi et al. 2016, p. 1564.
- ^ Kouchoukos et al. 2013, pp. 374–376.
- ^ Al-Atassi et al. 2016, p. 1563.
- ^ Kouchoukos et al. 2013, p. 348.
- ^ Kouchoukos et al. 2013, p. 386.
- ^ Mick et al. 2016, pp. 1603–1605.
- ^ Mick et al. 2016, pp. 1606–1608.
- ^ a b c d Kouchoukos et al. 2013, p. 387.
- ^ Kouchoukos et al. 2013, pp. 404–405.
- ^ a b c d Kouchoukos et al. 2013, p. 388.
- ^ a b Kouchoukos et al. 2013, p. 397.
- ^ Kouchoukos et al. 2013, p. 399.
- ^ Sef, D; Raja, SG (February 2021). "Bilateral internal thoracic artery use in coronary artery bypass grafting in the post-ART era – Perspective". International Journal of Surgery (London, England). 86: 1–4. doi:10.1016/j.ijsu.2020.12.007. PMID 33388437. S2CID 230488630.
- ^ a b Kouchoukos et al. 2013, p. 401.
- ^ a b c d e f g Al-Atassi et al. 2016, 결과
- ^ a b c Smith & Schroder 2016, 566쪽.
- ^ Al-Atassi et al. 2016, pp. 1561.
- ^ a b Kouchoukos et al. 2013, p. 403.
- ^ a b c d e f Smith & Schroder 2016, 페이지 565.
- ^ Al-Atassi et al. 2016, 1569.
- ^ Robinson, NB; Sef, D; Gaudino, M; Taggart, DP (February 2023). "Postcardiac surgery myocardial ischemia: Why, when, and how to intervene". The Journal of Thoracic and Cardiovascular Surgery. 165 (2): 687–695. doi:10.1016/j.jtcvs.2021.05.052. PMID 34556355. S2CID 237616162.
- ^ Robinson, NB; Sef, D; Gaudino, M; Taggart, DP (February 2023). "Postcardiac surgery myocardial ischemia: Why, when, and how to intervene". The Journal of Thoracic and Cardiovascular Surgery. 165 (2): 687–695. doi:10.1016/j.jtcvs.2021.05.052. PMID 34556355. S2CID 237616162.
- ^ Robinson, NB; Sef, D; Gaudino, M; Taggart, DP (February 2023). "Postcardiac surgery myocardial ischemia: Why, when, and how to intervene". The Journal of Thoracic and Cardiovascular Surgery. 165 (2): 687–695. doi:10.1016/j.jtcvs.2021.05.052. PMID 34556355. S2CID 237616162.
- ^ Laflamme, M; DeMey, N; Bouchard, D; Carrier, M; Demers, P; Pellerin, M; Couture, P; Perrault, LP (April 2012). "Management of early postoperative coronary artery bypass graft failure". Interactive Cardiovascular and Thoracic Surgery. 14 (4): 452–6. doi:10.1093/icvts/ivr127. PMC 3309816. PMID 22223760.
- ^ Sef, D; Szavits-Nossan, J; Predrijevac, M; Golubic, R; Sipic, T; Stambuk, K; Korda, Z; Meier, P; Turina, MI (2019). "Management of perioperative myocardial ischaemia after isolated coronary artery bypass graft surgery". Open Heart. 6 (1): e001027. doi:10.1136/openhrt-2019-001027. PMC 6519404. PMID 31168389.
- ^ Al-Atassi et al. 2016, p. 1552.
- ^ a b Head et al. 2013, pp. 2862–2863.
- ^ Al-Atassi et al. 2016, p. 1551.
- ^ Head et al. 2013, p. 2862.
- ^ a b Head et al. 2013, p. 2863.
- ^ Head et al. 2013, p. 2865.
- ^ Head et al. 2013, pp. 2863–2865.
- ^ Urso, S; Sadaba, R; González-Martín, JM; Dayan, V; Nogales, E; Tena, MÁ; Abad, C; Portela, F (30 March 2023). "Coronary surgery provides better survival than drug-eluting stent: A pooled meta-analysis of Kaplan- Meier-derived individual patient data". The Journal of Thoracic and Cardiovascular Surgery. doi:10.1016/j.jtcvs.2023.03.020. PMID 37001801. S2CID 257868518.
- ^ Head et al. 2013, p. 2868.
- ^ Connolly 2001, 페이지 1.
- ^ 코르도바 2020.
원천
- Al-Atassi, Talal; Toeg, Hadi D.; Chan, Vincent; Ruel, Marc (2016). "Coronary Artery Bypass Grafting". In Frank Sellke; Pedro J. del Nido (eds.). Sabiston and Spencer Surgery of the Chest. ISBN 978-0-323-24126-7.
- Bojar, R.M. (2021). Manual of Perioperative Care in Adult Cardiac Surgery. Wiley. ISBN 978-1-119-58255-7. Retrieved 2022-10-26.
- Connolly, John E. (2001-03-25). "The Development of Coronary Artery Surgery: Personal Recollections". Texas Heart Institute Journal. 29 (1): 10–14. PMC 101261. PMID 11995842.
- Cordova, Melanie Greaver (2020-05-05). "Veterinarians, MDs team up for canine open-heart surgery". Cornell Chronicle. Retrieved 2023-08-24.
- Farina, Piero; Gaudino, Mario Fulvio Luigi; Taggart, David Paul (2020). "The Eternal Debate With a Consistent Answer: CABG vs PCI". Seminars in Thoracic and Cardiovascular Surgery. Elsevier BV. 32 (1): 14–20. doi:10.1053/j.semtcvs.2019.08.009. ISSN 1043-0679. PMID 31442489. S2CID 201632303.
- Fearon, William F.; Zimmermann, Frederik M.; De Bruyne, Bernard; Piroth, Zsolt; van Straten, Albert H.M.; Szekely, Laszlo; Davidavičius, Giedrius; Kalinauskas, Gintaras; Mansour, Samer; Kharbanda, Rajesh; Östlund-Papadogeorgos, Nikolaos; Aminian, Adel; Oldroyd, Keith G.; Al-Attar, Nawwar; Jagic, Nikola; Dambrink, Jan-Henk E.; Kala, Petr; Angerås, Oskar; MacCarthy, Philip; Wendler, Olaf; Casselman, Filip; Witt, Nils; Mavromatis, Kreton; Miner, Steven E.S.; Sarma, Jaydeep; Engstrøm, Thomas; Christiansen, Evald H.; Tonino, Pim A.L.; Reardon, Michael J.; Lu, Di; Ding, Victoria Y.; Kobayashi, Yuhei; Hlatky, Mark A.; Mahaffey, Kenneth W.; Desai, Manisha; Woo, Y. Joseph; Yeung, Alan C.; Pijls, Nico H.J. (2022-01-13). "Fractional Flow Reserve–Guided PCI as Compared with Coronary Bypass Surgery". New England Journal of Medicine. Massachusetts Medical Society. 386 (2): 128–137. doi:10.1056/nejmoa2112299. ISSN 0028-4793. PMID 34735046. S2CID 242940936.
- Head, S. J.; Kieser, T. M.; Falk, V.; Huysmans, H. A.; Kappetein, A. P. (2013-10-01). "Coronary artery bypass grafting: Part 1—the evolution over the first 50 years". European Heart Journal. Oxford University Press (OUP). 34 (37): 2862–2872. doi:10.1093/eurheartj/eht330. ISSN 0195-668X. PMID 24086085.
- Smith, Peter K.; Schroder, Jacob N. (2016). "On-Pump Coronary Artery Bypass Grafting". In Josef E. Fischer (ed.). Master Techniques in Surgery CARDIAC SURGERY. Wolters Kluwer. ISBN 9781451193534.
- Kouchoukos, Nicholas; Blackstone, E. H.; Hanley, F. L.; Kirklin, J. K. (2013). Kirklin/Barratt-Boyes Cardiac Surgery E-Book (4th ed.). Elsevier. ISBN 978-1-4160-6391-9.
- Mick, Stephanie; Keshavamurthy, Suresh; Mihaljevicl, Tomislav; Bonatti, Johannes (2016). "Robotic and Alternative Approaches to Coronary Artery Bypass Grafting". In Frank Sellke; Pedro J. del Nido (eds.). Sabiston and Spencer Surgery of the Chest. pp. 1603–1615. ISBN 978-0-323-24126-7.
- Ngu, Janet M. C.; Sun, Louise Y.; Ruel, Marc (2018). "Pivotal contemporary trials of percutaneous coronary intervention vs. coronary artery bypass grafting: a surgical perspective". Annals of Cardiothoracic Surgery. AME Publishing Company. 7 (4): 527–532. doi:10.21037/acs.2018.05.12. ISSN 2225-319X. PMC 6082775. PMID 30094218.
- Welt, Frederick G.P. (2022-01-13). "CABG versus PCI — End of the Debate?". New England Journal of Medicine. Massachusetts Medical Society. 386 (2): 185–187. doi:10.1056/nejme2117325. ISSN 0028-4793. PMID 35020989. S2CID 245907473.
외부 링크
- 로튼 JS, 타미스 홀랜드 JE, 방갈로르 S, 베이츠 ER, 베키 TM, 비스코프 JM, 비틀 JM, 코헨 MG, 디마이오 JM, 돈 CW, 프레메스 SE, 가우디노 MF, 골드버거 ZD, 그랜트 MC, 자스왈 JB, 쿠를란스키 PA, 메란 R, 메트쿠스 TS Jr, 은나체타 LC, 라오 SV, 셀케 FW, 샤르마 G, 용 CM, 위셴버거 BA. 2021 관상동맥 재관류술에 대한 ACC/AHA/SCAI 가이드라인: 미국심장학회/미국심장학회 임상진료지침 공동위원회 보고서. 잼 콜 카디올. 2022;79:e21-e129