공동활성화기(유전자)
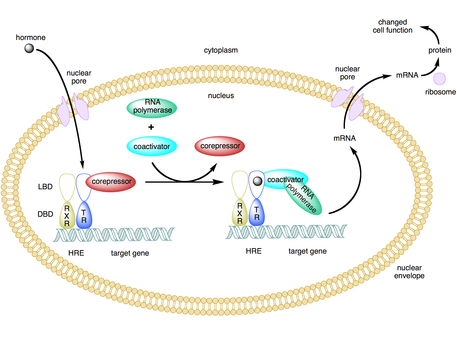
Coactivator (genetics)공동활성화기는 유전자나 유전자 집합의 전사율을 높이기 위해 활성제(전사 계수)에 결합하는 전사적 코어조화기의 일종이다.[1] 활성제는 DNA 촉진자 사이트 또는 엔핸서라고 불리는 특정 DNA 규제 순서에 바인딩되는 DNA 결합 도메인을 포함한다.[2][3] 활성화-활성화 복합체를 결합하면 촉진자에게 일반 전사 기계를 채용하여 전사 속도가 빨라져 유전자 발현이 증가한다.[3][4][5] 활성제와 공동 활성제의 사용은 세포 유형과 발달 단계에 따라 특정 유전자의 고도로 구체적인 발현을 가능하게 한다.[2]
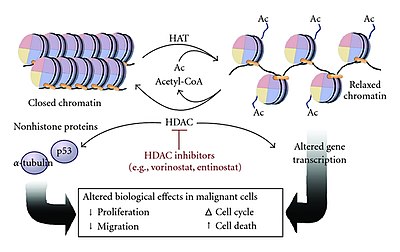
일부 공동활성화기는 히스톤 아세틸전달효소(HAT) 활동도 한다. HATs는 N단자 히스톤 꼬리를 아세틸화함으로써 히스톤과 DNA의 연관성을 약화시키는 큰 다단백질 복합체를 형성한다. 이것은 전사 기계가 발기인과 결합할 수 있는 더 많은 공간을 제공하므로 유전자 발현이 증가한다.[1][4]
활성제는 모든 살아있는 유기체에서 발견되지만, 공동활성제 단백질은 더 복잡하고 유전자 조절을 위한 더 복잡한 메커니즘이 필요하기 때문에 일반적으로 진핵생물에서만 발견된다.[1][4] eukaryotes에서 coactivator는 보통 핵에 국부화된 단백질이다.[1][6]
메커니즘
일부 공동활성화자는 활동체에 결합하고 그에 따라 활동자가 DNA 증진제 또는 촉진자 순서에 결합할 수 있는 순응적 변화를 유도하여 유전자 발현을 간접적으로 규제한다.[2][7][8] 활성제-활성화제 복합체가 엔한서에 결합되면 RNA 중합효소 II와 기타 일반 전사 기계들이 DNA에 포집되어 전사가 시작된다.[9]
히스톤 아세틸전달효소
핵 DNA는 보통 히스톤을 중심으로 단단히 감싸고 있어 전사 기계가 DNA에 접근하기 어렵거나 불가능하다. 이 연관성은 주로 DNA 인산염 백본은 음전하를 띠며 히스톤에는 양전하를 띠는 라이신 잔류물이 풍부하기 때문에 DNA와 히스톤 사이의 정전기 흡인력에 기인한다.[10] 촘촘한 DNA-히스토네이션은 DNA가 RNA로 전이되는 것을 막는다.
많은 공동활성화기는 히스톤의 N단자 꼬리에 있는 특정 라이신 잔류물을 아세톤 아세틸트랜스퍼레이즈(HAT) 활동을 한다.[4][7][11] 이 방법에서 활성제는 엔핸서 사이트에 결합하고, 양성 충전된 라이신 잔류물을 중화시켜 핵산촉자 결합 히스톤을 아세틸화시키는 HAT 복합체를 모집한다.[7][11] 이러한 전하중화 작용은 히스톤이 음전하 DNA에 약하게 결합하게 하여, 염색체 구조를 완화시켜, 다른 전사 계수나 전사 기구가 발기인에 결합할 수 있게 한다(전사 개시).[4][11] HAT 콤플렉스에 의한 아세틸화는 또한 연화 과정 내내 염색질을 개방적으로 유지시켜 전사 속도를 증가시키는 데 도움을 줄 수 있다.[4]
N단자 히스톤 꼬리의 아세틸화는 진핵생물에서 발견되는 가장 흔한 단백질 변형 중 하나로, 전체 인간 단백질의 약 85%가 아세틸화된다.[12] 아세틸화는 단백질과 RNA 성분의 합성, 안정성, 기능, 조절 및 국산화 등에 매우 중요하다.[11][12]
HATs는 N-단말 아세틸트랜스퍼레이즈(N-terminal 아세틸트랜스퍼레이즈)와 유사하게 기능하지만, 그 아세틸화는 NAT과 달리 되돌릴 수 있다.[13] HAT 매개 히스톤 아세틸화는 리신 잔류물의 가수분해를 촉진하는 히스톤 디액테틸레이스(HDAC)를 사용하여 역행하여 히스톤에서 아세틸 그룹을 제거한다.[4][7][11] 이로 인해 염색질이 이완된 상태에서 다시 클로즈업되어 전사기계가 발기인과 결합하기 어려워져 유전자 발현을 억제하게 된다.[4][7]
HAT 활동을 표시하는 공동 활성제의 예로는 CARM1, CBP 및 EP300이 있다.[14][15]
코어프레스
많은 공동활성화기는 특정 상황에서 코어 압축기 역할도 한다.[5][9] TAF1과 BTAF1과 같은 공동 인자에서는 활성제(공동 활성제 역할을 함)가 있는 상태에서 전사를 시작하고 활성제(핵심 압축기 역할을 함)가 없는 경우 기저 전사를 억제할 수 있다.[9]
의의
생물학적 의의
전사 조절은 유기체가 유전자 발현을 변화시키는 가장 흔한 방법 중 하나이다.[16] 활성화와 공동 활성화의 사용은 단백질이 언제, 어디서, 얼마나 생산되는지에 대한 더 큰 통제를 가능하게 한다.[1][7][16] 이를 통해 각 세포는 환경적 또는 생리학적 변화에 신속하게 대응할 수 있으며, 달리 규제되지 않은 경우 발생할 수 있는 손상을 완화하는 데 도움이 된다.[1][7]
관련 장애
공동활성화 유전자에 대한 돌연변이는 선천적 결함, 암(특히 호르몬 의존성 암), 신경 발달 장애, 지적 장애(ID)[17][5]와 같은 질병과 질환과 연관되어 있다. 공동 활성제의 과다 또는 과소표현을 초래하는 조절장애는 많은 약물(특히 항호르몬제)과 손상적으로 상호작용할 수 있으며 암, 생식력 문제, 신경발달 및 신경정신과 질환에 관련되어 있다.[5] 구체적인 예를 들면 중추신경계(CNS), 생식계, 흉선, 신장 내 수많은 전사 인자의 공동 활성제 역할을 하는 CREB결합단백질(CBP)의 잘못된 조절은 헌팅턴병, 백혈병, 루빈스타인-타이비 증후군, 신경발달장애 및 면역시신경의 결손과 관련이 있다.줄기, 조혈모양, 골격근 기능.[14][18]
약물 표적으로
공동 활성제는 많은 다른 장애들과 함께 암, 대사 장애, 심혈관 질환, 제2형 당뇨병의 치료에서 약물 치료의 유망한 대상이다.[5][19] 예를 들어, 스테로이드 수용체 공동활성제(SCR) NCOA3는 유방암에서 과다압축되는 경우가 많기 때문에 이 공동활성제를 대상으로 하여 그 발현을 감소시키는 억제제 분자의 발달이 유방암의 잠재적 치료제로 사용될 수 있다.[15][20]
전사 요인은 많은 다른 생물학적 과정을 제어하기 때문에 약물 치료의 이상적인 대상이다.[14][21] 이를 규제하는 공동활성제는 유전자 발현 증가나 감소를 조절할 수 있는 합성 리간드로 쉽게 대체할 수 있다.[14]
추가적인 기술 발전은 전체 조직 수준에서 공동 활성제의 기능과 규제에 대한 새로운 통찰력을 제공하고 인간 질병에 대한 그들의 역할을 설명할 것이며, 이것은 향후 약물 치료의 더 나은 목표를 제공할 것으로 희망한다.[14][15]
알려진 공동 활성화자
지금까지 알려진 300개 이상의 코어게이터가 있다.[15] 이러한 공동활성화기의 예는 다음과 같다.[22]
- ARA54 표적 안드로겐 수용체
- ATXN7L3는 핵수용체 슈퍼 패밀리의 여러 구성원을 대상으로 한다.
- BCL3 대상 9-cis 레티노산 수용체(RXR)
- CBP는 많은 전사 요인을 대상으로 한다.
- CDC25B 대상 스테로이드 수용체
- COPS5는 여러 핵 수용체를 대상으로 한다.
- DDC 대상 안드로겐 수용체
- EP300은 많은 전사 요인을 대상으로 한다.
- KAT5는 많은 핵수용체를 대상으로 한다.
- KDM1A 표적 안드로겐 수용체
- 스테로이드 수용체 공동활성화기(SRC) 제품군
참고 항목
참조
- ^ a b c d e f Courey AJ (2008). Mechanisms in transcriptional regulation. Malden, MA: Blackwell. ISBN 978-1-4051-0370-1. OCLC 173367793.
- ^ a b c "General transcription factor / transcription factor". Learn Science at Scitable. Retrieved 2017-11-29.
- ^ a b Pennacchio LA, Bickmore W, Dean A, Nobrega MA, Bejerano G (April 2013). "Enhancers: five essential questions". Nature Reviews Genetics. 14 (4): 288–95. doi:10.1038/nrg3458. PMC 4445073. PMID 23503198.
- ^ a b c d e f g h Brown CE, Lechner T, Howe L, Workman JL (January 2000). "The many HATs of transcription coactivators". Trends in Biochemical Sciences. 25 (1): 15–9. doi:10.1016/S0968-0004(99)01516-9. PMID 10637607.
- ^ a b c d e Kumar R, O'Malley BW (2008). NR coregulators and human diseases. Hackensack, N.J.: World Scientific. ISBN 978-981-270-536-5. OCLC 261137374.
- ^ Vosnakis N, Koch M, Scheer E, Kessler P, Mély Y, Didier P, Tora L (September 2017). "Coactivators and general transcription factors have two distinct dynamic populations dependent on transcription". The EMBO Journal. 36 (18): 2710–2725. doi:10.15252/embj.201696035. PMC 5599802. PMID 28724529.
- ^ a b c d e f g Spiegelman BM, Heinrich R (October 2004). "Biological control through regulated transcriptional coactivators". Cell. 119 (2): 157–67. doi:10.1016/j.cell.2004.09.037. PMID 15479634. S2CID 14668705.
- ^ Scholes NS, Weinzierl RO (May 2016). "Molecular Dynamics of "Fuzzy" Transcriptional Activator-Coactivator Interactions". PLOS Computational Biology. 12 (5): e1004935. Bibcode:2016PLSCB..12E4935S. doi:10.1371/journal.pcbi.1004935. PMC 4866707. PMID 27175900.
- ^ a b c Thomas MC, Chiang CM (May 2006). "The general transcription machinery and general cofactors". Critical Reviews in Biochemistry and Molecular Biology. 41 (3): 105–78. CiteSeerX 10.1.1.376.5724. doi:10.1080/10409230600648736. PMID 16858867. S2CID 13073440.
- ^ Decher, Gero (1997-08-29). "Fuzzy Nanoassemblies: Toward Layered Polymeric Multicomposites". Science. 277 (5330): 1232–1237. doi:10.1126/science.277.5330.1232. ISSN 0036-8075.
- ^ a b c d e Hermanson O, Glass CK, Rosenfeld MG (2002). "Nuclear receptor coregulators: multiple modes of modification". Trends in Endocrinology and Metabolism. 13 (2): 55–60. doi:10.1016/s1043-2760(01)00527-6. PMID 11854019. S2CID 38649132.
- ^ a b Van Damme P, Hole K, Pimenta-Marques A, Helsens K, Vandekerckhove J, Martinho RG, Gevaert K, Arnesen T (July 2011). "NatF contributes to an evolutionary shift in protein N-terminal acetylation and is important for normal chromosome segregation". PLOS Genetics. 7 (7): e1002169. doi:10.1371/journal.pgen.1002169. PMC 3131286. PMID 21750686.
- ^ Starheim KK, Gevaert K, Arnesen T (April 2012). "Protein N-terminal acetyltransferases: when the start matters". Trends in Biochemical Sciences. 37 (4): 152–61. doi:10.1016/j.tibs.2012.02.003. PMID 22405572.
- ^ a b c d e Lonard DM, O'Malley BW (October 2012). "Nuclear receptor coregulators: modulators of pathology and therapeutic targets". Nature Reviews. Endocrinology. 8 (10): 598–604. doi:10.1038/nrendo.2012.100. PMC 3564250. PMID 22733267.
- ^ a b c d Hsia EY, Goodson ML, Zou JX, Privalsky ML, Chen HW (October 2010). "Nuclear receptor coregulators as a new paradigm for therapeutic targeting". Advanced Drug Delivery Reviews. 62 (13): 1227–37. doi:10.1016/j.addr.2010.09.016. PMC 5004779. PMID 20933027.
- ^ a b "Enhancer". Learn Science at Scitable. Retrieved 2017-11-29.
- ^ Berk A, Zipursky SL, Matsudaira PT, Baltimore D, Darnell J (2000). Lodish HF (ed.). Molecular Cell Biology (4th ed.). New York: W.H. Freeman. ISBN 978-0-7167-3136-8. OCLC 41266312.
- ^ Becnel LB, Darlington YF, Orechsner S, Easton-Marks J, Watkins CA, McOwiti A, Kankanamge WH, Dehart M, Silva CM. "CBP". NURSA Molecules. doi:10.1621/8egsudafco.
- ^ "Nuclear Receptors". courses.washington.edu. Retrieved 2017-11-29.
- ^ Tien JC, Xu J (November 2012). "Steroid receptor coactivator-3 as a potential molecular target for cancer therapy". Expert Opinion on Therapeutic Targets. 16 (11): 1085–96. doi:10.1517/14728222.2012.718330. PMC 3640986. PMID 22924430.
- ^ Sladek FM (October 2003). "Nuclear receptors as drug targets: new developments in coregulators, orphan receptors and major therapeutic areas". Expert Opinion on Therapeutic Targets. 7 (5): 679–84. doi:10.1517/14728222.7.5.679. PMID 14498828. S2CID 16891519.
- ^ "NURSA - Molecules". nursa.org. Retrieved 2017-11-30.
외부 링크
- 원자력 수용체 신호 전달 아틀라스(NIH 지원 연구 컨소시엄 및 데이터베이스, 개방형 액세스 PubMed-indexed 저널, 핵 수용체 신호 전달 포함)
- TCOF - 단백질 상호 작용하는 전사 공동 인자 및 전사 인자의 드래곤 데이터베이스