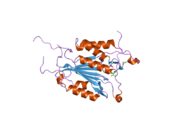
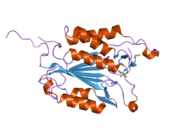
카스파제3길
Caspase 3Caspase-3는 Caspase-8과 Caspase-9와 상호작용하는 Caspase 단백질이다.그것은 CASP3 유전자에 의해 암호화된다.CASP3 정형외과들은[4] 완전한 게놈 데이터를 이용할 수 있는 수많은 포유류에서 확인되었다.새, 도마뱀, 리삼피비아인, 텔레오스트에도 독특한 직교자가 존재한다.
CASP3 단백질은 시스테인-아스파르트산프로테아제(caspase) 계열의 성분이다.[5]캐스퍼스의 순차적 활성화는 세포사멸의 실행단계에서 중심적인 역할을 한다.캐스파아제는 활성 효소를 형성하기 위해 조광하는 크고 작은 두 개의 서브유닛을 생성하기 위해 보존된 아스파르트 잔류물에서 단백질 분해 처리를 거치는 비활성 프로엔자임으로 존재한다.이 단백질은 6, 7번 가스를 분해하고 활성화하며, 단백질 자체는 8, 9, 10번 가스를 통해 처리되고 활성화된다.알츠하이머병에서 뉴런 사망과 관련이 있는 아밀로이드-베타 4A 전구단백질의 갈라짐과 관련된 주요 캐스파아제다.[6]이 유전자의 대체적인 스플라이싱은 동일한 단백질을 인코딩하는 두 가지 대본 변형을 초래한다.[7]
 TNF-R1의 신호 경로.점선 회색 선은 여러 단계를 나타냄 |  Caspase 3 활성화로 이어지는 경로.[8] |
Caspase-3는 현재 알려진 모든 캐스페이스에 공통적인 많은 전형적인 특징을 공유한다.예를 들어, 그것의 활성 부위는 특정 4-아미노산 염기서열의 일부일 때 아스파르산의 카르복시-단자측으로 단백질 염기서열의 펩타이드 결합분리를 안정화하는 시스테인 잔류물(Cys-163)과 히스티딘 잔류물(His-121)을 함유하고 있다.[9][10]이러한 특수성으로 인해 캐스파이스는 글루탐산보다 아스파르트산을 2만배 더 선호하기 때문에 믿을 수 없을 정도로 선택적일 수 있다.[11]세포 내 캐스파이스의 주요 특징은 생화학적 변화가 활성화의 원인이 될 때까지 활동이 뜸한 지모균, 일명 프로스파이스로 존재한다는 것이다.각 프로스파아제는 약 20 kDa의 N-단자 대형 서브 유닛을 가지고 있고, 각각 p20과 p10이라고 불리는 약 10 kDa의 작은 서브 유닛을 가지고 있다.[12]
기질특성
정상적인 상황에서 캐스파아제는 아스파르트산 잔류물 후 기판 및 가수 분해 펩타이드 결합에 대한 사트라펩타이드 시퀀스를 인식한다.카스파제3와 카스파제7은 테트라펩타이드 모티브인 Asp-x-Asp를 인식해 기질특성이 유사하다.[13]C-단자 아스프는 절대적으로 필요한 반면 다른 3개 포지션에서의 변화는 용인될 수 있다.[14]카스파제 기질 특이성은 카스파제 기반 억제제 및 약물 설계에 널리 사용되어 왔다.[15]
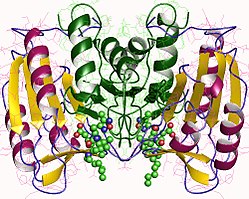
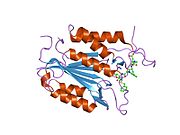
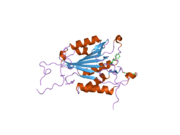
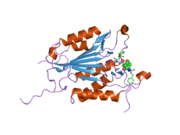
구조
특히 Caspase-3(CPP32/Yama/apopain이라고도 함)[16][17][18]는 17 kDa와 12 kDa 서브유닛으로 분할된 32 kDa zimogen에서 형성된다.프로스파아제가 특정 잔류물에서 분해되면 활성 헤테로테트라머는 소수성 상호작용에 의해 형성되어 p17의 4개 반병행 베타시트, p12의 2개가 합쳐져 헤테로디머를 만들게 되고, 이는 다시 다른 헤테로디머와 상호 작용하여 12 가닥의 베타시트 구조를 이루게 된다.캐스페이스 특유의 [12][19]알파-알파벳헤테로디머가 서로 머리를 맞대고 정렬할 때, p17(더 큰) 하위 유닛에서 필요한 Cys-163과 His-121 잔여물이 발견되지만, 활성 부위는 두 하위 유닛의 잔류물로 형성된 분자의 양쪽 끝에 위치한다.[19]
메커니즘
카스파제-3의 촉매 부위는 시스-163의 황하이드릴 그룹과 히스-121의 이미다졸 링을 포함한다.His-121은 주요 아스파리트 잔여물의 카보닐 그룹을 안정화시키는 반면, Cys-163은 펩타이드 결합을 궁극적으로 분리하기 위해 공격한다.또한 Cys-163과 글리-238은 수소 결합을 통해 기질-엔자임 복합체의 사면 전환 상태를 안정시키는 기능을 한다.[19]시험관내에서는 카스파제-3가 두 번째 아스파르트산 잔류물(D와 G 사이)의 카르복시 측에서 갈라짐 현상이 발생하는 펩타이드 시퀀스 DEVDG(Asp-Glu-Val-Ap-Gly)를 선호하는 것으로 밝혀졌다.[11][19][20]Caspase-3는 다른 많은 실행자 캐스페이스보다 약간 높은(더 기본적인) 넓은 pH 범위에 걸쳐 활성화된다.이 넓은 범위는 카스파제-3가 정상 세포 조건과 세포 사멸 조건에서 완전히 활성화됨을 나타낸다.[21]
활성화
Caspase-3는 세포외(죽음의 리간드) 경로와 내성(미토콘드리아) 경로에 의해 모두 세포외에서 활성화된다.[12][22]카스파아제-3의 지모겐 기능은 규제를 받지 않으면, 카스파아제 활동이 세포를 무차별적으로 죽일 수 있기 때문에 필요하다.[23]실행자 캐스파아제로서, caspase-3 zimogen은 세포외 신호 이벤트가 발생한 후 개시자 캐스파아제에 의해 분해될 때까지 사실상 활동이 없다.[24]그러한 신호 이벤트 중 하나는 초기자 캐스파이스를 활성화할 수 있는 granzyme B를 킬러 T세포에 의한 사멸을 목표로 하는 세포에 도입하는 것이다.[25][26]그리고 나서 이 외적 활성화는 카스파제-3가 지배적인 역할을 하는 세포외 경로의 홀마크 캐스파제 캐스케이드 특성을 촉발한다.[10]내인성 활성화에서 미토콘드리아의 시토크롬 c는 카스파제-9, 사멸-활성화 인자 1(Apaf-1) 및 ATP와 결합하여 프로스파제-3를 처리한다.[20][26][27]이 분자들은 체외에서 카스파제-3를 활성화시키기에 충분하지만, 체내에서는 다른 조절 단백질이 필요하다.[27]망고스틴(Garcinia Mangostana) 추출물이 B-amyloid 처리된 인간 신경세포에서 카스파제 3의 활성화를 억제하는 것으로 나타났다.[28]
억제
카스파제 억제수단의 하나는 c-IAP1, c-IAP2, XIAP, ML-IAP를 포함하는 IAP(사멸 억제수) 단백질 제품군을 통해서이다.[19] XIAP는 실행자 카스파제-3의 활성화에 직접 관여하는 개시자 카스파제-9를 결합하고 억제한다.[27]그러나 캐스파제 캐스파제 3은 특정 현장에서 캐스파제 9를 분리하여 XIAP 활동을 억제하는 기능을 수행하므로, XIAP가 캐스파제 9 활동을 억제하기 위해 바인딩할 수 없게 된다.[29]
상호작용
Caspase 3은 다음과 상호작용하는 것으로 나타났다.
생물 함수
카스파제-3는 정상적인 뇌 발달은 물론 염색질 응축과 DNA 파편화를 담당하는 세포사멸의 전형적인 역할에도 필요한 것으로 밝혀졌다.[20]혈류에서 카스파제-3, p17의 파편 수치가 높아진 것은 최근 심근경색의 징후다.[51]현재 카스파제-3가 배아 및 조혈모세포 분화에 역할을 할 수 있다는 것이 보여지고 있다.[52]
참고 항목
참조
- ^ a b c GRCm38: 앙상블 릴리스 89: ENSMUSG000031628 - 앙상블, 2017년 5월
- ^ "Human PubMed Reference:". National Center for Biotechnology Information, U.S. National Library of Medicine.
- ^ "Mouse PubMed Reference:". National Center for Biotechnology Information, U.S. National Library of Medicine.
- ^ "OrthoMaM phylogenetic marker: CASP3 coding sequence". Archived from the original on 2016-03-03. Retrieved 2009-12-20.
- ^ Alnemri ES, Livingston DJ, Nicholson DW, Salvesen G, Thornberry NA, Wong WW, Yuan J (October 1996). "Human ICE/CED-3 protease nomenclature". Cell. 87 (2): 171. doi:10.1016/S0092-8674(00)81334-3. PMID 8861900. S2CID 5345060.
- ^ Gervais FG, Xu D, Robertson GS, Vaillancourt JP, Zhu Y, Huang J, LeBlanc A, Smith D, Rigby M, Shearman MS, Clarke EE, Zheng H, Van Der Ploeg LH, Ruffolo SC, Thornberry NA, Xanthoudakis S, Zamboni RJ, Roy S, Nicholson DW (April 1999). "Involvement of caspases in proteolytic cleavage of Alzheimer's amyloid-beta precursor protein and amyloidogenic A beta peptide formation". Cell. 97 (3): 395–406. doi:10.1016/s0092-8674(00)80748-5. PMID 10319819. S2CID 17524567.
- ^ "Entrez Gene: CASP3 caspase 3, apoptosis-related cysteine peptidase".
- ^ Harrington HA, Ho KL, Ghosh S, Tung KC (2008). "Construction and analysis of a modular model of caspase activation in apoptosis". Theoretical Biology & Medical Modelling. 5 (1): 26. doi:10.1186/1742-4682-5-26. PMC 2672941. PMID 19077196.
- ^ Wyllie AH (1997). "Apoptosis: an overview". British Medical Bulletin. 53 (3): 451–65. doi:10.1093/oxfordjournals.bmb.a011623. PMID 9374030.
- ^ a b Perry DK, Smyth MJ, Stennicke HR, Salvesen GS, Duriez P, Poirier GG, Hannun YA (July 1997). "Zinc is a potent inhibitor of the apoptotic protease, caspase-3. A novel target for zinc in the inhibition of apoptosis". The Journal of Biological Chemistry. 272 (30): 18530–3. doi:10.1074/jbc.272.30.18530. PMID 9228015.
- ^ a b Stennicke HR, Renatus M, Meldal M, Salvesen GS (September 2000). "Internally quenched fluorescent peptide substrates disclose the subsite preferences of human caspases 1, 3, 6, 7 and 8". The Biochemical Journal. 350 (2): 563–8. doi:10.1042/0264-6021:3500563. PMC 1221285. PMID 10947972.
- ^ a b c Salvesen GS (January 2002). "Caspases: opening the boxes and interpreting the arrows". Cell Death and Differentiation. 9 (1): 3–5. doi:10.1038/sj.cdd.4400963. PMID 11803369. S2CID 31274387.
- ^ Agniswamy J, Fang B, Weber IT (September 2007). "Plasticity of S2-S4 specificity pockets of executioner caspase-7 revealed by structural and kinetic analysis". The FEBS Journal. 274 (18): 4752–65. doi:10.1111/j.1742-4658.2007.05994.x. PMID 17697120. S2CID 1860924.
- ^ Fang B, Boross PI, Tozser J, Weber IT (July 2006). "Structural and kinetic analysis of caspase-3 reveals role for s5 binding site in substrate recognition". Journal of Molecular Biology. 360 (3): 654–66. doi:10.1016/j.jmb.2006.05.041. PMID 16781734.
- ^ Weber IT, Fang B, Agniswamy J (October 2008). "Caspases: structure-guided design of drugs to control cell death". Mini Reviews in Medicinal Chemistry. 8 (11): 1154–62. doi:10.2174/138955708785909899. PMID 18855730.
- ^ Fernandes-Alnemri T, Litwack G, Alnemri ES (December 1994). "CPP32, a novel human apoptotic protein with homology to Caenorhabditis elegans cell death protein Ced-3 and mammalian interleukin-1 beta-converting enzyme". The Journal of Biological Chemistry. 269 (49): 30761–4. doi:10.1016/S0021-9258(18)47344-9. PMID 7983002.
- ^ Tewari M, Quan LT, O'Rourke K, Desnoyers S, Zeng Z, Beidler DR, Poirier GG, Salvesen GS, Dixit VM (June 1995). "Yama/CPP32 beta, a mammalian homolog of CED-3, is a CrmA-inhibitable protease that cleaves the death substrate poly(ADP-ribose) polymerase". Cell. 81 (5): 801–9. doi:10.1016/0092-8674(95)90541-3. PMID 7774019. S2CID 18866447.
- ^ Nicholson DW, Ali A, Thornberry NA, Vaillancourt JP, Ding CK, Gallant M, Gareau Y, Griffin PR, Labelle M, Lazebnik YA (July 1995). "Identification and inhibition of the ICE/CED-3 protease necessary for mammalian apoptosis". Nature. 376 (6535): 37–43. Bibcode:1995Natur.376...37N. doi:10.1038/376037a0. PMID 7596430. S2CID 4240789.
- ^ a b c d e Lavrik IN, Golks A, Krammer PH (October 2005). "Caspases: pharmacological manipulation of cell death". The Journal of Clinical Investigation. 115 (10): 2665–72. doi:10.1172/JCI26252. PMC 1236692. PMID 16200200.
- ^ a b c Porter AG, Jänicke RU (February 1999). "Emerging roles of caspase-3 in apoptosis". Cell Death and Differentiation. 6 (2): 99–104. doi:10.1038/sj.cdd.4400476. PMID 10200555.
- ^ Stennicke HR, Salvesen GS (October 1997). "Biochemical characteristics of caspases-3, -6, -7, and -8". The Journal of Biological Chemistry. 272 (41): 25719–23. doi:10.1074/jbc.272.41.25719. PMID 9325297.
- ^ Ghavami S, Hashemi M, Ande SR, Yeganeh B, Xiao W, Eshraghi M, Bus CJ, Kadkhoda K, Wiechec E, Halayko AJ, Los M (August 2009). "Apoptosis and cancer: mutations within caspase genes". Journal of Medical Genetics. 46 (8): 497–510. doi:10.1136/jmg.2009.066944. PMID 19505876.
- ^ Boatright KM, Salvesen GS (December 2003). "Mechanisms of caspase activation". Current Opinion in Cell Biology. 15 (6): 725–31. doi:10.1016/j.ceb.2003.10.009. PMID 14644197.
- ^ Walters J, Pop C, Scott FL, Drag M, Swartz P, Mattos C, Salvesen GS, Clark AC (December 2009). "A constitutively active and uninhibitable caspase-3 zymogen efficiently induces apoptosis". The Biochemical Journal. 424 (3): 335–45. doi:10.1042/BJ20090825. PMC 2805924. PMID 19788411.
- ^ Gallaher BW, Hille R, Raile K, Kiess W (September 2001). "Apoptosis: live or die--hard work either way!". Hormone and Metabolic Research. 33 (9): 511–9. doi:10.1055/s-2001-17213. PMID 11561209.
- ^ a b Katunuma N, Matsui A, Le QT, Utsumi K, Salvesen G, Ohashi A (2001). "Novel procaspase-3 activating cascade mediated by lysoapoptases and its biological significances in apoptosis". Advances in Enzyme Regulation. 41 (1): 237–50. doi:10.1016/S0065-2571(00)00018-2. PMID 11384748.
- ^ a b c Li P, Nijhawan D, Wang X (January 2004). "Mitochondrial activation of apoptosis". Cell. 116 (2 Suppl): S57–9, 2 p following S59. doi:10.1016/S0092-8674(04)00031-5. PMID 15055583. S2CID 5180966.
- ^ Moongkarndi P, Srisawat C, Saetun P, Jantaravinid J, Peerapittayamongkol C, Soi-ampornkul R, Junnu S, Sinchaikul S, Chen ST, Charoensilp P, Thongboonkerd V, Neungton N (May 2010). "Protective effect of mangosteen extract against beta-amyloid-induced cytotoxicity, oxidative stress and altered proteome in SK-N-SH cells". Journal of Proteome Research. 9 (5): 2076–86. doi:10.1021/pr100049v. PMID 20232907.
- ^ Denault JB, Eckelman BP, Shin H, Pop C, Salvesen GS (July 2007). "Caspase 3 attenuates XIAP (X-linked inhibitor of apoptosis protein)-mediated inhibition of caspase 9". The Biochemical Journal. 405 (1): 11–9. doi:10.1042/BJ20070288. PMC 1925235. PMID 17437405.
- ^ Guo Y, Srinivasula SM, Druilhe A, Fernandes-Alnemri T, Alnemri ES (April 2002). "Caspase-2 induces apoptosis by releasing proapoptotic proteins from mitochondria". The Journal of Biological Chemistry. 277 (16): 13430–7. doi:10.1074/jbc.M108029200. PMID 11832478.
- ^ Srinivasula SM, Ahmad M, Fernandes-Alnemri T, Litwack G, Alnemri ES (December 1996). "Molecular ordering of the Fas-apoptotic pathway: the Fas/APO-1 protease Mch5 is a CrmA-inhibitable protease that activates multiple Ced-3/ICE-like cysteine proteases". Proceedings of the National Academy of Sciences of the United States of America. 93 (25): 14486–91. Bibcode:1996PNAS...9314486S. doi:10.1073/pnas.93.25.14486. PMC 26159. PMID 8962078.
- ^ Selvakumar, P.; Sharma, RK. (May 2007). "Role of calpain and caspase system in the regulation of N-myristoyltransferase in human colon cancer (Review)". Int J Mol Med. 19 (5): 823–7. doi:10.3892/ijmm.19.5.823. PMID 17390089.
- ^ Shu HB, Halpin DR, Goeddel DV (June 1997). "Casper is a FADD- and caspase-related inducer of apoptosis". Immunity. 6 (6): 751–63. doi:10.1016/S1074-7613(00)80450-1. PMID 9208847.
- ^ Han DK, Chaudhary PM, Wright ME, Friedman C, Trask BJ, Riedel RT, Baskin DG, Schwartz SM, Hood L (October 1997). "MRIT, a novel death-effector domain-containing protein, interacts with caspases and BclXL and initiates cell death". Proceedings of the National Academy of Sciences of the United States of America. 94 (21): 11333–8. Bibcode:1997PNAS...9411333H. doi:10.1073/pnas.94.21.11333. PMC 23459. PMID 9326610.
- ^ Forcet C, Ye X, Granger L, Corset V, Shin H, Bredesen DE, Mehlen P (March 2001). "The dependence receptor DCC (deleted in colorectal cancer) defines an alternative mechanism for caspase activation". Proceedings of the National Academy of Sciences of the United States of America. 98 (6): 3416–21. Bibcode:2001PNAS...98.3416F. doi:10.1073/pnas.051378298. PMC 30668. PMID 11248093.
- ^ Samali A, Cai J, Zhivotovsky B, Jones DP, Orrenius S (April 1999). "Presence of a pre-apoptotic complex of pro-caspase-3, Hsp60 and Hsp10 in the mitochondrial fraction of jurkat cells". The EMBO Journal. 18 (8): 2040–8. doi:10.1093/emboj/18.8.2040. PMC 1171288. PMID 10205158.
- ^ Xanthoudakis S, Roy S, Rasper D, Hennessey T, Aubin Y, Cassady R, Tawa P, Ruel R, Rosen A, Nicholson DW (April 1999). "Hsp60 accelerates the maturation of pro-caspase-3 by upstream activator proteases during apoptosis". The EMBO Journal. 18 (8): 2049–56. doi:10.1093/emboj/18.8.2049. PMC 1171289. PMID 10205159.
- ^ Ruzzene M, Penzo D, Pinna LA (May 2002). "Protein kinase CK2 inhibitor 4,5,6,7-tetrabromobenzotriazole (TBB) induces apoptosis and caspase-dependent degradation of haematopoietic lineage cell-specific protein 1 (HS1) in Jurkat cells". The Biochemical Journal. 364 (Pt 1): 41–7. doi:10.1042/bj3640041. PMC 1222543. PMID 11988074.
- ^ Chen YR, Kori R, John B, Tan TH (November 2001). "Caspase-mediated cleavage of actin-binding and SH3-domain-containing proteins cortactin, HS1, and HIP-55 during apoptosis". Biochemical and Biophysical Research Communications. 288 (4): 981–9. doi:10.1006/bbrc.2001.5862. PMID 11689006.
- ^ Tamm I, Wang Y, Sausville E, Scudiero DA, Vigna N, Oltersdorf T, Reed JC (December 1998). "IAP-family protein survivin inhibits caspase activity and apoptosis induced by Fas (CD95), Bax, caspases, and anticancer drugs". Cancer Research. 58 (23): 5315–20. PMID 9850056.
- ^ Shin S, Sung BJ, Cho YS, Kim HJ, Ha NC, Hwang JI, Chung CW, Jung YK, Oh BH (January 2001). "An anti-apoptotic protein human survivin is a direct inhibitor of caspase-3 and -7". Biochemistry. 40 (4): 1117–23. doi:10.1021/bi001603q. PMID 11170436.
- ^ Lee ZH, Lee SE, Kwack K, Yeo W, Lee TH, Bae SS, Suh PG, Kim HH (March 2001). "Caspase-mediated cleavage of TRAF3 in FasL-stimulated Jurkat-T cells". Journal of Leukocyte Biology. 69 (3): 490–6. PMID 11261798.
- ^ Leo E, Deveraux QL, Buchholtz C, Welsh K, Matsuzawa S, Stennicke HR, Salvesen GS, Reed JC (March 2001). "TRAF1 is a substrate of caspases activated during tumor necrosis factor receptor-alpha-induced apoptosis". The Journal of Biological Chemistry. 276 (11): 8087–93. doi:10.1074/jbc.M009450200. PMID 11098060.
- ^ Suzuki Y, Nakabayashi Y, Takahashi R (July 2001). "Ubiquitin-protein ligase activity of X-linked inhibitor of apoptosis protein promotes proteasomal degradation of caspase-3 and enhances its anti-apoptotic effect in Fas-induced cell death". Proceedings of the National Academy of Sciences of the United States of America. 98 (15): 8662–7. Bibcode:2001PNAS...98.8662S. doi:10.1073/pnas.161506698. PMC 37492. PMID 11447297.
- ^ Silke J, Hawkins CJ, Ekert PG, Chew J, Day CL, Pakusch M, Verhagen AM, Vaux DL (April 2002). "The anti-apoptotic activity of XIAP is retained upon mutation of both the caspase 3- and caspase 9-interacting sites". The Journal of Cell Biology. 157 (1): 115–24. doi:10.1083/jcb.200108085. PMC 2173256. PMID 11927604.
- ^ Riedl SJ, Renatus M, Schwarzenbacher R, Zhou Q, Sun C, Fesik SW, Liddington RC, Salvesen GS (March 2001). "Structural basis for the inhibition of caspase-3 by XIAP". Cell. 104 (5): 791–800. doi:10.1016/S0092-8674(01)00274-4. PMID 11257232. S2CID 17915093.
- ^ Roy N, Deveraux QL, Takahashi R, Salvesen GS, Reed JC (December 1997). "The c-IAP-1 and c-IAP-2 proteins are direct inhibitors of specific caspases". The EMBO Journal. 16 (23): 6914–25. doi:10.1093/emboj/16.23.6914. PMC 1170295. PMID 9384571.
- ^ Deveraux QL, Takahashi R, Salvesen GS, Reed JC (July 1997). "X-linked IAP is a direct inhibitor of cell-death proteases". Nature. 388 (6639): 300–4. Bibcode:1997Natur.388..300D. doi:10.1038/40901. PMID 9230442. S2CID 4395885.
- ^ Suzuki Y, Nakabayashi Y, Nakata K, Reed JC, Takahashi R (July 2001). "X-linked inhibitor of apoptosis protein (XIAP) inhibits caspase-3 and -7 in distinct modes". The Journal of Biological Chemistry. 276 (29): 27058–63. doi:10.1074/jbc.M102415200. PMID 11359776.
- ^ Ohtsubo T, Kamada S, Mikami T, Murakami H, Tsujimoto Y (September 1999). "Identification of NRF2, a member of the NF-E2 family of transcription factors, as a substrate for caspase-3(-like) proteases". Cell Death and Differentiation. 6 (9): 865–72. doi:10.1038/sj.cdd.4400566. PMID 10510468.
- ^ Agosto M, Azrin M, Singh K, Jaffe AS, Liang BT (January 2011). "Serum caspase-3 p17 fragment is elevated in patients with ST-segment elevation myocardial infarction: a novel observation". Journal of the American College of Cardiology. 57 (2): 220–1. doi:10.1016/j.jacc.2010.08.628. PMID 21211695.
- ^ Abdul-Ghani M, Megeney LA (June 2008). "Rehabilitation of a contract killer: caspase-3 directs stem cell differentiation". Cell Stem Cell. 2 (6): 515–6. doi:10.1016/j.stem.2008.05.013. PMID 18522841.
추가 읽기
- Cohen GM (August 1997). "Caspases: the executioners of apoptosis". The Biochemical Journal. 326 (Pt 1): 1–16. doi:10.1042/bj3260001. PMC 1218630. PMID 9337844.
- Roig J, Traugh JA (2001). Cytostatic p21 G protein-activated protein kinase gamma-PAK. Vitamins & Hormones. Vol. 62. pp. 167–98. doi:10.1016/S0083-6729(01)62004-1. ISBN 9780127098623. PMID 11345898.
- Zhao LJ, Zhu H (December 2004). "Structure and function of HIV-1 auxiliary regulatory protein Vpr: novel clues to drug design". Current Drug Targets. Immune, Endocrine and Metabolic Disorders. 4 (4): 265–75. doi:10.2174/1568008043339668. PMID 15578977.
- Le Rouzic E, Benichou S (2006). "The Vpr protein from HIV-1: distinct roles along the viral life cycle". Retrovirology. 2 (1): 11. doi:10.1186/1742-4690-2-11. PMC 554975. PMID 15725353.
- Sykes MC, Mowbray AL, Jo H (February 2007). "Reversible glutathiolation of caspase-3 by glutaredoxin as a novel redox signaling mechanism in tumor necrosis factor-alpha-induced cell death". Circulation Research. 100 (2): 152–4. doi:10.1161/01.RES.0000258171.08020.72. PMID 17272816.
외부 링크
| 위키미디어 커먼즈에는 캐스파세 3과 관련된 미디어가 있다. |