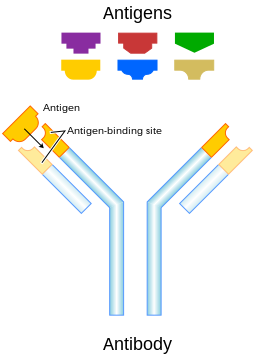
항원
Antigen면역학에서 항원(Ag)은 특정 항체 또는 T세포 [1]수용체에 결합할 수 있는 분자 또는 분자 구조 또는 이물질 또는 꽃가루 입자이다.체내에 항원이 존재하면 면역반응이 [2]일어날 수 있다.항원이라는 용어는 원래 항체 [3]생성 물질인 물질을 가리킨다.항원은 단백질, 펩타이드, 다당류, 지질 또는 핵산이 [4]될 수 있습니다.
항원은 항체와 T세포 수용체를 포함한 항원 수용체에 의해 인식된다.면역계의 세포에 의해 다양한 항원 수용체가 형성되어 각 세포가 단일 항원에 대한 특이성을 갖는다.항원에 노출되면, 그 항원을 인식하는 림프구만이 활성화되고 확장되는데, 이것은 클론 [4]선택이라고 알려진 과정이다.대부분의 경우, 항체는 오직 하나의 특정 항원에 반응하고 결합할 수 있다. 그러나, 어떤 경우에는, 항체가 교차 반응하고 하나 이상의 항원을 결합할 수 있다.
항원은 신체 내부("셀프 단백질") 또는 외부 환경("비자기")[2]에서 발생할 수 있습니다.면역 체계는 "비자기" 외부 항원을 식별하고 공격하며, 흉선의 T세포와 골수의 [5]B세포의 음성 선택으로 인해 보통 자가 단백질에 반응하지 않습니다.
백신은 면역원성 형태의 항원의 예로서 수용자에게 의도적으로 투여되어 수용자에게 침입하는 병원체의 항원에 대한 적응면역계의 기억기능을 유도한다.계절독감 백신이 대표적인 예다.[6]
어원학
파울 에를리히는 19세기 [7]말 그의 곁사슬 이론에서 항체라는 용어를 만들었다.1899년, Ladislas Deutsch(Laszlo Detre)는 박테리아 성분과 항체 사이의 중간 지점에 있는 가상의 물질을 "항원성 또는 면역 유발 물질"이라고 명명했다.그는 원래 자이모겐이 효소의 전구체인 것처럼 이 물질들이 항체의 전구체라고 믿었다.그러나 1903년까지 그는 항원이 면역체(항체)의 생성을 유도한다는 것을 이해하고 항원이라는 단어는 항종양체(Imunkörperbildner)의 수축이라고 썼다.옥스포드 영어 사전에는 논리 구문이 "반(body)-gen"[8]이어야 한다고 나와 있다.
용어.
- 에피토프 – 항원의 뚜렷한 표면 특징, 항원 결정 요인.
항원성 분자, 보통 "대형" 생물학적 고분자는 보통 특정 항체의 상호작용 지점 역할을 할 수 있는 표면 특징을 나타낸다.이러한 특징은 모두 에피토프를 구성합니다.대부분의 항원은 항원의 에피토프 중 하나에 특정한 여러 항체에 의해 결합될 수 있는 잠재력을 가지고 있다."잠금 및 열쇠" 은유를 사용하여 항원은 각각 다른 잠금(항체)과 일치하는 일련의 키(에피토프)로 볼 수 있습니다.서로 다른 항체 백치형은 각각 뚜렷하게 상보성 결정 영역을 형성한다. - 알레르겐 – 알레르기 반응을 일으킬 수 있는 물질.섭취, 흡입, 주입 또는 피부 접촉을 통한 노출 후 (상세) 반응이 나타날 수 있습니다.
- Superantigen – T세포의 비특이적 활성화를 유발하여 다세포 T세포 활성화 및 대규모 사이토카인 방출을 일으키는 항원의 일종.
- 톨루로겐 – 분자 형태로 인해 특정 면역 무반응을 일으키는 물질.분자 형태가 바뀌면 톨러로겐은 면역원이 될 수 있다.
- 면역글로불린 결합단백질 – 단백질 A, 단백질 G, 단백질 L과 같은 단백질로 항원 결합 부위 외부에 있는 항체에 결합할 수 있습니다.항원이 항체의 "표적"인 반면, 면역 글로불린 결합 단백질은 항체를 공격합니다.
- T-의존성 항원 – T세포의 도움을 필요로 하는 항원.
- T-비의존성 항원– B세포를 직접 자극하는 항원.
- 면역소화항원 – 면역반응을 일으키는 능력에서 지배적인 (병원체로부터 다른 모든 것을 능가하는) 항원.T세포 반응은 일부 경우(예: 말라리아 병원체 Plasmodium spp.) 비교적 많은 수의 기생충 [9]항원을 통해 분산되지만, 일반적으로 상대적으로 적은 수의 면역성 에피토프에 대해 유도된다.
항원 제시 세포는 조직적합성 분자에 펩타이드 형태로 항원을 제시한다.T세포는 항원을 선택적으로 인식하며, 항원과 조직적합성 분자의 유형에 따라 다른 유형의 T세포가 활성화된다.T세포 수용체(TCR) 인식을 위해 펩타이드는 세포 내부의 작은 조각으로 처리되어야 하며 주요 조직적합성 복합체(MHC)[10]에 의해 제시되어야 한다.그 항원은 면역학적 [11]보조자의 도움 없이는 면역 반응을 이끌어낼 수 없다.마찬가지로, 백신의 보조성분은 선천적인 면역체계의 [12][13]활성화에 필수적인 역할을 한다.
면역원은 체액성 면역 [14]반응 또는 세포 매개 면역 반응을 일으킬 수 있는 항원 물질(또는 부가물)이다.그것은 먼저 선천적인 면역 반응을 시작하여 적응 면역 반응의 활성화를 일으킨다.항원은 고변동 면역수용체 제품(B세포 수용체 또는 T세포 수용체)이 생성되면 결합한다.면역물질은 [15]면역반응을 유도할 수 있는 면역원성이라고 불리는 항원을 말한다.
분자 수준에서 항원은 항체의 파라토프에 결합하는 능력에 의해 특징지을 수 있다.다른 항체는 항원 표면에 존재하는 특정 에피토프를 구별할 수 있는 잠재력을 가지고 있다.합텐은 단백질과 같은 더 큰 운반체 분자에 부착되었을 때만 면역 반응을 유도할 수 있는 작은 분자이다.항원은 단백질, 다당류, 지질, 핵산 또는 다른 생체 [4]분자일 수 있습니다.여기에는 박테리아, 바이러스 및 기타 미생물의 일부(코트, 캡슐, 세포벽, 편모, 편모, 독소)가 포함됩니다.비균성 비자기 항원은 이식된 조직과 장기 또는 수혈된 혈구 표면에 꽃가루, 난백, 단백질을 포함할 수 있다.
원천
항원은 그 근원에 따라 분류될 수 있다.
외인성 항원
외인성 항원은 흡입, 섭취 또는 주사 등으로 외부에서 체내에 들어온 항원이다.외인성 항원에 대한 면역체계의 반응은 종종 잠재의식적이다.내구증 또는 식세포증에 의해 외인성 항원이 항원 제시 세포(APC)에 받아들여져 단편화된다.그런 다음 APC는 표면에 있는 클래스 II 조직적합성 분자를 사용하여 T 도우미 세포(CD4)에+ 단편을 제시한다.일부 T세포는 펩타이드에 특이적이다.MHC 콤플렉스세포독성 T림프구(CTL)를 활성화하는 물질인 사이토카인, 항체분비 B세포, 대식세포 및 기타 입자를 분비하기 시작한다.
어떤 항원은 외인성으로 시작해서 나중에 내인성이 된다.세포내 항원은 감염된 세포가 파괴되면 순환될 수 있다.
내인성 항원
내인성 항원은 정상적인 세포 대사의 결과 또는 바이러스 또는 세포 내 세균 감염으로 인해 정상 세포 내에서 생성된다.그런 다음 파편들은 복합체의 세포 표면에 MHC 클래스 I 분자와 함께 나타납니다.활성화된 세포독성+ CD8 T세포가 이를 인식하면 T세포는 감염된 세포의 용융이나 아포토시스의 원인이 되는 다양한 독소를 분비한다.자기단백질 제시만을 위해 세포독성세포가 세포를 죽이는 것을 방지하기 위해 내성(음성선택)에 의해 세포독성세포(자기반응성T세포)를 삭제한다.내인성 항원은 외래성 항원, 자가형 및 백치형 항원 또는 동종성 항원을 포함한다.때때로 항원은 자가면역질환에서 [2]숙주의 일부이다.
자동 안티겐
자가항원은 보통 특정 자가면역질환을 가진 환자의 면역체계에 의해 인식되는 자기단백질 또는 단백질 복합체이다.정상적인 조건에서는, 이러한 자가단백질은 면역 시스템의 표적이 되어서는 안 되지만, 자가면역 질환에서는, 연관된 T세포가 삭제되지 않고 대신 공격합니다.
네오안티겐스
네오안티겐은 정상적인 인간 게놈에 전혀 없는 것이다.무변성 자가단백질과 비교하여 네오안티겐은 종양조절과 관련이 있는데, 이러한 항원에 이용 가능한 T세포 풀의 품질이 중심 T세포 내성에 영향을 받지 않기 때문이다.네오안티겐에 대한 T세포 반응도를 체계적으로 분석하는 기술은 [16]최근에야 이용할 수 있게 됐다.네오안티겐은 분자진단업체 컴플리트 오믹스가 존스홉킨스대 [17]의대 연구팀과 공동으로 개발한 MANA-SRM이라는 방법으로 직접 검출하고 정량화할 수 있다.
바이러스 항원
자궁경부암과 두경부암의 서브셋과 같은 바이러스 관련 종양의 경우, 바이러스 개방형 판독 프레임에서 파생된 에피토프가 [16]네오안티겐 풀에 기여한다.
종양항원
종양 항원은 종양 세포의 표면에 있는 MHC 클래스 I 또는 MHC 클래스 II 분자에 의해 나타나는 항원이다.그러한 세포에서만 발견되는 항원은 종양 특이 항원이라고 불리며 일반적으로 종양 특이적 돌연변이에 의해 발생한다.더 흔한 것은 종양 세포와 종양 관련 항원으로 불리는 정상 세포에 의해 나타나는 항원이다.이러한 항원을 인식하는 세포독성 T림프구는 종양세포를 [16]파괴할 수 있다.
종양 항원은 예를 들어 B세포에 [16]의해 인식되는 돌연변이 수용체의 형태로 종양 표면에 나타날 수 있다.
바이러스 병인이 없는 인간 종양의 경우 종양 특이적 DNA [16]변화에 의해 새로운 펩타이드(신 에피토프)가 생성된다.
과정
인간 종양 돌연변이의 상당 부분은 효과적으로 환자 고유의 것이다.따라서 네오안티겐은 개별 종양 게놈에 기초할 수도 있다.딥시퀀싱 기술은 게놈(엑솜)의 단백질 코드 부분 내 돌연변이를 식별하고 잠재적 네오안티겐을 예측할 수 있다.마우스 모델에서 모든 신규 단백질 배열에 대해 잠재적 MHC 결합 펩타이드가 예측되었다.결과적으로 얻은 잠재적 네오안티겐 세트는 T 세포 반응성을 평가하는 데 사용되었다.Exome 기반 분석은 종양 침투 림프구(TIL) 세포 치료 또는 체크포인트 차단으로 치료된 환자의 반응성을 평가하기 위해 임상 환경에서 이용되었다.네오안티겐 식별은 여러 실험 모델 시스템과 인간 악성 [16]종양에 대해 성공적이었다.
암 엑소시옴 배열의 거짓 음성률은 낮다. 즉, 네오안티겐의 대부분은 충분한 커버리지를 가진 엑소닉 배열 내에서 발생한다.그러나 발현 유전자 내 돌연변이의 대부분은 자가 T세포에 [16]의해 인식되는 네오안티겐을 생성하지 않는다.
2015년 현재 질량 분석 분해능은 MHC 분자가 나타낼 수 있는 펩타이드 풀에서 많은 거짓 양성을 제외하기에 불충분하다.대신 가장 가능성이 높은 후보를 식별하기 위해 알고리즘이 사용됩니다.이러한 알고리즘은 프로테아솜 처리의 가능성, 소포체로의 수송, 관련 MHC 클래스 I 대립 유전자에 대한 친화력 및 유전자 발현 또는 단백질 번역 [16]수준과 같은 요인을 고려합니다.
편향되지 않은 화면에서 식별된 대부분의 인간 네오안티겐은 높은 예측 MHC 결합 친화성을 보인다.개념적으로 유사한 항원 등급인 작은 조직적합성 항원도 MHC 결합 알고리즘에 의해 정확하게 식별된다.또 다른 잠재적 필터는 돌연변이가 MHC 결합을 개선할 것으로 예상되는지 여부를 조사합니다.MHC 결합 펩타이드의 중심 TCR 노출 잔류물의 특성은 펩타이드 면역원성과 [16]관련이 있다.
예수 탄생
원어민 항원은 APC에 의해 더 작은 부분으로 아직 처리되지 않은 항원이다.T 세포는 네이티브 항원과 결합할 수 없지만 APC에 의해 처리되어야 하는 반면, B 세포는 네이티브 항원에 의해 활성화될 수 있습니다.
항원특이성
항원특이성은 숙주세포가 특이적으로 항원을 독특한 분자체로 인식하고 다른 항원과 정교한 정밀도로 구별하는 능력이다.항원 특이성은 주로 항원의 측쇄 구조에 기인한다.측정 가능하며 선형일 필요도 없고 속도 제한 단계 또는 [2][6]방정식일 필요도 없습니다.T 세포와 B 세포는 모두 적응 [2][4]면역의 세포 구성요소이다.
「 」를 참조해 주세요.
레퍼런스
- ^ "Antibody". National Human Genome Research Institute, US National Institutes of Health. 2020. Retrieved 13 October 2020.
- ^ a b c d e "Immune system and disorders". MedlinePlus, US National Institute of Medicine. 28 September 2020. Retrieved 13 October 2020.
- ^ Male, David K. (2006). Immunology. Elsevier Health Sciences. p. 10. ISBN 978-0323033992.
- ^ a b c d Abbas, Abul K.; Lichtman, Andrew; Pillai, Shiv (2018). "Antibodies and Antigens". Cellular and Molecular Immunology (9th ed.). Philadelphia: Elsevier. ISBN 978-0-323-52324-0.
- ^ Gallucci, S; Lolkema, M; Matzinger, P (November 1999). "Natural adjuvants: endogenous activators of dendritic cells". Nature Medicine. 5 (11): 1249–55. doi:10.1038/15200. PMID 10545990. S2CID 29090284.
- ^ a b "Antigenic characterization". US Centers for Disease Control and Prevention. 15 October 2019. Retrieved 13 October 2020.
- ^ Strebhardt, Klaus; Ullrich, Axel (Jun 2008). "Paul Ehrlich's magic bullet concept: 100 years of progress". Nature Reviews Cancer. 8 (6): 473–80. doi:10.1038/nrc2394. ISSN 1474-1768. PMID 18469827. S2CID 30063909.
- ^ Lindenmann, Jean (1984). "Origin of the Terms 'Antibody' and 'Antigen'". Scand. J. Immunol. 19 (4): 281–85. doi:10.1111/j.1365-3083.1984.tb00931.x. PMID 6374880. S2CID 222200504.
- ^ Doolan DL, Southwood S, Freilich DA, Sidney J, Graber NL, Shatney L, Bebris L, Florens L, Dobano C, Witney AA, Appella E, Hoffman SL, Yates JR, Carucci DJ, Sette A (August 2003). "Identification of Plasmodium falciparum antigens by antigenic analysis of genomic and proteomic data". Proceedings of the National Academy of Sciences of the United States of America. 100 (17): 9952–57. Bibcode:2003PNAS..100.9952D. doi:10.1073/pnas.1633254100. PMC 187898. PMID 12886016.
- ^ 파르함, 피터(2009).면역체계, 제3판, G:2, 갈랜드 사이언스, 테일러, 프란시스 그룹, LLC.
- ^ Gavin, AL; Hoebe, K; Duong, B; Ota, T; Martin, C; Beutler, B; Nemazee, D (22 December 2006). "Adjuvant-enhanced antibody responses in the absence of toll-like receptor signaling". Science. 314 (5807): 1936–38. Bibcode:2006Sci...314.1936G. doi:10.1126/science.1135299. PMC 1868398. PMID 17185603.
- ^ Janeway CA, Jr (1 November 2013). "Pillars article: approaching the asymptote? Evolution and revolution in immunology. Cold spring harb symp quant biol. 1989. 54: 1–13". Journal of Immunology. 191 (9): 4475–87. PMID 24141854.
- ^ Gayed, PM (June 2011). "Toward a modern synthesis of immunity: Charles A. Janeway Jr. and the immunologist's dirty little secret". The Yale Journal of Biology and Medicine. 84 (2): 131–38. ISSN 1551-4056. PMC 3117407. PMID 21698045.
- ^ 파르함, 피터(2009).면역체계, 제3판, G:11페이지, 갈랜드 사이언스, 테일러, 프란시스 그룹, LLC.
- ^ Kuby Immunology (6th ed.). Macmillan. 2006. p. 77. ISBN 978-1-4292-0211-4.
- ^ a b c d e f g h i Schumacher, Ton N.; Schreiber, Robert D. (April 3, 2015). "Neoantigens in cancer immunotherapy". Science. 348 (6230): 69–74. Bibcode:2015Sci...348...69S. doi:10.1126/science.aaa4971. PMID 25838375.
- ^ Wang, Qing.; Douglass, Jacqueline (September 16, 2019). "Direct Detection and Quantification of Neoantigens". Cancer Immunol Res. 7 (11): 1748–54. doi:10.1158/2326-6066.CIR-19-0107. PMC 6825591. PMID 31527070.