중화항체
Neutralizing antibody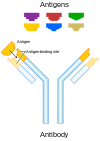 표준 항체 표현. | |
| 특성. | |
|---|---|
| 단백질 타입 | 면역글로빈 |
| 기능. | 항원의 중화 |
| 생산. | B세포[1][2] |
중화항체(NAB)는 병원체 또는 감염입자로부터 세포가 생물학적으로 미치는 영향을 중화함으로써 세포를 보호하는 항체이다.중화시키면 입자가 더 이상 감염되거나 병원성이 [3][4]없어집니다.중화 항체는 바이러스, 세포 내 박테리아 및 미생물 독소에 대한 적응 면역 시스템의 체액 반응의 일부이다.중화 항체는 감염성 입자의 표면 구조(항원)에 특이적으로 결합함으로써 입자가 숙주 세포와 상호작용하는 것을 방지하고 감염 및 파괴할 수 있다.중화 항체에 의한 면역은 [5]면역체계가 감염되기 전에 감염 입자를 제거하기 때문에 살균 면역이라고도 한다.
메커니즘
세포에 들어가기 위해, 순환하는 바이러스 입자 또는 세포외 박테리아와 같은 병원체는 세포 표면에 있는 분자를 사용하여 세포 안으로 들어가 복제 [6]주기를 시작할 수 있게 하는 표적 세포의 세포 표면 수용체와 상호작용한다.중화 항체는 병원체에 결합함으로써 감염성을 억제하고 세포 진입에 필요한 분자를 차단할 수 있다.이것은 항체가 숙주 세포 수용체에 붙어 있는 병원균이나 독소와 정적으로 간섭하기 때문일 수 있습니다.바이러스 감염의 경우, NAbs는 포락선 바이러스의 당단백질이나 비포락선 바이러스의 캡시드 단백질과 결합할 수 있다.또한 중화항체는 세포 진입에 종종 필요한 구조변화를 입자가 겪는 것을 방지함으로써 작용한다.예를 들어, 항체를 중화시키는 것은 숙주 [6]세포에 들어가는 데 필요한 막 융합을 매개하는 바이러스 단백질의 구조 변화를 막을 수 있다.항체가 분해된 후에도 바이러스가 감염되지 않는 경우도 있다.병원체-항체복합체는 결국 대식세포에 [7]의해 흡수되고 분해된다.
중화 항체는 또한 박테리아 독소의 독성 효과를 중화시키는데 중요하다.중화항체의 [8]예로는 디프테리아 독소의 생물학적 영향을 중화시킬 수 있는 디프테리아 항독소가 있다.중화항체는 항체의 결합이 세균의 복제를 막지 않기 때문에 세포외 세균에 대해 효과가 없다.여기서, 면역 체계는 박테리아를 [9]죽이기 위해 옵소닌화 및 보체 활성화와 같은 항체의 다른 기능을 사용합니다.
중화항체와 결합항체의 차이
병원성 입자와 결합하는 모든 항체가 중화되는 것은 아니다.비중화 항체 또는 결합 항체는 병원체에 특이적으로 결합하지만, 그들의 감염성을 방해하지는 않는다.그것은 그들이 올바른 지역에 얽매이지 않기 때문일 수 있다.비중화 항체는 면역 세포를 위해 입자를 표시하는데 중요할 수 있으며, 이는 입자가 표적이 되었음을 나타내며, 그 후 입자가 처리된 후 모집된 면역 [10]세포에 의해 결과적으로 파괴됩니다.반면 항체를 중화시키면 면역세포 없이도 항원의 생물학적 효과를 중화시킬 수 있다.경우에 따라서는 비중화 항체 또는 바이러스 입자에 결합하는 충분한 양의 중화 항체가 일부 바이러스 종에 의해 숙주 세포로의 흡수를 용이하게 하기 위해 이용될 수 있다.이 메커니즘은 항체 의존성 [11]강화로 알려져 있다.뎅기 바이러스와 지카 [12]바이러스가 관찰되었습니다.
생산.
항체는 B세포에 의해 생성되고 분비된다.골수에서 B세포가 생성될 때, 항체를 코드하는 유전자는 무작위 유전자 재조합을 거치고, 이것은 모든 성숙한 B세포가 항원 결합 영역에서 아미노산 배열이 다른 항체를 생산하게 한다.그러므로, 모든 B 세포는 다른 [13]항원들과 특이하게 결합하는 항체를 생산한다.항체 레퍼토리의 강한 다양성은 면역체계가 모든 다른 형태와 크기로 나타날 수 있는 과도한 병원체를 인식하도록 합니다.감염 중에는 친화력이 높은 병원성 항원과 결합하는 항체만 생성된다.이것은 단일 B 세포 클론의 복제 선택으로 이루어진다: 선천적인 면역 반응의 일부로 감염된 세포에 의해 방출되는 간섭자를 감지함으로써 B 세포는 감염 부위로 모집된다.B세포는 세포막에 고정된 항체인 B세포 수용체를 세포 표면에 보여준다.B세포 수용체가 높은 친화력으로 동족 항원과 결합하면 세포 내 신호 전달 캐스케이드가 트리거된다.B세포는 항원에 결합하는 것 외에 병원체에 대한 면역계의 세포반응의 일부로서 T도우미세포에 의해 생성된 사이토카인에 의해 자극될 필요가 있다.B세포는 완전히 활성화되면 빠르게 증식하여 혈장세포로 분화한다.혈장 세포는 항원 특이 항체를 [14]대량으로 분비한다.예방접종 또는 자연감염에 의한 항원의 첫 만남 후 면역기억은 다음에 바이러스에 노출된 후 중화항체를 보다 빠르게 생산할 수 있게 한다.
중화항체 바이러스 회피
바이러스는 중화 [15]항체를 피하기 위해 다양한 메커니즘을 사용한다.바이러스 게놈은 높은 속도로 변이된다.바이러스가 중화 항체를 회피할 수 있는 돌연변이가 선택될 것이고, 따라서 우세할 것이다.반대로 면역반응 중에 항체가 친화성 성숙에 의해 동시에 진화함으로써 바이러스 입자의 인식을 향상시킨다.바이러스 기능에 중추적인 역할을 하는 바이러스 단백질의 보존된 부분은 시간이 지남에 따라 진화할 가능성이 낮으며, 따라서 항체 결합에 더 취약합니다.그러나 바이러스는 이들 영역에 대한 항체의 입체적 접근을 방해하는 특정 메커니즘을 진화시켜 결합을 [15]어렵게 만들었다.표면 구조 단백질의 밀도가 낮은 바이러스는 항체가 [15]결합하는 것이 더 어렵다.일부 바이러스 당단백질은 N-결합 글리칸과 O-결합 글리칸에 의해 고도로 글리코실화되어 이른바 글리칸 차폐를 생성하며, 이는 항체 결합 친화력을 감소시키고 중화 [15]항체의 회피를 촉진할 수 있다.인간 에이즈의 원인인 HIV-1은 이 두 [16][17]가지 메커니즘을 모두 사용합니다.
중화 항체의 의학적 용도
중화 항체는 수동 면역에 사용되며, 건강한 면역 체계를 가지고 있지 않더라도 환자에게 사용될 수 있습니다.20세기 초에, 감염된 환자에게 이전에 감염되고 회복된 환자의 혈청인 항혈청을 주사했는데, 항혈청은 감염원에 대한 다클론 항체를 포함하고 있었다.이것은 항체가 바이러스 감염과 [18]독소에 대한 효과적인 치료제로 사용될 수 있다는 것을 보여주었다.항혈청은 혈장 내 항체가 정제되거나 표준화되지 않고 [19]기증자에 의해 혈장이 거부될 수 있기 때문에 매우 조악한 치료법이다.회복된 환자의 기부에 의존하기 때문에 쉽게 확장할 수 없다.그러나 혈청 요법은 비교적 빠르게 [20][21]얻을 수 있기 때문에 오늘날에도 여전히 발병 시 첫 번째 방어선으로 사용되고 있다.혈청 치료는 2009년 신종플루[22] 대유행과 서아프리카 에볼라 바이러스 유행 [23]동안 환자의 사망률을 감소시키는 것으로 나타났다.그것은 또한 COVID-19에 대한 가능한 치료법으로 시험되고 있다.[24][25]건강한 사람으로부터 얻은 항체의 혼합물을 사용하는 면역글로불린 요법은 감염을 퇴치하기 위해 면역 결핍 환자나 면역 억제 환자에게 주어진다.
보다 특이적이고 견고한 치료를 위해 정제 폴리클로널 또는 모노클로널 항체(mAb)를 사용할 수 있다.폴리클론 항체는 동일한 병원체를 대상으로 하지만 다른 에피토프에 결합하는 항체의 집합이다.폴리클론 항체는 항원에 노출된 인간 기증자나 동물로부터 얻어진다.동물공여자에게 주입된 항원은 중화항체를 [26]생성하도록 설계될 수 있다.폴리클론 항체는 사이토메갈로바이러스(CMV), B형간염바이러스(HBV), 광견병바이러스, 홍역바이러스, 호흡기합성세포바이러스(RSV)[19]의 치료제로 사용되어 왔다.디프테리아 항독소는 디프테리아 [27]독소에 대한 폴리클론 항체를 포함한다.복수의 에피토프를 결합하는 항체로 처리함으로써 바이러스가 돌연변이를 일으켜 에피토프 중 하나가 구조가 변화해도 치료 효과가 있다.단, 제조의 성질상 폴리클로널 항체에 의한 처리는 배치간 변동과 낮은 항체 [26]적정성을 가진다.반면 모노클로널 항체는 모두 동일한 에피토프를 높은 특이성으로 결합한다.mAb를 [18]대량으로 생성할 수 있는 Hybridoma 기술로 제조할 수 있으며, mAb의 표적이 되는 에피토프를 바이러스가 변이시키거나 여러 변종이 돌면 감염에 대한 mAb가 작동을 멈춥니다.모노클로널 항체를 사용하는 약물의 예로는 에볼라에 대한[28] ZMapp과 RSV에 [29]대한 Palivizumab이 있다.다른 감염에 대한 많은 mAB가 임상시험 [18]중이다.
중화 항체는 백신 접종에 의한 능동 면역에도 역할을 한다.면역반응에서 항체를 중화시키는 결합부위와 구조를 이해함으로써 면역계를 자극하여 항체를 중화시키지 [30][31]않고 중화항체를 생성하도록 백신을 합리적으로 설계할 수 있다.백신 접종을 통해 약화된 형태의 바이러스를 도입하는 것은 B세포에 의한 중화항체 생산을 가능하게 한다.두 번째 피폭 후 바이러스 [32]특이 항체를 생성하는 기억 B세포가 존재하기 때문에 중화 항체 반응이 더 빠르다.효과적인 백신은 비록 항체 회피로 이어지는 바이러스 돌연변이가 반응하여 [32]백신을 업데이트해야 할 수도 있지만, 바이러스의 대부분의 변종을 중화시킬 수 있는 항체의 생산을 유도한다.일부 바이러스는 다른 바이러스보다 빠르게 진화하기 때문에 이에 대응하여 백신을 업데이트해야 합니다.잘 알려진 예는 인플루엔자 바이러스 백신인데,[15] 이 백신은 최근 순환하는 바이러스의 변종을 설명하기 위해 매년 업데이트 되어야 한다.
중화 항체는 또한 다발성 경화증 [2]치료를 도울 수 있다.비록 이런 종류의 항체가 레트로바이러스 감염과 싸우는 능력을 가지고 있지만, 어떤 경우에는 다발성 경화증을 치료하기 위해 몸에 투여되는 약품을 공격한다.재조합 단백질 약물, 특히 동물에서 파생된 약물은 일반적으로 항체를 중화시키는 것에 의해 표적이 된다.예를 들어 Rebif, Betaseron 및 Avonex가 [2]있습니다.
중화항체 검출 및 정량방법
중화 측정은 플라크 감소(접종된 배양액과 대조군 웰의 바이러스 플라크 수를 비교함), 마이크로뉴트랄화(소량의 혈청으로 채워진 마이크로티터 판에서 수행됨), 색도 측정과 같은 기술의 사용을 포함하여 다양한 방법으로 수행되고 측정될 수 있습니다.ssays([33]바이오마커에 의존하며 바이러스의 대사 억제를 나타낸다)
광범위한 중화항체
면역계에 의해 생성되는 중화항체는 대부분 [14]B세포에 의한 친화성 성숙으로 인해 단일 바이러스주에 매우 특이적이다.HIV와 같이 유전적 변이가 높은 일부 병원체는 표면 구조를 끊임없이 변화시켜 오래된 변종에 대한 특이성이 높은 항체를 중화시키는 것이 더 이상 새로운 바이러스 변종에 결합할 수 없게 된다.이 면역 회피 전략은 면역체계가 [34]병원체에 대한 면역학적 기억을 발달시키는 것을 막는다.반면에 광범위하게 중화항체(bNAbs)는 바이러스 [35]종의 여러 변종을 결합하고 중화시키는 특별한 능력을 가지고 있다.
bNAbs는 처음에 HIV [36]환자들에게서 발견되었다.그러나, 그것들은 매우 드물다.전체 환자의 1%만이 HIV에 [37]대해 bNAb를 발생시키는 것으로 나타났다.bNAB는 바이러스 복제에 기능적으로 필수적이기 때문에 변이가 불가능한 바이러스 표면 단백질의 보존된 영역에 결합함으로써 광범위한 바이러스 변종을 중화시킬 수 있다.HIV에 대한 bNAb의 대부분의 결합 부위는 HIV의 노출된 표면 항원인 외피(Env) 단백질(gp120 및 gp41 서브유닛으로 구성된 트리머)에 있습니다.이러한 사이트에는 CD4 바인딩 사이트 또는 gp41-gp120 [38]인터페이스가 포함됩니다.Los Alamos National Laboratory의 HIV Databases는 HIV 시퀀스, bNAb 등에 [39]대한 풍부한 정보를 제공하는 포괄적인 리소스입니다.
또한, bNAbs는 [40]인플루엔자,[41] C형 간염, 뎅기열[42], 웨스트 나일 [43]바이러스를 포함한 다른 바이러스들에 대해서도 발견되었다.
조사.
bNAbs는 HIV-1에 대한 bNAbs를 식별하고 테스트하기 위해 예비연구를 실시한다.[44]bNAbs는 bNAbs의 생산을 촉진하고 바이러스에 대한 면역성을 촉진하기 위한 백신을 합리적으로 설계하기 위한 연구에 사용된다.동물 모델이나 사람에서 bNAb 생성을 유발하는 항원은 [35]알려져 있지 않다.
「 」를 참조해 주세요.
레퍼런스
- ^ Mike Recher; Karl S Lang; Lukas Hunziker; Stefan Freigang; Bruno Eschli; Nicola L Harris; Alexander Navarini; Beatrice M Senn; Katja Fink; Marius Lötscher; Lars Hangartner; Raphaël Zellweger; Martin Hersberger; Alexandre Theocharides; Hans Hengartner; Rolf M Zinkernagel (8 August 2004). "Deliberate removal of T cell help improves virus-neutralizing antibody production". Nature Immunology. 5 (9): 934–942. doi:10.1038/ni1102. PMID 15300247.
- ^ a b c Stachowiak, Julie (15 August 2008). "Neutralizing Antibodies and Disease-Modifying Therapies for Multiple Sclerosis". About.com. Retrieved 13 June 2009.
- ^ "Neutralizing antibody". Biology-Online. 2008. Retrieved 4 July 2009.
- ^ Klasse, P. J. (9 September 2014). "Neutralization of Virus Infectivity by Antibodies: Old Problems in New Perspectives". Advances in Biology. Retrieved 16 August 2021.
- ^ Dutta, A; Huang, CT; Lin, CY; Chen, TC; Lin, YC; Chang, CS; He, YC (6 September 2016). "Sterilizing immunity to influenza virus infection requires local antigen-specific T cell response in the lungs". Scientific Reports. 6: 32973. Bibcode:2016NatSR...632973D. doi:10.1038/srep32973. PMC 5011745. PMID 27596047.
- ^ a b Principles of Virology, Volume 1: Molecular Biology (4th ed.). ASM Press. 2015. p. 31. ISBN 978-1555819330.
- ^ Principles of Virology, Volume 2: Pathogenesis and Control (4th ed.). ASM Press. 2015. p. 125. ISBN 978-1-555-81951-4.
- ^ Treffers, Henry P. (2014). "Neutralizing antibody". AccessScience. McGraw-Hill. doi:10.1036/1097-8542.450600.
- ^ Janeway's immunobiology (8th ed.). Garland Science. 2012. p. 388. ISBN 978-0-8153-4243-4.
- ^ Schmaljohn, AL (July 2013). "Protective antiviral antibodies that lack neutralizing activity: precedents and evolution of concepts". Current HIV Research. 11 (5): 345–53. doi:10.2174/1570162x113116660057. PMID 24191933.
- ^ Tirado, SM; Yoon, KJ (2003). "Antibody-dependent enhancement of virus infection and disease". Viral Immunology. 16 (1): 69–86. doi:10.1089/088282403763635465. PMID 12725690.
- ^ Dejnirattisai, Wanwisa; Supasa, Piyada; Wongwiwat, Wiyada; Rouvinski, Alexander; Barba-Spaeth, Giovanna; Duangchinda, Thaneeya; Sakuntabhai, Anavaj; Cao-Lormeau, Van-Mai; Malasit, Prida; Rey, Felix A; Mongkolsapaya, Juthathip; Screaton, Gavin R (23 June 2016). "Dengue virus sero-cross-reactivity drives antibody-dependent enhancement of infection with zika virus". Nature Immunology. 17 (9): 1102–1108. doi:10.1038/ni.3515. PMC 4994874. PMID 27339099.
- ^ Jung, David; Alt, Frederick W (January 2004). "Unraveling V(D)J Recombination". Cell. 116 (2): 299–311. doi:10.1016/S0092-8674(04)00039-X. PMID 14744439.
- ^ a b Janeway's immunobiology (8th ed.). Garland Science. 2012. pp. 389–404. ISBN 978-0-8153-4243-4.
- ^ a b c d e VanBlargan, Laura A.; Goo, Leslie; Pierson, Theodore C. (2016). "Deconstructing the Antiviral Neutralizing-Antibody Response: Implications for Vaccine Development and Immunity". Microbiology and Molecular Biology Reviews. 80 (4): 989–1010. doi:10.1128/MMBR.00024-15. ISSN 1092-2172. PMC 5116878. PMID 27784796.
- ^ Crispin, Max; Ward, Andrew B.; Wilson, Ian A. (20 May 2018). "Structure and Immune Recognition of the HIV Glycan Shield". Annual Review of Biophysics. 47 (1): 499–523. doi:10.1146/annurev-biophys-060414-034156. ISSN 1936-122X. PMC 6163090. PMID 29595997.
- ^ Guha, Debjani; Ayyavoo, Velpandi (2013). "Innate Immune Evasion Strategies by Human Immunodeficiency Virus Type 1". ISRN AIDS. 2013: 954806. doi:10.1155/2013/954806. ISSN 2090-939X. PMC 3767209. PMID 24052891.
- ^ a b c Salazar, Georgina; Zhang, Ningyan; Fu, Tong-Ming; An, Zhiqiang (10 July 2017). "Antibody therapies for the prevention and treatment of viral infections". NPJ Vaccines. 2 (1): 19. doi:10.1038/s41541-017-0019-3. PMC 5627241. PMID 29263875.
- ^ a b Casadevall, A; Dadachova, E; Pirofski, LA (September 2004). "Passive antibody therapy for infectious diseases". Nature Reviews. Microbiology. 2 (9): 695–703. doi:10.1038/nrmicro974. PMID 15372080.
- ^ Kreil, Thomas R. (March 2015). "Treatment of Ebola Virus Infection with Antibodies from Reconvalescent Donors". Emerging Infectious Diseases. 21 (3): 521–523. doi:10.3201/eid2103.141838. PMC 4344290. PMID 25695274.
- ^ Schmidt, Rebecca; Beltzig, Lea C.; Sawatsky, Bevan; Dolnik, Olga; Dietzel, Erik; Krähling, Verena; Volz, Asisa; Sutter, Gerd; Becker, Stephan; von Messling, Veronika (5 October 2018). "Generation of therapeutic antisera for emerging viral infections". NPJ Vaccines. 3 (1). doi:10.1038/s41541-018-0082-4. PMID 30323953.
- ^ Hung, I. F.; To, K. K.; Lee, C.-K.; Lee, K.-L.; Chan, K.; Yan, W.-W.; Liu, R.; Watt, C.-L.; Chan, W.-M.; Lai, K.-Y.; Koo, C.-K.; Buckley, T.; Chow, F.-L.; Wong, K.-K.; Chan, H.-S.; Ching, C.-K.; Tang, B. S.; Lau, C. C.; Li, I. W.; Liu, S.-H.; Chan, K.-H.; Lin, C.-K.; Yuen, K.-Y. (19 January 2011). "Convalescent Plasma Treatment Reduced Mortality in Patients With Severe Pandemic Influenza A (H1N1) 2009 Virus Infection". Clinical Infectious Diseases. 52 (4): 447–456. doi:10.1093/cid/ciq106. PMC 7531589. PMID 21248066.
- ^ World Health Organization. "WHO Use of convalescent whole blood or plasma collected from patients recovered from Ebola virus disease". WHO. Retrieved 5 April 2020.
- ^ Shen, Chenguang; Wang, Zhaoqin; Zhao, Fang; Yang, Yang; Li, Jinxiu; Yuan, Jing; Wang, Fuxiang; Li, Delin; Yang, Minghui; Xing, Li; Wei, Jinli; Xiao, Haixia; Yang, Yan; Qu, Jiuxin; Qing, Ling; Chen, Li; Xu, Zhixiang; Peng, Ling; Li, Yanjie; Zheng, Haixia; Chen, Feng; Huang, Kun; Jiang, Yujing; Liu, Dongjing; Zhang, Zheng; Liu, Yingxia; Liu, Lei (27 March 2020). "Treatment of 5 Critically Ill Patients With COVID-19 With Convalescent Plasma". JAMA. 323 (16): 1582. doi:10.1001/jama.2020.4783. PMC 7101507. PMID 32219428.
- ^ Casadevall, Arturo; Pirofski, Liise-anne (13 March 2020). "The convalescent sera option for containing COVID-19". Journal of Clinical Investigation. 130 (4): 1545–1548. doi:10.1172/JCI138003. PMC 7108922. PMID 32167489.
- ^ a b Bregenholt, S; Jensen, A; Lantto, J; Hyldig, S; Haurum, JS (2006). "Recombinant human polyclonal antibodies: A new class of therapeutic antibodies against viral infections". Current Pharmaceutical Design. 12 (16): 2007–15. doi:10.2174/138161206777442173. PMID 16787244.
- ^ "Our Formulary". Infectious Diseases Laboratories. Centers for Disease Control and Prevention. Archived from the original on 16 December 2016. Retrieved 9 December 2016.
- ^ Multi-National PREVAIL II Study Team, Davey RT Jr, Dodd L, Proschan MA, Neaton J, Neuhaus Nordwall J, Koopmeiners JS, Beigel J, Tierney J, Lane HC, Fauci AS, Massaquoi MBF, Sahr F, Malvy D, et al. (PREVAIL II Writing Group) (13 October 2016). "A Randomized, Controlled Trial of ZMapp for Ebola Virus Infection". New England Journal of Medicine. 375 (15): 1448–1456. doi:10.1056/NEJMoa1604330. PMC 5086427. PMID 27732819.
- ^ "Label - Palivizumab (Synagis), Medimmune, Incorporated" (PDF). Retrieved 4 February 2020.
- ^ VanBlargan, Laura A.; Goo, Leslie; Pierson, Theodore C. (26 October 2016). "Deconstructing the Antiviral Neutralizing-Antibody Response: Implications for Vaccine Development and Immunity". Microbiology and Molecular Biology Reviews. 80 (4): 989–1010. doi:10.1128/MMBR.00024-15. PMID 27784796.
- ^ Kwong, P. D.; Mascola, J. R.; Nabel, G. J. (1 September 2011). "Rational Design of Vaccines to Elicit Broadly Neutralizing Antibodies to HIV-1". Cold Spring Harbor Perspectives in Medicine. 1 (1): a007278. doi:10.1101/cshperspect.a007278. PMC 3234457. PMID 22229123.
- ^ a b Burton, Dennis R. (2002). "Antibodies, viruses and vaccines". Nature Reviews Immunology. 2 (9): 706–713. doi:10.1038/nri891. ISSN 1474-1733. PMID 12209139.
- ^ Kaslow, R. A.; Stanberry, L.R.; Le Duc, J. W., eds. (2014). Viral Infections of Humans: Epidemiology and Control (5th ed.). Springer. p. 56. ISBN 9781489974488. Retrieved 4 April 2020.
- ^ Santoro, MM; Perno, CF (2013). "HIV-1 Genetic Variability and Clinical Implications". ISRN Microbiology. 2013: 481314. doi:10.1155/2013/481314. PMC 3703378. PMID 23844315.
- ^ a b Kumar, R; Qureshi, H; Deshpande, S; Bhattacharya, J (August 2018). "Broadly neutralizing antibodies in HIV-1 treatment and prevention". Therapeutic Advances in Vaccines and Immunotherapy. 6 (4): 61–68. doi:10.1177/2515135518800689. PMC 6187420. PMID 30345419.
- ^ Cohen, J. (2013). "Bound for Glory". Science. 341 (6151): 1168–1171. Bibcode:2013Sci...341.1168C. doi:10.1126/science.341.6151.1168. PMID 24030996.
- ^ Simek, MD; Rida, W; Priddy, FH; Pung, P; Carrow, E; Laufer, DS; Lehrman, JK; Boaz, M; Tarragona-Fiol, T; Miiro, G; Birungi, J; Pozniak, A; McPhee, DA; Manigart, O; Karita, E; Inwoley, A; Jaoko, W; Dehovitz, J; Bekker, LG; Pitisuttithum, P; Paris, R; Walker, LM; Poignard, P; Wrin, T; Fast, PE; Burton, DR; Koff, WC (July 2009). "Human immunodeficiency virus type 1 elite neutralizers: individuals with broad and potent neutralizing activity identified by using a high-throughput neutralization assay together with an analytical selection algorithm". Journal of Virology. 83 (14): 7337–48. doi:10.1128/JVI.00110-09. PMC 2704778. PMID 19439467.
- ^ Haynes, Barton F.; Burton, Dennis R.; Mascola, John R. (30 October 2019). "Multiple roles for HIV broadly neutralizing antibodies". Science Translational Medicine. 11 (516): eaaz2686. doi:10.1126/scitranslmed.aaz2686. PMC 7171597. PMID 31666399.
- ^ "HIV Databases". Los Alamos National Laboratory.
- ^ Corti, D; Cameroni, E; Guarino, B; Kallewaard, NL; Zhu, Q; Lanzavecchia, A (June 2017). "Tackling influenza with broadly neutralizing antibodies". Current Opinion in Virology. 24: 60–69. doi:10.1016/j.coviro.2017.03.002. PMC 7102826. PMID 28527859.
- ^ Colbert, MD; Flyak, AI; Ogega, CO; Kinchen, VJ; Massaccesi, G; Hernandez, M; Davidson, E; Doranz, BJ; Cox, AL; Crowe JE, Jr; Bailey, JR (15 July 2019). "Broadly Neutralizing Antibodies Targeting New Sites of Vulnerability in Hepatitis C Virus E1E2". Journal of Virology. 93 (14). doi:10.1128/JVI.02070-18. PMC 6600205. PMID 31068427.
- ^ Durham, ND; Agrawal, A; Waltari, E; Croote, D; Zanini, F; Fouch, M; Davidson, E; Smith, O; Carabajal, E; Pak, JE; Doranz, BJ; Robinson, M; Sanz, AM; Albornoz, LL; Rosso, F; Einav, S; Quake, SR; McCutcheon, KM; Goo, L (10 December 2019). "Broadly neutralizing human antibodies against dengue virus identified by single B cell transcriptomics". eLife. 8. doi:10.7554/eLife.52384. PMC 6927745. PMID 31820734.
- ^ Goo, L; Debbink, K; Kose, N; Sapparapu, G; Doyle, MP; Wessel, AW; Richner, JM; Burgomaster, KE; Larman, BC; Dowd, KA; Diamond, MS; Crowe JE, Jr; Pierson, TC (January 2019). "A protective human monoclonal antibody targeting the West Nile virus E protein preferentially recognizes mature virions". Nature Microbiology. 4 (1): 71–77. doi:10.1038/s41564-018-0283-7. PMC 6435290. PMID 30455471.
- ^ Bhiman, Jinal N.; Lynch, Rebecca M. (27 March 2017). "Broadly neutralizing antibodies as treatment: effects on virus and immune system". Current HIV/AIDS Reports. 14 (2): 54–62. doi:10.1007/s11904-017-0352-1. ISSN 1548-3568. PMC 5401706. PMID 28349376.



