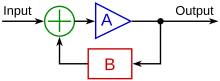
배아내 혈관 리모델링
Vascular remodelling in the embryo혈관 리모델링은 미성숙한 심장이 수축하기 시작하면서 초기 혈관 조직을 통해 액체를 밀어내는 과정이다. 이 과정은 일반적으로 22일에 시작되며 인간의 발생 10주째까지 계속된다. 이 첫 번째 유체 통로는 전단응력과 원주응력을 포함한 물리적 단서에 근거한 신호 캐스케이드와 세포 이동을 개시하는데, 이는 혈관망의 리모델링, 동맥-정체성, 혈관신생성, 기계전도를 통한 유전자 조절에 필요하다. 이러한 배아 과정은 성숙한 혈관망의 미래 안정을 위해 필요하다.[2]
Vasculogenesis는 혈관 네트워크 또는 혈관 트리의 구성요소의 초기 설정이다. 이것은 유전적 요인에 의해 지시되며 순환계의 예비 윤곽을 정립하는 것 외에는 고유의 기능이 없다. 유체 흐름이 시작되면 혈관신생에 의해 설정된 시스템에 생체역학 및 혈류역학적 입력이 적용되며, 능동적 리모델링 과정이 시작될 수 있다.
압력, 속도, 유량 패턴, 전단 응력 등의 물리적 단서는 분지 형태생식, 고유량 영역의 혈관 확대, 혈관신생술, 정맥판막 발달 등 여러 가지 방법으로 혈관망에 작용하는 것으로 알려져 있다. 혈관벽의 내피적이고 매끄러운 근육세포에 대한 이러한 물리적 단서의 기계적인 전도는 혈관확장, 세포정렬 및 기타 전단응력 완화요인을 담당하는 특정 유전자의 촉진 또는 억제를 유발할 수 있다. 이러한 유전학과 환경 사이의 관계는 명확하게 이해되지는 않지만, 연구자들은 유전적으로 절연된 모델 유기체와 조직과 같은 신뢰할 수 있는 유전적 기법과 체내 흐름 패턴, 속도 프로파일, 압력 변동을 측정하고 추적하기 위해 개발된 새로운 기술을 결합하여 이를 명확히 하려고 시도하고 있다.[2]
체내 연구와 모델링 모두 이 복잡한 과정을 이해하는 데 필요한 도구들이다. 혈관 리모델링은 상처 치유와 조직 이식 및 장기 기증을 적절히 통합하는 것과 관련이 있다. 경우에 따라 적극적인 리모델링 과정을 촉진하면 환자들이 더 빨리 회복하고 기증된 조직의 기능적 사용을 유지하는데 도움이 될 수 있다. 그러나 상처 치유 외에 성인에서 만성적인 혈관 리모델링이 심혈관 질환의 증상인 경우가 많다. 따라서 이러한 생물의학 현상에 대한 이해 증가는 치료법의 개발이나 아테롬성 동맥경화증과 같은 질병에 대항하는 예방적 조치를 도울 수 있다.
역사관
100여 년 전 토마 씨는 국소 혈류의 증가가 혈관 직경의 확장을 야기한다는 것을 관찰했고 심지어 혈류의 흐름이 혈관의 성장과 발달을 책임질 수도 있다고 추정하기까지 했다.[3] 그 후 1918년 채프먼은 병아리 배아의 심장을 제거하는 것이 리모델링 과정을 방해한다는 것을 발견했지만, 혈관조영술에 의해 내려졌던 초기 혈관 패턴은 손상되지 않은 채 남아 있었다. 다음으로, 1926년에 Murray는 혈관 직경이 혈관 벽의 전단 응력 양에 비례한다고 제안하였다. 즉, 혈관이 전단 응력과 같은 환경으로부터의 물리적 단서에 기초하여 흐름 패턴에 능동적으로 적응하였다.
수학자 겸 컴퓨터 과학자 앨런 튜링이 1952년 쓴 '모폴생식의 화학적 기반'은 영양소의 분자적 확산에 기초한 다양한 생물학적 모델을 주창했다.[4] 그러나 혈관 발달의 확산 모델은 모세혈관 침대의 복잡성과 동맥과 정맥의 상호연결망에는 미치지 못하는 것 같다.[4][5] 2000년, 플뢰리는 혈관 나무의 분지 형태생식에 대한 책임이 있는 확산 분자 대신에, 장거리 형태생물이 개입될 수 있다고 제안했다. 이 모델에서는 이동 압력파가 전단 응력을 통해 혈관 위에 작용하여 혈류 증가 및 유동 시작 시 네트워크를 재배열하여 분기를 가장 낮은 에너지 구성으로 재배열할 수 있다.[4][6] 기계적인 힘이 혈관 나무의 형태학과 복잡성에 극적으로 영향을 줄 수 있다고 알려져 있다.[5][6] 그러나 이러한 힘은 영양소의 확산에 거의 영향을 미치지 않으며 따라서 영양소와 산소의 획득이 배아 혈관 리모델링에 중요한 역할을 할 것 같지는 않다.[5]
배아에서 혈관 리모델링을 하는 것은 혈관신생과 구별되는 과정이라는 것이 현재 널리 받아들여지고[weasel words][by whom?] 있다. 그러나 이 두 과정은 불가분의 관계에 있다. 혈관신생술은 혈관 리모델링 이전에 발생하지만 혈관망 발달에 필요한 단계로 혈관을 동맥이나 정맥으로 식별하는 데 영향을 미친다. 심장의 수축이 시작되면, 혈관 리모델링은 생체역학 단서와 유체역학에서 비롯되는 힘의 상호작용을 통해 진행되는데, 이것은 세포와 유전적 수준의 변화로 기계전도에 의해 해석된다.
바스쿨로제시스
Vasculogenesis는 초기 Vasculature의 형성이며, 이것은 유전적 요인에 의해 놓여진다.[7] 노른자낭의 중층부에 혈액섬이라고 불리는 구조물이 세포 분화에 의해 내피와 적혈구로 형성된다.[7] 다음으로 모세혈관 플렉서스는 내피세포가 혈액섬에서 바깥쪽으로 이동하면서 형성되며 연속 가닥의 무작위 네트워크를 형성한다.[7] 그리고 나서 이 가닥들은 내피세포가 고체 코드에서 속이 빈 튜브로 자발적 재배열이라는 과정을 거친다.[8]
배아 내부에서 등 대동맥이 형성되고 결국 노른자낭의 모세관 흉골에 심장을 연결한다.[7] 이것은 단단한 내피 튜브의 폐쇄 루프 시스템을 형성한다. 혈류가 시작되기 전, 혈관조영술의 초기 과정에서도 관계의 부분은 동맥이나 정맥의 정체성의 유전자 표지인 에프린이나 신경일린 등을 각각 표현할 수 있다.[7] 이러한 정체성은 아직 다소 유연하지만 초기 특성화는 배아 리모델링 과정에 중요하다.[2]
혈관신생술은 또한 초기 네트워크의 복잡성에 기여한다; 혈관 내피 성장 인자(VEGF)의 표현에 의해 유발되는 압출과 같은 과정에 의해 내피 싹이 형성된다.[8] 이 내피성 싹들은 모선에서 떨어져 자라 더 작은 딸 혈관을 형성하여 새로운 영토에 도달한다.[8] 단일 튜브가 갈라져 두 개의 분기 튜브가 형성되는 현상인 무투시 감각도 혈관신생을 유발한다.[8] 혈관신생술은 일반적으로 혈관으로 개별 장기 시스템을 식민지화하는 데 책임이 있는 반면, 혈관신생술은 네트워크의 초기 파이프라인을 깔고 있다.[9] 혈관 리모델링 시 혈관신생도 발생하는 것으로 알려져 있다.[9]
동맥-정맥 정체성
혈관조형성체를 동맥류 또는 정맥류 식별 세포로 분류하는 것은 적절한 분지 형태학을 형성하기 위해 필수적이다.[2] 초기 혈관조영술의 동맥부분은 ephrinB2와 DLL4를 표현하는 반면 정맥부분은 신경동맥-2와 EPHB4를 표현한다. 이는 루프의 동맥-정맥부분으로부터의 흐름의 안내에 도움을 주는 것으로 여겨진다.[2] 그러나 완전한 리모델링을 위해서는 여전히 심장의 첫 수축에 의해 제공되는 기계적인 단서가 필요하다.[2]
생체역학적으로 추진되는 계층구조 리모델링의 첫 번째 사건은 심장 박동이 시작된 직후에 발생하는데, 이때 작은 모세혈관이 여러 개 융합되어 비텔린 동맥이 형성된다. 이후, 옆가지들은 대동맥에서 분리되어 정맥망에 다시 부착되어 그들의 정체성을 효과적으로 바꿀 수 있다.[10] 이는 동맥 라인의 높은 내강압으로 인해 가지가 다시 동맥 혈관에 부착되는 것을 방지하는 것으로 생각된다[by whom?].[10] 이것은 또한 네트워크의 두 요소들 사이에 션트 형성을 방지한다.[5] 모연 등은 동맥 내피세포가 정맥이 되고 그 반대의 경우도 가능하다는 것을 보여주었다.[11] 그들은 이전에 동맥 표지를 병아리 정맥(또는 그 반대)에 표현했던 메추리 내피관을 접붙여서 시스템의 가소성을 보여주었다. 정맥 대 동맥류(즉, 압력 프로필과 산소 장력)의 물리적 또는 화학적 성질의 차이 때문인지는 분명하지 않지만 동맥 및/또는 정맥의 흐름 패턴 역류도 동일한 영향을 미칠 수 있다.[10]
동맥경화 정체성의 유동성을 보여주는 또 다른 예는 소말리아간 혈관의 유동성이다. 초기에 이 혈관은 대동맥에 연결되어 동맥망의 일부가 된다.[2] 그러나 심맥에서 나오는 새싹은 대동맥에서 서서히 분리되어 정맥이 되는 간혈관과 융합할 수도 있다.[2] 이 과정은 완전히 이해되지는 않지만 압력 및 관류 같은 기계적 힘의 균형을 맞추기 위해 발생할 수 있다.[2]
배아 혈관 리모델링 초기 동맥-정맥 정체성은 유연하며, 동맥 세그먼트가 정맥선으로 재활용되는 경우가 많고, 세그먼트의 물리적 구조와 유전자 표지가 네트워크 자체와 함께 능동적으로 리모델링된다.[10] 이것은 시스템 전체가 일시적인 흐름 패턴과 혈류역학적 신호에 의해 형성될 수 있는 가소성의 정도를 나타내지만, 그러나 유전적 요인은 혈관 정체성의 초기 사양에 역할을 한다.[2]
생물역학
일단 심장이 뛰기 시작하면, 기계적인 힘은 빠르게 확장되고 조직 대사에 도움이 되도록 재편되는 초기 혈관 시스템에 작용하기 시작한다.[9] 혈류가 없는 배아에서 내피세포는 혈관조영술과 유사한 미분화 형태학(성숙한 혈관조직에서 발견되는 평평한 상피세포와 비교)[2]을 유지한다. 일단 심장이 뛰기 시작하면 내피세포의 형태학과 행동이 변한다.[2][12] 심박수를 변화시킴으로써 심장은 또한 새로운 혈관의 싹을 돋우기 위해 시스템에 작용하는 관류나 압력을 조절할 수 있다.[2] 결국, 새로운 혈관의 싹은 자라면서 혈관을 압축하는 다른 배아 조직의 확장에 의해 균형을 이룬다.[5] 이러한 힘의 평형은 혈관 리모델링에 큰 역할을 하지만, 새로운 혈관의 싹을 틔우는 데 필요한 혈관신생 메커니즘은 연구되었지만, 불필요한 가지 성장을 억제하는 데 필요한 리모델링 프로세스에 대해서는 거의 알려져 있지 않다.[2]
혈액이 이 시스템을 관류하면서 혈관벽에 전단력과 압력력을 발휘한다. 동시에 심혈관계계 밖의 조직 증식은 혈관벽의 외부를 밀어낸다. 이러한 힘은 배아 신체의 모든 조직에 영양소와 산소의 저비용 공급을 위한 효율적인 에너지 상태를 얻기 위해 균형을 이루어야 한다.[2] 노른자 주머니(외부 조직)의 성장이 제약되면 혈관 힘과 조직력 사이의 균형이 이동되며, 일부 혈관 분지는 압축 조직을 통해 새로운 경로를 개척할 수 없기 때문에 리모델링 과정에서 분리되거나 감소할 수 있다.[2] 일반적으로 이러한 조직의 강성과 저항성은 그들이 변형될 수 있는 정도와 생물역학적인 힘이 그들에게 영향을 미칠 수 있는 방법을 지시한다.[2]
혈관망의 발달은 조직확장의 압축력과 혈관벽의 원주 스트레치 사이의 균형으로 인해 조직내 각 지점에서 자가조직화된다.[5] 시간이 지남에 따라, 이것은 이주하는 선들이 커브하기 보다는 곧게 된다는 것을 의미한다; 이것은 서로 밀어 붙이는 두 개의 움직이는 경계를 상상하는 것과 비슷하다.[5] 직선 혈관은 경계가 압력 구배를 평준화하는 작용을 했기 때문에 보통 이소압축 선과 평행하다.[5] 또한 혈관 방향은 정상 방향에서 가장 가파른 응력 구배를 따르는 경향이 있다.[5]
또한, 배아 혈관 내부의 생체역학은 중요한 리모델링 효과를 가지고 있다. 압력 변동은 스트레스와 긴장 변동을 초래하며, 이것은 나중에 유기체가 발달할 때 혈관이 하중을 견디도록 "훈련"할 수 있다.[9] 여러 개의 작은 혈관이 융합되면 혈압과 유속이 큰 혈관 나무의 부위에 큰 혈관이 생성될 수도 있다.[10] 머레이의 법칙은 순환계에 맞는 분기의 반지름과 모선의 반지름 사이의 관계다. 이것은 혈관 크기에 의해 제시된 흐름에 대한 가장 낮은 저항(지름이 큰 혈관은 낮은 압력 강하를 나타내기 때문에)과 혈액 자체를 인피니텀을 분산시킬 수 없는 살아있는 조직으로 유지하는 것 사이의 균형을 간략히 설명한다.[2] 따라서 확산만으로는 이를 책임질 수 없기 때문에 장기계에 혈액을 공급하기 위해서는 복잡한 분기가 필요하다.[according to whom?][original research?]
생체역학은 혈관 네트워크 연결에도 작용한다. 내강압력은 혈관 세그먼트를 고압 영역으로 재활용하도록 지시하고,[5] 네트워크를 형성하기 위해 동맥 라인에서 혈관 세그먼트를 분리하고 정맥 라인으로 재접착하는 것을 통제하는 것으로 나타났다.[7] 이러한 유형의 혈관 파단은 심지어 일부 장기 시스템의 개발과 더 큰 유기체의 진화에 간접적인 책임이 있을 수 있는데, 분리 및 이동 없이 태아의 많은 조직들이 혈액 공급에서 분리되지 않은 채로 남아 있기 때문이다.[5] 일단 혈관이 모 동맥에서 벗어나면, 그들은 네트워크의 나머지 부분에 원위 조직을 주입하기 위해 혈관신생을 겪을 수도 있다.[2]
유체 역학
유체 역학 또한 혈관 리모델링에 중요한 역할을 한다. 혈관벽에 적용되는 전단응력은 유체의 점도와 흐름 패턴에 비례한다. 교란된 흐름 패턴은 밸브 형성을 촉진할 수 있으며 압력 상승은 혈관의 방사형 성장에 영향을 줄 수 있다.[9] 수축의 처음 며칠 동안의 원시적인 심장은 근막 펌프라고 가장 잘 묘사되지만, 3일 후에는 흐름이 맥동성이 된다.[9] 맥동 흐름은 혈관 리모델링에 중요한 역할을 하는데, 그 이유는 흐름 패턴이 스트레스의 내피세포로의 기계전도에 영향을 미칠 수 있기 때문이다.[7][13]
레이놀즈 번호와 워머슬리 번호와 같은 차원 없는 관계는 초기 혈관 구조에서 흐름을 설명하는 데 사용될 수 있다.[7] 모든 초기 혈관에 존재하는 낮은 레이놀즈 수는 흐름이 서서히 일어나고 층층이 쌓이는 것으로 간주될 수 있다는 것을 의미한다.[7] 워머슬리 수가 낮다는 것은 점성 효과가 흐름 구조를 지배하고 경계 층은 존재하지 않는 것으로 간주될 수 있다는 것을 의미한다.[7] 이것은 유동 동적 계산이 수학을 단순화하는 특정 가정에 근거할 수 있도록 한다.[original research?]
배아혈관 리모델링 1단계에서는 지름이 큰 혈관에만 고탄력 흐름이 존재하는 것이 아니라, 이는 혈류 첫 이틀 동안의 혈관 리모델링 효과로 인해 저절로 교정된다.[14] 배아 혈관은 혈관의 지름을 높여 압력 증가에 반응하는 것으로 알려져[by whom?] 있다.[9] 성체 혈관에 탄력적인 지지력을 제공하는 평활근 세포와 글리코칼릭스가 없기 때문에 발달한 배아의 혈관은 흐름에 대한 저항력이 훨씬 더 강하다.[7] 이것은 흐름이나 압력의 증가는 성인 혈관에서 경험하는 보다 점진적인 스트레칭과 팽창에 의해서가 아니라 혈관 직경의 빠른 반영구 확장에 의해서만 응답할 수 있다는 것을 의미한다.[7]
라플레이스와 푸아세유 관계를 재정렬하면 원주 스트레스의 결과로 방사형 성장이 발생하고 전단 스트레스의 결과로 원주 성장이 발생한다는 것을 시사한다.[9] 전단 응력은 혈관 벽의 두 고정점 사이의 압력 강하뿐만 아니라 혈관 내부의 속도에 비례한다.[5] 선박 리모델링의 정밀한 메커니즘은 성장을 유도할 수 있는 선박 내벽에 높은 응력이 가해져 선박벽 양쪽의 균일한 압축력과 인장응력을 향한다고 생각된다.[9] 일반적으로 원주잔류응력이 압축성과 인장성이 있어[by whom?] 내피관의 내피층이 외부층보다 더 많이 성장하는 것으로 나타났다.[15]
기계전도와 유전적 조절
배아에서 다른 유형의 흐름 패턴과 다른 물리적 단서가 혈관 리모델링에 다른 영향을 미치는 메커니즘을 기계 전도라고 한다. 발달하는 혈관조직에서 흔히 볼 수 있는 난류 흐름은 난류와 관련된 역류를 방지하는 심장판막 형성에 역할을 한다.[16] 또한 큰 혈관의 이질적인 흐름 패턴이 혈관 한쪽의 PITX2와 같은 유전자를 우선적으로 활성화하거나, 한쪽의 원주 스트레칭을 유도하여 반대쪽에서의 퇴행을 촉진함으로써 비대칭을 발생시킬 수 있는 것으로 나타났다.[6][17] 층류 흐름은 또한 세포사멸 감소, 증식 억제, 세포의 흐름 방향 정렬, 많은 세포 신호 전달 인자의 조절과 같은 유전적 영향을 가지고 있다.[7] 기계전도는 양 또는 음의 피드백 루프에 의해 작용될 수 있으며, 이는 혈관에 배치된 물리적 스트레스나 스트레스에 반응하기 위해 특정 유전자를 활성화하거나 억제할 수 있다.
세포는 세포외 매트릭스와 액틴 사이토스켈레톤 사이의 기계적 연결을 제공하는 수용체인 통합 감지를 통해 흐름 패턴을 읽는다. 이 메커니즘은 세포가 흐름 패턴에 어떻게 반응할지를 지시하고 세포 접착을 중재할 수 있는데, 특히 새로운 혈관의 싹트기와 관련이 있다.[2] 기계전도의 과정을 통해 전단 스트레스는 많은 다른 유전자의 발현을 조절할 수 있다. 생체역학에 의한 혈관 리모델링의 맥락에서 다음과 같은 예가 연구되었다.
- 내피질산화질소 싱타아제(eNOS)는 심장 박동 시작 시 단방향 흐름을 촉진하고 전단 스트레스에[18] 의해 상향 조절된다.
- 혈소판 유도성장인자(PDGF), 변환성장인자베타(TGFβ), 크루펠 유사인자2(Klf-2)는 전단응력에 의해 유도되며 난류 흐름에[7] 대한 내피반응을 다루는 유전자에 상향조절 영향을 미칠 수 있다.
- 전단[2][7] 응력은 혈관 발달, 특히 새로운 혈관의 싹을 담당하는 VEGF 수용체의 인산화 유발
- 저산소증은 새로운 새싹의 성장을 배아의[2] 산소 결핍 영역으로 개척하기 위해 저산소 유도 인자 1(HIF-1) 또는 VEGF의 발현을 유발할 수 있다.
- PDGF-β, VEGFR-2, connexion43은 비정상적인 흐름 패턴에[2] 의해 상향 조정된다.
- 전단응력이 NF-164B를 조절하여 매트릭스 메탈로프로테아제들이 혈관확대를[19] 유발하도록 유도함
다른 흐름 패턴과 지속시간은 전단 응력 조절 유전자에 기초하여 매우 다른 반응을 이끌어낼 수 있다.[7] 유전적 조절과 물리적인 힘 모두 배아 혈관 리모델링의 과정에 책임이 있지만, 이러한 요소들은 거의 동시에 연구되지 않는다.[2][7]
체내 연구
배아 혈관 리모델링의 체내 연구에서 가장 큰 어려움은 혈관 리모델링에 영향을 미칠 수 있는 영양소, 산소 및 기타 신호 전달 요인의 전달에서 물리적 단서의 영향을 분리하는 것이었다.[7] 이전 연구에서는 적혈구가 혈장으로 유입되는 것을 방지하는 등 초기 심혈관 흐름에서 혈액 점도를 제어함으로써 점도와 관련된 전단 응력을 낮추었다.[18] 녹말은 또한 점도와 전단 응력을 증가시키기 위해 혈류로 주입될 수 있다.[18] 배아 내 혈관 리모델링은 산소 공급을 담당하는 적혈구 없이 진행된다는 연구결과가 나왔다.[18] 따라서 혈관 리모델링은 산소의 유무에 좌우되지 않으며 실제로 관류조직이 산소 분만을 요구하기 전에 일어난다.[7] 다만 다른 영양소나 유전적 요인이 혈관 리모델링에 홍보 효과를 줄 수 있을지는 아직 미지수다.[18]
살아있는 배아 혈관의 포물선 속도 프로파일의 측정은 혈관 벽이 생체 활성 효과를 가질 수 있는 층 및 전단 응력 수준에 노출되었음을 나타낸다.[14] 배아 마우스와 닭 정관 체계에 대한 전단 응력은 1 - 5 dyn/cm2이다.[14] 이는 혈관의 단면을 절단하고 개구부의 각도를 관찰하여 잔존 스트레스를 해소하기 위해 구부러지는 것을 관찰하거나 [15]혈관에 존재하는 헤마토크릿을 측정하여 유체의 겉보기 점도를 계산함으로써 측정할 수 있다.[7]
살아있는 배아 발달의 영상화와 점성, 압력, 속도, 흐름 방향의 작은 값들의 정확한 측정과 관련된 어려움 때문에, 이 과정의 정확한 모델을 개발하는 것에 더욱 중요해졌다. 이런 방법으로, 이러한 효과를 체외에서 연구하기 위한 효과적인 방법이 발견될 수 있다.[according to whom?]
모델링
배아의 혈관 리모델링에 대한 유체 영향을 설명하기 위해 많은 모델이 제안되었다. 이러한 유사점에서 종종 놓치는[according to whom?] 한 가지 점은 그 과정이 살아있는 시스템 내에서 발생한다는 사실이다; 막다른 곳에서 떨어져서 다시 붙일 수 있고, 나뭇가지가 접합부나 판막을 형성할 수 있고, 혈관은 극도로 변형되어 새로운 조건에 빠르게 적응하고 새로운 경로를 형성할 수 있다. 이론적으로 혈관 나무의 형성은 퍼콜레이션 이론의 관점에서 생각할 수 있다. 튜브 네트워크는 무작위로 발생하며, 결국 두 개의 분리된 지점과 연결되지 않은 지점 사이에 경로를 설정하게 된다. 일단 몇몇 중요한 숫자의 싹트기 관이 이전에 점유하지 않았던 영역으로 옮겨지면, 이 두 지점 사이에 프랙탈이라고 불리는 경로가 설정될 수 있다.[8] 프랙탈은 생물학적으로 유용한 구조로, 생물학적으로 보면 영양소와 폐기물의 운반 효율이 크게 향상되는 것을 의미한다.[8] 프랙탈 경로는 유연하며, 한 연결이 끊어지면 다른 형태가 되어 경로를 다시 설정한다.[8] 이것은 비록 모형으로 사용할 수는 없지만 혈관 나무가 어떻게 형성되는지를 보여주는 유용한 삽화다. 확산 제한 집계 모델은 체내 혈관 나무와 비교하여 가장 근접한 시뮬레이션 결과를 제공했다. 이 모델은 혈관 벽의 전단 응력 구배를 따라 혈관 성장이 발생하여 혈관 반지름이 성장한다는 것을 시사한다.[20] 확산 제한 집계는 무작위 워커의 융합에 의해 골재가 성장한다는 것을 제안하고, 골재는 압력 구배를 따라 걷는다.[5] 무작위 걷기는 단순히 확산 방정식의 확률 기반 버전이다.[5] 따라서 이 모델을 혈관 트리에 적용할 때 전체 시스템에 걸친 압력의 균형을 유지하기 위해 작고 내성이 있는 혈관을 큰 전도 용기로 교체해야 한다.[5] 이 모델은 주요 라인보다 끝에서 랜덤하게 구조물을 산출하는데, 이것은 속도가 압력 구배와 관련하여 음수일 때 라플라시안 제형이 안정적이라는 사실과 관련이 있다.[5] 주요 라인에서는 항상 그러하지만 작은 새싹에서는 속도가 0을 중심으로 변동하여 불안정한 무작위적인 행동을 하게 된다.[5]
리모델링 과정의 또 다른 큰 구성 요소는 갈라진 혈관이 분리되어 혈액을 균일하게 공급하기 위해 원위 지역으로 이동하는 것이다.[5] 분기형 형태생식은 유량이 충분한 혈관만 확대되는 반면 다른 혈관들은 폐쇄된다는 점에서 유전체 분해 모델을 따르는 것으로 밝혀졌다.[5] 두 개의 튜브가 한 개에서 분리되는 용기 내부의 위치에서, 분할의 한 팔은 닫히고, 분리되고, 다시 부착될 정맥선 쪽으로 이동하기 쉽다. 가지 폐쇄의 결과는 본선에서 흐름이 증가하여 덜 동요하게 되는 반면, 혈액 또한 부족한 부분을 향해 흐르기 시작하는 것이다.[5] 어떤 가지가 닫힐지는 유량, 방향, 분기 각도에 따라 달라진다. 일반적으로 75° 이상의 분기 각도는 더 작은 가지를 닫아야 한다.[5]
따라서, 혈관 리모델링의 몇 가지 중요한 매개변수는 확산 제한 집적 및 유전체 파괴의 결합 모델을 사용하여 설명할 수 있다: 가지가 닫힐 확률(혈관 분할의 플라스틱성), 혈관이 정맥 선에 다시 연결될 확률(새싹 재생성의 플라스틱성), 스프라우의 수축 저항성.팅 팁(외부 압축과 내부 전단 응력 사이의 균형) 및 내부 혈관 확장에 대한 외부 조직 성장 비율. 그러나 이 모델은 배아 혈관 리모델링에 영향을 미칠 수 있는 산소나 신호 전달 요인의 확산은 시행하지 않는다.[5] 이러한 모델들은 생체내 보이는 혈관조직의 대부분의 측면을 몇 가지 다른 전문 사례에서 일관되게 재현한다.[5]
질병 진행에 대한 연구 적용
비임부조직의 혈관 리모델링은 질병 진행의 증상이라고 여겨진다. 심혈관계 질환은 세계적으로[22] 가장 흔한 사망 원인 중 하나로 남아 있으며 혈관의 막힘이나 협착과 관련이 있는 경우가 많아 생물역학적으로 극적인 영향을 미칠 수 있다. 급성 및 만성 리모델링의 경우 막힌 혈관의 직경 감소에 따른 전단 응력 증가는 혈관 손상을 유발하여 전형적인 전단 응력 수준을 회복시킬 수 있다.[6][23] 그러나 팽창은 또한 혈관을 통한 혈류 증가로 이어져 고혈증을 유발할 수 있고, 고통받는 혈관의 하류에 생리적 규제 작용에 영향을 미치며, 동맥경화 판자에 압력을 증가시켜 파열로 이어질 수 있다.[6] 혈관 막힘은 현재 혈관 직경을 강제로 열고 정상 혈류를 회복시키기 위해 수술로 스텐트를 삽입하여 치료하고 있다. 동측 조절기에 대한 전단 응력 증가의 영향을 이해함으로써 선박 막힘을 치료하기 위한 대안적이고 덜 침습적인 방법을 개발할 수 있다.
종양의 증가는 종종 혈관으로 새로운 조직을 관류시키고 그 증식을 지속시키기 위해 혈관 성장과 혈관 리모델링을 재활성화시키는 결과를 낳는다.[2] 종양의 성장은 스스로 조직화되고 성인 조직보다 배아 조직과 더 비슷하게 행동하는 것으로 나타났다.[24] 또한, 종양에서의 혈관 성장과 유동 역학은 배아를 개발하는 과정에서 혈관 성장을 재현하는 것으로 생각된다[by whom?].[2] 이런 의미에서 배아 혈관 리모델링은 종양 성장에 활성화되는 동일한 경로의 모델로 간주될 수 있으며, 이러한 경로에 대한 이해 증가는 종양 형성을 억제할 수 있는 새로운 치료법으로 이어질 수 있다.[original research?]
반대로 혈관신생과 혈관개축은 상처치유와 조직이식의 장기적인 안정성의 중요한 측면이다.[2] 혈관신생술은 혈류가 흐르지 않을 때 새싹이 나는 혈관을 제공하는데, 이 혈관은 손상된 조직으로 옮겨져 관류를 회복한다. 따라서 혈관 리모델링에 대한 연구는 또한 상처 치유를 개선하고 거부반응 발생률을 낮추어 이식에 따른 조직 통합에 도움이 되는 새로운 기법의 개발에 대한 중요한 통찰력을 제공할 수 있다.[according to whom?]
참조
- ^ Walls, J.R., Coultas L. 등. (2008) 생쥐 배아 내 혈관 발달의 3차원 분석. PLoS ONE 3(8): e2853. doi:10.1371/journal.pone.0002853
- ^ a b c d e f g h i j k l m n o p q r s t u v w x y z aa 존스, E.A.V. 외 (2006년 12월) 무엇이 혈관 구조를 결정하는가? 유전자 사전 지정 vs. 혈류역학 생리학 21: 388 – 395. doi:10.1152/physiol.00020.2006.
- ^ 토마, R. (1893) 운터수충겐 ü ber die 히스토제네즈 und Histo-mechanicalik des 1186 Gefé ßsystems. 독일 슈투트가르트: 페르디난트 엥케
- ^ a b c 플뢰리, V. (2000년) 반응-확산 모델에서 분지 형태생성. 물리적 검토 E 61: 4156 – 4160. PMID11088210
- ^ a b c d e f g h i j k l m n o p q r s t u v w Nguyen, T-H, 등(2006년 6월). 분기 형태생식의 역학: 혈액과 조직의 흐름의 영향. 물리적 검토 E 73. doi:10.1103/PhysRevE.73.061907
- ^ a b c d e 콜러, A, Kaley, G. (1996년) 건강 및 질병에서 혈관 내성에 대한 전단 응력에 따른 조절: 내피 역할. 내피성 4: 247 – 272. 도이:10.3109/10623329609024701
- ^ a b c d e f g h i j k l m n o p q r s t 존스, E.A.V. (2010년 4월) 혈관을 개발하는 데 있어 기계 전도 및 혈액 역학 캐나다 화학 공학 저널 88: 136 – 143. doi:10.1002/cjce.20290
- ^ a b c d e f g G.와 S.A. (2005) 뉴먼. 발달된 배아의 생물 물리학 영국 케임브리지: 케임브리지 대학 출판부. ISBN 978-0-521-78337-8
- ^ a b c d e f g h i LA 태버(2001년 6월) 심혈관 개발의 생체역학. 생명공학 연간 검토: 1 – 25. doi:10.1146/annurev.bioeng.3.1.1
- ^ a b c d e 르 노블, F. 외 (2003년 10월) 흐름은 병아리 배아 노른자 주머니에서 동맥-혈관 분화를 조절한다. 개발 131: 361 – 375. doi:10.1242/dev.00929
- ^ 모연, D. 외. (2001년 9월) 조류 배아에서 동맥과 혈관 분화 중 내피세포의 가소성. 개발 128: 3359 – 3370. PMID 11546752
- ^ 와키모토 외 (2000). Na+/Ca2+교환기 유전자의 표적 교란은 심근 세포 사멸과 심장 박동 결함으로 이어진다. 생물 화학 저널 275: 36991 – 36998. doi:10.1074/jbc.M004035200
- ^ 부쉬만, I. 외 (2010년 4월) 맥동성 전단 및 Gja5는 유동성 동맥 발생 시 동맥 정체성을 변조하고 리모델링 이벤트를 수행한다. 개발 137: 2187–2196. PMID 20530546
- ^ a b c 존스, E.A.V. 외 (2004). 포유류 발달 중 혈류역학적 변화 측정. 미국 생리학 저널 심장 및 순환기 생리 287: H1561 – H1569. doi:10.11552/ajpheart.00081.2004
- ^ a b C.J. Chuong과 Y.C. 펑(1986). 동맥의 잔류응력에 대해서. 생물역학 저널 108: 189 – 192. PMID 3079517
- ^ Hove, J.R. 외 연구진 (2003). 심장내 유체 힘은 배아 심장 생성에 필수적인 후생유전적 요인이다. 자연 421: 172 – 177. doi:10.1038/자연01282
- ^ 야시로, K. 외 (2007). 유전자 프로그램에 의해 결정되는 혈액역학은 대동맥 아치의 비대칭 발달을 지배한다. 네이처 450: 285 – 288. 도이:10.1038/네이처06254
- ^ a b c d e 루시티, J.L. 외. (2007년 7월) 마우스 노른자 주머니의 혈관 리모델링을 위해서는 혈류역학적 힘이 필요하다. 개발 134, 3317 – 3326. doi:10.1242/dev.02883
- ^ 카스티에, Y. 외 (2009년 3월) 유동에 의한 혈관 리모델링에서 NF-148B의 역할. 산화 방지제 & 레독스 신호 전달 11: 1641–1649. doi:10.1089/ars.293
- ^ 플뢰리, 브이, 슈워츠, L. (1999년) 단순 혈관 형성 모델로서 전단 응력으로부터의 확산 제한 집합. 프랙탈 7: 33 – 39. doi:10.1142/S0218348X99000050
- ^ 야스오카 외 (2009). 유방암에서 신경근-2의 표현: 림프절 전이와의 상관관계, 좋지 않은 예후, CXCR4 표현의 조절. BMC 암 2009년 9:220. doi:10.1186/1471-2407-9-220
- ^ 멘디스, S. 외 (2011) 심혈관 질환 예방 및 통제에 관한 글로벌 아틀라스. 세계보건기구: 제네바 ISBN 978-92-4-156437-3
- ^ 카스티에, Y. 외 (2005년 8월) p47pox 의존성 NADPH 산화효소는 유동에 의한 혈관 리모델링을 조절한다. Circulation Research 97: 533 – 540. doi:10.161/01.RES.00001859.63239.21
- ^ 도르만, S.와 도이치, A.(2002년). 하이브리드 셀룰러 자동화를 통해 자체 조직화된 분자 종양 성장 모델링. Silico Biology 2: 393 – 406. PMID 12542422