초임계 유체
Supercritical fluid초임계 유체(SCF)는 임계점보다 높은 온도와 압력에 있는 물질로, 액상과 기체상은 따로 존재하지 않지만 [1]고체로 압축하는 데 필요한 압력보다 낮습니다.그것은 기체와 같은 다공질 고형물을 통해 유출될 수 있으며, 이러한 물질을 통해 액체 수송을 느리게 하는 질량 전달 한계를 극복할 수 있습니다.SCF는 액체나 고형물과 같은 물질을 용해하는 능력에서 기체보다 훨씬 우수합니다.또한 임계점에 가까워지면 압력이나 온도의 작은 변화가 밀도에 큰 변화를 일으켜 초임계 유체의 많은 특성을 "미세 조정"할 수 있습니다.
초임계 유체는 가스 행성인 목성과 토성, 지상 행성인 금성, 그리고 아마도 얼음 행성인 천왕성과 해왕성의 대기에서 발생한다.초임계수는 수중 열수 [2]분출구의 일종인 흑인 흡연자로부터 나오는 물과 같이 지구상에서 발견된다.다양한 산업 및 실험실 공정에서 유기 용제의 대체재로 사용됩니다.이산화탄소와 물은 가장 일반적으로 사용되는 초임계 유체이며, 각각 디카페인(decaffeination)과 발전(power-generation)에 사용됩니다.흥미로운 특성은 일부 물질이 용제의 초임계 상태(예: 이산화탄소)에서는 용해되지만 기체 또는 액체 상태에서는 용해되지 않는다는 것이다.이는 용매 내에서 단순히 상전이를 허용하거나 유도함으로써 원하는 위치에 퇴적하기 전에 물질을 추출하여 용액의 다른 곳으로 운반하는 데 사용할 수 있습니다.
특성.
일반적으로 초임계 유체는 기체와 액체 사이에 특성이 있습니다.표 1에 초임계 유체로 일반적으로 사용되는 일부 물질의 임계 특성이 나와 있습니다.
표 1.| 용제 | 분자량 | 임계 온도 | 임계 압력 | 임계 밀도 |
|---|---|---|---|---|
| 출력 | K | MPa(atm) | g/cm3 | |
| 이산화탄소(CO2) | 44.01 | 304.1 | 7.38 (72.8) | 0.469 |
| 물(HO2)† | 18.015 | 647.096 | 22.064 (217.755) | 0.322 |
| 메탄(CH4) | 16.04 | 190.4 | 4.60 (45.4) | 0.162 |
| 에탄(CH26) | 30.07 | 305.3 | 4.87 (48.1) | 0.203 |
| 프로판(CH38) | 44.09 | 369.8 | 4.25 (41.9) | 0.217 |
| 에틸렌(CH24) | 28.05 | 282.4 | 5.04 (49.7) | 0.215 |
| 프로필렌(CH36) | 42.08 | 364.9 | 4.60 (45.4) | 0.232 |
| 메탄올(CHOH3) | 32.04 | 512.6 | 8.09 (79.8) | 0.272 |
| 에탄올(CHOH25) | 46.07 | 513.9 | 6.14 (60.6) | 0.276 |
| 아세톤(CHO36) | 58.08 | 508.1 | 4.70 (46.4) | 0.278 |
| 아산화질소(NO2) | 44.013 | 306.57 | 7.35 (72.5) | 0.452 |
표 2는 일반적인 액체, 가스 및 초임계 유체의 밀도, 확산도 및 점도를 보여줍니다.
표 2| 밀도(kg/m3) | 점도(paPa·s) | 확산도(mm2/s) | |
|---|---|---|---|
| 가스 | 1 | 10 | 1–10 |
| 초임계 유체 | 100–1000 | 50–100 | 0.01–0.1 |
| 액체 | 1000 | 500–1000 | 0.001 |
또한 초임계 유체에는 액체/기상 경계가 없기 때문에 표면 장력이 없습니다.유체의 압력과 온도를 바꿈으로써, 그 성질은 보다 액체 모양 또는 보다 기체 모양으로 "조정"될 수 있다.가장 중요한 특성 중 하나는 유체 속 물질의 용해성입니다.초임계 유체의 용해도는 유체의 밀도(정온)에 따라 증가하는 경향이 있습니다.압력에 따라 밀도가 증가하므로 압력에 따라 용해도가 증가하는 경향이 있습니다.온도와의 관계는 조금 더 복잡하다.일정한 밀도에서 용해도는 온도에 따라 증가합니다.그러나 임계점에 가까워지면 온도가 약간 상승하면 밀도가 급격히 떨어질 수 있습니다.따라서 임계온도에 근접하면 온도가 상승함에 따라 용해도가 떨어졌다가 다시 [6]상승하는 경우가 많습니다.
혼합물
일반적으로 초임계 유체는 서로 완전히 혼합되기 때문에 혼합물의 임계점을 초과할 경우 이원 혼합물이 단일 기체상을 형성합니다.그러나 한 구성 요소가 다른 구성 요소보다 휘발성이 훨씬 높은 시스템에서는 예외가 알려져 있으며, 경우에 따라 구성 요소 임계점보다 높은 고압 및 온도에서 두 개의 불용성 가스상을 형성할 수 있습니다.이 동작은 예를 들어 N-NH23, NH-CH34, SO-N22 및 n-부탄-HO2 [7]시스템에서 발견되었습니다.
이원 혼합물의 임계점은 두 성분의 임계 온도와 압력의 산술 평균으로 추정할 수 있다.
정확성을 높이기 위해 Peng-Robinson과 같은 상태 방정식이나 그룹 기여 방법을 사용하여 임계점을 계산할 수 있습니다.밀도와 같은 다른 특성도 [8]상태 방정식을 사용하여 계산할 수 있습니다.
위상도
그림 1과 그림 2는 위상 다이어그램의 2차원 투영을 보여줍니다.압력-온도상도(그림 1)에서 비등곡선은 기체와 액체영역을 분리하여 임계점에서 종료되며, 여기서 액상과 기체상은 사라지며 단일 초임계상이 된다.
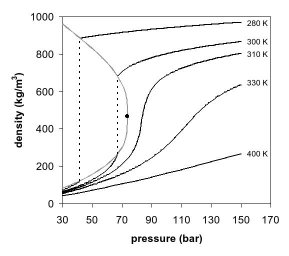
단상의 출현은 이산화탄소에 대한 밀도-압력 위상도(그림 2)에서도 관찰할 수 있다.임계 온도(예: 280K)보다 훨씬 낮은 온도에서 압력이 증가하면 기체가 압축되고 최종적으로 (40bar를 조금 넘는) 훨씬 고밀도 액체로 응축되어 라인(수직 점선)이 중단됩니다.이 시스템은 고밀도 액체와 저밀도 기체의 2상 평형으로 구성되어 있습니다.임계온도(300K)에 가까워질수록 평형상태에서 기체의 밀도가 높아지고 액체의 밀도가 낮아진다.임계점(304.1K 및 7.38MPa(73.8bar))에서는 밀도 차이가 없으며 2상은 하나의 유체상이 된다.따라서 임계 온도 이상에서는 기체가 압력에 의해 액화되지 않습니다.임계 온도(310K)를 약간 웃돌면 임계 압력 부근에서는 선이 거의 수직이 됩니다.압력이 조금만 증가하면 초임계 단계의 밀도가 크게 증가합니다.다른 많은 물리적 특성도 임계점 부근의 압력에 의해 큰 구배를 나타내며, 예를 들어 점도, 상대 유전율 및 용매 강도는 모두 밀도와 밀접하게 관련되어 있다.높은 온도에서 유체는 그림 2에서 볼 수 있듯이 보다 선형적인 밀도/압력 관계로 이상적인 기체와 같은 동작을 하기 시작합니다.이산화탄소가 400K일 경우 밀도는 압력에 따라 거의 선형적으로 증가합니다.
많은 가압가스는 실제로 초임계 유체이다.예를 들어, 질소의 임계점은 126.2K(-147°C)와 3.4MPa(34bar)입니다.따라서 이 압력보다 높은 가스 실린더 내의 질소(또는 압축 공기)는 실제로 초임계 유체입니다.이것들은 종종 영구 가스로 알려져 있다.상온에서는 임계 온도보다 훨씬 높기 때문에 400K 위의 CO와 유사한2 거의 이상적인 기체로 작용합니다.그러나 임계 온도 이하로 냉각되지 않는 한 기계적 압력으로 액화할 수 없으며, 고온에서 [citation needed]액체나 고체를 생성하기 위해 가스 거대 기업 내와 같은 중력 압력이 필요합니다.임계 온도 이상에서는 압력이 높아지면 SCF가 액체 상태의 밀도 및 동작을 보일 정도로 밀도가 증가할 수 있습니다.매우 높은 압력에서는 용해 곡선이 P/T 위상 다이어그램에서 임계점의 오른쪽으로 연장되기 때문에 SCF를 고체로 압축할 수 있습니다.초임계2 CO를 고체로 압축하는 데 필요한 압력은 온도에 따라 570 [9]MPa까지 낮아질 수 있지만, 초임계수 응고에 필요한 압력은 14,000 [10]MPa입니다.
Fisher-Widom 선, Widom 선 또는 Frenkel 선은 초임계 유체 내에서 액체 상태 및 기체 상태를 구분할 수 있는 열역학 개념입니다.
최근 몇 년 동안 초임계 유체의 다양한 특성을 조사하기 위해 상당한 노력을 기울이고 있습니다.이곳은 1822년 찰스 카니어드 드 라 투르 남작이 [11]고온에서 다양한 유체로 채워진 밀폐된 총신에서 소리의 중단과 관련된 실험을 하던 중 초임계 유체를 발견한 이후 오랜 역사를 가진 흥미로운 분야였다.최근에는 꽃에서 꽃향기를 추출하는 것부터 디카페인 커피, 기능성 식재료, 의약품, 화장품, 폴리머, 파우더, 바이오 및 기능성 재료, 나노시스템, 천연생산 등 식품과학 분야에서의 응용에 이르기까지 다양한 분야에서 초임계 유체가 사용되고 있다.cts, 바이오 테크놀로지, 화석 및 바이오 연료, 마이크로 일렉트로닉스, 에너지 및 환경.지난 10년간의 흥분과 관심의 대부분은 관련 실험 도구의 성능을 높이는 데 있어 엄청난 진전이 이루어졌기 때문입니다.새로운 실험 방법의 개발과 기존 방법의 개선은 이 분야에서 계속 중요한 역할을 하고 있으며, 최근의 연구는 유체의 동적 특성에 초점을 맞추고 있다.
자연발생
열수 순환
열수 순환은 지구의 지각 내에서 유체가 가열되고 대류하기 시작하는 곳 어디에서나 일어난다.이러한 유체는 포르피리 구리 퇴적물의 형성이나 해저의 해수 고온 순환과 같은 여러 가지 다른 환경에서 초임계 상태에 도달하는 것으로 생각된다.미드오션 능선에서 이러한 순환은 "블랙 스모커"로 알려진 열수 분출구의 출현으로 가장 뚜렷하게 나타납니다.황화물과 황산염 광물로 이루어진 대형(미터 높이) 굴뚝으로 최대 400°C의 유체를 배출합니다.액체는 액체에 용해된 금속의 침전에 의해 거대한 검은 연기 구름처럼 보입니다.이러한 환기구 현장의 대부분은 깊이에서 초임계 상태에 도달하지만, 해저에 도달할 때쯤에는 아임계 상태가 될 정도로 충분히 냉각된다.특정 환기구 사이트인 Turtle Pits는 환기구 사이트에서 잠깐 동안 초임계 상태를 보였습니다.케이맨 트로프의 또 다른 사이트인 비브는 환기구 오리피스에서 [12]지속적인 초임계 상태를 보이는 것으로 생각됩니다.
행성 대기
금성의 대기는 96.5퍼센트의 이산화탄소와 3.5퍼센트의 질소로 이루어져 있다.표면 압력은 9.3MPa(93bar)이고 표면 온도는 735K로 두 주요 구성 요소의 임계점을 초과하여 표면 대기가 초임계 유체입니다.
태양계의 거대 가스 행성들의 내부 대기는 임계점보다 훨씬 높은 온도에서 주로 수소와 헬륨으로 구성되어 있다.목성과 토성의 기체 외부 대기는 촘촘한 액체 내부로 부드럽게 이행하지만, 해왕성과 천왕성의 전이 구역의 성질은 알려져 있지 않습니다.외계 행성 글리제 876 d의 이론적인 모형은 압력이 가해진 초임계 유체 물의 바다를 바닥에 고체 고압 물 얼음으로 위치시켰다.
적용들
초임계 유체 추출
(액체 추출에 비해) 초임계 유체 추출의 장점은 초임계 유체와 관련된 점도가 낮고 확산성이 높기 때문에 상대적으로 빠르다는 것입니다.초임계 유체에 대한 대체 용제는 물이나 이산화탄소보다 훨씬 더 큰 독성이 있거나 인화성 또는 환경 유해 물질일 수 있습니다.배지의 밀도를 제어함으로써 추출을 어느 정도 선택할 수 있으며, 추출된 물질은 감압만으로 쉽게 회수할 수 있어 초임계 유체가 기상으로 돌아가 용제 잔류물이 거의 또는 전혀 남지 않게 증발할 수 있습니다.이산화탄소는 가장 흔한 초임계 용매이다.그린커피 원두의 탈카페인, [13]맥주 생산용 [14]홉 추출, 식물에서 에센셜 오일 및 의약품 생산에 대규모로 사용된다.몇 가지 실험실 테스트 방법에는 기존 [15][16][17]용제 대신 추출 방법으로 초임계 유체 추출을 사용하는 방법이 있습니다.
초임계 유체 분해
초임계수는 바이오매스의 [18]초임계수 가스화를 통해 바이오매스를 분해하는 데 사용될 수 있다.이러한 유형의 바이오매스 가스화는 효율적인 연소 장치에 사용할 탄화수소 연료를 생산하거나 연료 전지에 사용할 수 있는 수소를 생산하는 데 사용될 수 있습니다.후자의 경우, 물이 전체 반응에서 수소를 제공하는 역할을 하는 증기 개질 때문에 수율이 바이오매스의 수소 함량보다 훨씬 높을 수 있다.
드라이클리닝
PERC(퍼클로로에틸렌) 또는 기타 바람직하지 않은 용제 대신 초임계 이산화탄소(SCD)를 드라이클리닝에 사용할 수 있습니다.초임계 이산화탄소가 버튼에 삽입되어 SCD가 감압되면 버튼이 터지거나 분리되는 경우가 있습니다.이산화탄소에 녹는 세제는 [19]용제의 용해력을 향상시킨다.CO2 기반의 드라이클리닝 장비는 버튼이 손상되지 않도록 초임계2 CO가 아닌 액체2 CO를 사용합니다.
초임계 유체 크로마토그래피
초임계 유체 크로마토그래피(SFC)는 고성능 액체 크로마토그래피(HPLC)와 가스 크로마토그래피(GC)의 많은 장점을 결합한 분석 척도로 사용할 수 있습니다.비휘발성 및 열적 연성 분석 물질(GC와 달리)과 함께 사용할 수 있으며 범용 화염 이온화 검출기(HPLC와 달리)와 함께 사용할 수 있을 뿐만 아니라 빠른 확산으로 인해 좁은 피크를 생성할 수 있습니다.실제로, 키랄 분리 및 고분자량 [20]탄화수소의 분석과 같은 몇 가지 경우를 제외하고, SFC가 제공하는 이점은 널리 사용되는 HPLC와 GC를 대체하기에 충분하지 않았다.제조를 위해 효율적인 사전 시뮬레이션 이동 침대 유닛을 사용할 [21]수 있습니다.완제품의 순도는 매우 높지만, 가격이 비싸 의약품 등 고부가가치 재료에만 적합합니다.
화학 반응
반응 용제의 조건을 변경하면 제품 제거를 위한 상 또는 반응을 위한 단상이 분리될 수 있습니다.빠른 확산은 확산 제어 반응을 가속화한다.온도와 압력은 예를 들어 특정 키랄 이성질체의 [22]수율을 개선하기 위해 선호하는 경로를 감소시킬 수 있습니다.또한 기존 유기 용제에 비해 상당한 환경적 이점이 있습니다.초임계 조건에서 수행되는 산업용 합성에는 초임계 에텐의 폴리에틸렌, 초임계 프로펜의 이소프로필 알코올, 초임계 부텐의 2-부탄올, 질소와 [11]수소의 초임계 혼합의 암모니아가 포함됩니다.과거에는 메탄올의 합성 및 열(비촉매) 오일 크래킹 등 초임계 조건에서 산업적으로 다른 반응이 수행되었습니다.효과적인 촉매의 개발로 인해 이들 두 공정의 필요 온도가 감소하여 더 이상 초임계 [11]상태가 아닙니다.
함침 및 염색
임신은 본질적으로 추출의 반대이다.초임계유체에 물질이 용해되어 용액이 고체기판을 통과하여 기판상에 퇴적 또는 용해된다.분산(비이온) 염료를 사용하여 폴리에스테르 등의 고분자 섬유에 쉽게 염색할 수 있는 염색은 특별한 경우이다.이산화탄소는 또한 많은 폴리머에 용해되어 상당히 부풀어 오르고 가소화되어 확산 과정을 더욱 가속화한다.
나노 및 미립자 형성
분포가 좁은 물질의 작은 입자의 형성은 제약 및 다른 산업에서 중요한 과정이다.초임계 유체는 희석, 감압 또는 이들의 조합에 의해 용질의 포화점을 빠르게 초과함으로써 이를 달성하기 위한 많은 방법을 제공한다.이러한 과정은 액체보다 초임계 유체에서 더 빨리 일어나 결정 성장을 통해 핵생성 또는 스피노달 분해를 촉진하고 매우 작고 일정한 크기의 입자를 생성합니다.최근의 초임계 유체는 입자를 5-2000nm [23]범위까지 줄일 수 있는 능력을 보여주고 있습니다.
의약품 코크리스탈 생성
초임계 유체는 제약 코크리스탈이라고 하는 새로운 형태의 결정성 API(Active Pharmical Christals)를 생성하기 위한 새로운 매체 역할을 합니다.초임계 유체 기술은 기존 기술로는 얻기가 어렵거나 불가능한 입자를 한 단계씩 생성할 수 있는 새로운 플랫폼을 제공합니다.초임계2 CO용매력, 항용제효과 및 그 원자화증강 [24][25]등 서로 다른 초임계 유체특성을 이용하여 SCF의 고유한 특성에 의해 순수 및 건조된 새로운 코크리스탈(API와 결정격자 내의 하나 이상의 컨포머로 이루어진 결정체)의 생성을 달성할 수 있다.
초임계 건조
초임계 건조는 표면 장력 효과 없이 용매를 제거하는 방법이다.액체가 마르면 고체 내부의 작은 구조물에서 표면 장력이 끌리면서 왜곡과 수축을 일으킨다.초임계 상태에서는 표면 장력이 없으며, 초임계 유체를 변형 없이 제거할 수 있습니다.초임계 건조는 에어로겔의 제조 공정과 전자현미경용 고고학적 시료, 생물학적 시료 등 섬세한 재료의 건조 공정에서 사용된다.
초임계수 전기분해
초임계 상태에서 물을 전기분해하면 다른 전해질에서 발견되는 과전압을 감소시켜 산소 및 수소 생산의 전기 효율을 향상시킬 수 있다.
온도가 상승하면 열역학적 장벽이 감소하고 동력이 증가합니다.전극에 산소나 수소의 기포가 형성되지 않아 촉매와 물 사이에 절연층이 형성되지 않아 오믹 손실을 줄일 수 있다.기체와 같은 성질은 빠른 질량 전달을 제공합니다.
초임계수산화
초임계수 산화는 유해 폐기물을 산화시키는 매개체로 초임계수를 사용하여 연소 시 발생할 수 있는 독성 연소 생성물의 생산을 제거합니다.
산화될 폐기물은 산화 반응이 [citation needed]발생하는 분자 산소(또는 분해 시 산소를 포기하는 산화제, 예를 들어 과산화수소)와 함께 초임계수에 용해됩니다.
초임계수 가수분해
초임계 가수분해는 모든 바이오매스 다당류 및 연관된 리그닌을 초임계 조건 하에서 물과 단독으로 접촉함으로써 저분자 화합물로 변환하는 방법이다.초임계수는 용매, 결합을 끊는 열 에너지의 공급원, 열전달제 및 수소 원자의 공급원으로 작용합니다.모든 다당류는 1초 이내에 거의 정량적인 수율로 단당으로 변환된다.리그닌의 지방족 간 고리 연결도 물에서 나오는 수소에 의해 안정화되는 유리기로 쉽게 분해된다.리그닌의 방향족 고리는 짧은 반응 시간에도 영향을 받지 않으므로 리그닌 유래 제품은 저분자량 혼합 페놀이다.분할에 필요한 매우 짧은 반응 시간을 활용하려면 연속 반응 시스템을 고안해야 합니다.따라서 초임계 상태로 가열되는 물의 양이 최소화됩니다.
초임계수 가스화
초임계수 가스화는 초임계수의 유익한 효과를 이용하여 수성 바이오매스 흐름을 깨끗한 물과 H, CH4, CO2,[26] CO 등의2 가스로 바꾸는 과정이다.
발전 시 초임계 유체
열 엔진의 효율은 궁극적으로 열원과 싱크 사이의 온도 차이(카르노 사이클)에 따라 달라집니다.발전소의 효율을 향상시키려면 운전 온도를 높여야 한다.물을 작동 유체로 사용하면 초임계 [27]상태가 됩니다.현재의 [28]테크놀로지를 사용하면, 미임계 운용의 효율은 약 39%에서 약 45%로 향상할 수 있습니다.초임계수형 원자로(SCWR)는 유사한 열효율 향상을 제공하는 발전된 원자력 시스템이다.이산화탄소는 초임계 사이클 원자력 발전소에도 사용될 수 있으며, 이와 유사한 효율성 [29]향상 효과도 얻을 수 있다.많은 석탄 연소식 초임계 증기 발전기가 전 세계에서 가동되고 있으며, 전통적인 증기 발전소의 효율을 향상시켰다.초임계 이산화탄소는 물보다 임계 압력이 낮다는 장점이 있는 작동 유체로도 제안되지만, 부식 문제는 아직 완전히 [30][31]해결되지 않았습니다.제안된 애플리케이션 중 하나는 Allam 사이클입니다.이산화탄소와 물은 모두 중성자 조절제이지만, 그들은 액체 물보다 초임계 유체만큼 밀도가 낮다.이를 통해 초임계 유체를 1차 냉각수로 하는 원자로는 감속 모드("반속" 또는 "발열")로 운전할 수 있지만 일반적으로 고속 중성자 원자로로는 운전할 수 없다.한편 완전 열 중성자 스펙트럼에는 약간의 추가 조절이 필요하다.
바이오디젤 생산
식물성 오일의 바이오디젤로의 전환은 트랜스 에스테르화 반응을 통해 이루어지며, 여기서 트리글리세라이드는 메틸에스테르+글리세롤로 전환된다.이것은 보통 메탄올과 가성 촉매 또는 산 촉매를 사용하여 수행되지만 촉매 없이 초임계 메탄올을 사용하여 수행될 수 있습니다.바이오디젤 생산에 초임계 메탄올을 사용하는 방법은 Saka와 그의 동료들에 의해 처음 연구되었다.원재료(특히 사용후 식용유)의 범위와 수분 함량이 넓어지고 촉매를 제거하기 위해 제품을 세척할 필요가 없으며 [32]연속 공정으로 설계하기 쉬운 장점이 있습니다.
향상된 오일 회수 및 탄소 회수 및 저장
초임계 이산화탄소는 성숙한 유전의 오일 회수율을 높이기 위해 사용된다.동시에, 「청정탄 기술」을 이용해, 강화된 회수 방법과 탄소 격리를 조합할 가능성도 있다.CO는2 다른 연도 가스로부터 분리되고, 초임계 상태로 압축되어 지질 저장소로 주입되며, 수율을 개선하기 위해 기존 유전으로 주입될 수 있습니다.
현재 화석 CO를2 천연 가스에서 분리하는 계획만이 실제로 탄소 저장(예: Sleipner 가스전)[33]을 사용하고 있지만, 향후 연소 전 또는 연소 후2 [34][35][36][37]CO를 포함하는 CCS 계획에 대한 많은 계획이 있다.또한 바이오매스를 이용하여 발전하고 발생하는 CO를2 격리함으로써 대기 중 CO의 양을2 줄일 수 있다.
향상된 지열 시스템
물 대신 초임계 이산화탄소의 사용은 지열 작동 유체로서 검토되었다.
냉동
초임계 이산화탄소는 또한 트랜스임계 [38]사이클을 이용한 새로운 CFC/HFC 미사용 가정용 히트 펌프에 사용되는 유용한 고온 냉매로 부상하고 있습니다.이러한 시스템은 아시아에서 이미 성공적으로 판매되고 있는 초임계 이산화탄소 열 펌프를 통해 지속적으로 개발되고 있습니다.일본의 EcoCute 시스템은 상업적으로 성공한 최초의 고온 가정용 히트 펌프입니다.
초임계 유체 증착
초임계 유체는 기능성 나노구조막과 나노미터 크기의 금속 입자를 표면에 퇴적시키는 데 사용될 수 있습니다.화학 증기 증착에 사용되는 진공 시스템과 비교하여 유체 내 전구체의 높은 확산도와 농도는 표면 반응 속도 제한 상태에서 증착이 일어나 안정적이고 균일한 계면 [39]성장을 제공합니다.이것은 보다 강력한 전자 부품을 개발하는 데 매우 중요하며, 이러한 방식으로 축적된 금속 입자는 화학 합성과 전기 화학 반응을 위한 강력한 촉매이기도 합니다.또한 용액 내 전구체 수송 속도가 높기 때문에 화학 증착 시 시스템의 출구 부근에서 고갈을 보이는 높은 표면적 입자를 코팅할 수 있으며, 또한 수상돌기와 같은 불안정한 계면 성장 특성을 초래할 수 있습니다.그 결과 매우 얇고 균일한 막이 원자층 퇴적 속도보다 훨씬 빠르게 퇴적됩니다. 원자층 퇴적 속도는 이 [40]크기에서 입자 코팅에 가장 적합한 도구입니다.
항균성
고압의2 CO는 항균성을 [41]가지고 있다.다양한 응용 분야에서 그 효과가 입증되었지만, 불활성화 메커니즘은 [42]60년 이상에 걸쳐 조사되었지만 완전히 이해되지 않았다.
역사
1822년, 남작 찰스 카니어드 드 라 투르는 그의 유명한 대포통 실험에서 물질의 임계점을 발견했습니다.그는 다양한 온도의 유체가 채워진 밀폐된 대포에서 굴러가는 부싯돌의 소리를 들으며 임계 온도를 관찰했다.이 온도 이상에서는 액상과 기체상의 밀도가 같아지고 그 차이가 없어져 단일 초임계 [43]유체상이 발생합니다.
「 」를 참조해 주세요.
레퍼런스
- ^ Schlosky, Kevin (1989). "Supercritical phase transitions at very high pressure". J. Chem. Educ. 66 (12): 989. doi:10.1021/ed066p989.
- ^ Koschinsky, Andrea (2008). "Hydrothermal venting at pressure-temperature conditions above the critical point of seawater, 5°S on the Mid-Atlantic Ridge". Geology. 36 (8): 615. doi:10.1130/G24726A.1.
- ^ Reid, Robert C.; Sherwood, Thomas Kilgore; Prasnitz, J. M; Poling, Bruce E. (1987). The Properties of Gases and Liquids (4th ed.). McGraw-Hill. ISBN 9780070517998.
- ^ "International Association for the Properties of Water and Steam". www.iapws.org. Retrieved 2020-01-20.
- ^ Edit Székely. "What is a supercritical fluid?". Budapest University of Technology and Economics. Archived from the original on 2016-01-08. Retrieved 2014-06-26.
- ^ "Supercritical Fluid Extraction, Density Considerations". Retrieved 2007-11-20.
- ^ Gordon, R. P. (1972). "A Supercritical Phase Separation". Journal of Chemical Education. 49 (4): 249–252. doi:10.1021/ed049p249.
- ^ A. A. Clifford (2007-12-04). "Calculation of Thermodynamic Properties of CO2 using Peng–Robinson equation of state". Critical Processes Ltd. Archived from the original on 2008-05-05. Retrieved 2007-11-20.
- ^ Bridgman, P. (1914). "Change of Phase under Pressure. I. The Phase Diagram of Eleven Substances with Especial Reference to the Melting Curve". Phys. Rev. 3 (2): 126. doi:10.1103/PhysRev.3.126.
- ^ Mishima, O. (1978). "Melting curve of ice VII". J. Chem. Phys. 68 (10): 4417. doi:10.1063/1.435522.
- ^ a b c Leitner, Walter (2010). Supercritical Fluids, Vol. 4 of the Handbook of Green Chemistry. Wiley-VCH.
- ^ Webber, A.P.; Murton, B.; Roberts, S.; Hodgkinson, M. "Supercritical Venting and VMS Formation at the Beebe Hydrothermal Field, Cayman Spreading Centre". Goldschmidt Conference Abstracts 2014. Geochemical Society. Archived from the original on 29 July 2014. Retrieved 29 July 2014.
- ^ "The Naked Scientist Interviews". 15 July 2007. Retrieved 2007-11-20.
- ^ Aizpurua-Olaizola, Oier; Ormazabal, Markel; Vallejo, Asier; Olivares, Maitane; Navarro, Patricia; Etxebarria, Nestor; Usobiaga, Aresatz (2015-01-01). "Optimization of Supercritical Fluid Consecutive Extractions of Fatty Acids and Polyphenols from Vitis Vinifera Grape Wastes". Journal of Food Science. 80 (1): E101–E107. doi:10.1111/1750-3841.12715. ISSN 1750-3841. PMID 25471637.
- ^ 미국 EPA 방법 3560 총 회수 가능 탄화수소의 초임계 유체 추출https://www.epa.gov/sites/production/files/2015-12/documents/3560.pdf
- ^ 미국 EPA 방법 3561 다핵 방향족 탄화수소의 초임계 유체 추출https://www.epa.gov/sites/production/files/2015-12/documents/3561.pdf
- ^ 실험실에서의 오존소모물질 사용TemaNord 2003 : 516 . : CS1 maint : 타이틀로서의 아카이브 카피 (링크)
- ^ "Supercritical water gasification of biomas". Archived from the original on 2009-03-23. Retrieved 2011-11-17.
- ^ "Science News Online". Retrieved 2007-11-20.
- ^ Bart, C. J. (2005). "Chapter 4: Separation Techniques". Additives in Polymers: industrial analysis and applications. John Wiley and Sons. p. 212. doi:10.1002/0470012064.ch4. ISBN 978-0-470-01206-2.
- ^ "Simulated Moving Bed Theory" (PDF). Archived from the original (PDF) on 2004-08-29. Retrieved 2007-11-20.
- ^ R. Scott Oakes; Anthony A. Clifford; Keith D. Bartle; Mark Thornton Pett & Christopher M. Rayner (1999). "Sulfur oxidation in supercritical carbon dioxide: dramatic pressure dependent enhancement of diastereoselectivity for sulphoxidation of cysteine derivatives". Chemical Communications. 44 (3): 247–248. doi:10.1039/a809434i.
- ^ Sang-Do Yeo & Erdogan Kiran (2005). "Formation of polymer particles with supercritical fluids: A review". The Journal of Supercritical Fluids. 34 (3): 287–308. doi:10.1016/j.supflu.2004.10.006.
- ^ Padrela, L.; Rodrigues, M.A.; Velaga, S.P.; Matos, H.A.; Azevedo, E.G. (2009). "Formation of indomethacin–saccharin cocrystals using supercritical fluid technology". European Journal of Pharmaceutical Sciences. 38 (1): 9–17. doi:10.1016/j.ejps.2009.05.010. PMID 19477273.
- ^ Padrela, Luis (2010). "Screening for pharmaceutical cocrystals using the supercritical fluid enhanced atomization process". The Journal of Supercritical Fluids. 53 (1–3): 156–164. doi:10.1016/j.supflu.2010.01.010.
- ^ "Reforming in supercritical water". Retrieved 16 May 2017.
- ^ Malhotra, Ashok 및 Satyakam, R, 2000, 초임계 발전소의 최적 설계에 대한 기후 매개변수의 영향,IECEC, 에너지 변환 엔지니어링 컨퍼런스, 페이지 1053–1058,
- ^ "Supercritical steam cycles for power generation applications" (PDF). Archived from the original (PDF) on December 17, 2008. Retrieved 2007-11-20.
- ^ V. Dostal; M.J. Driscoll; P. Hejzlar. "A Supercritical Carbon Dioxide Cycle for Next Generation Nuclear Reactors" (PDF). MIT-ANP-TR-100. MIT-ANP-Series. Retrieved 2007-11-20.
- ^ Sridharan, Kumar. "Corrosion in Supercritical Carbon Dioxide: Materials, Environmental Purity, Surface Treatments, and Flow Issues" (PDF). Nuclear Energy University Programs (NEUP). U.S. Department of Energy. Retrieved 3 April 2022.
- ^ Fleming, Darryn D.; Pasch, James J.; Conboy, Thomas M.; Carlson, Matthew D.; Kruizenga, Alan M. (February 2014). "3 SAND201Corrosion and Erosion Behavior in Supercritical CO2 Power Cycles" (PDF). SANDIA REPORT SAND2014-0602C. Sandia National Laboratories. Retrieved 3 April 2022.
- ^ Kunchana Bunyakiat; Sukunya Makmee; Ruengwit Sawangkeaw & Somkiat Ngamprasertsith (2006). "Continuous Production of Biodiesel via Transesterification from Vegetable Oils in Supercritical Methanol". Energy & Fuels. 20 (2): 812–817. doi:10.1021/ef050329b.
- ^ "Saline Aquifer CO2 Storage". Retrieved 2007-12-10.
- ^ "수소 경제:기회, 비용, 장벽 및 연구개발 요구", 페이지 84 (2004)
- ^ FutureGen 테크놀로지 2008-01-01 웨이백 머신에 아카이브
- ^ øYvind Vessia : "Fischer-Tropsch reactor feed by singas" 2007-09-29 Wayback Machine 아카이브 완료
- ^ 기후변화에 관한 정부간 패널 IPCC 이산화탄소 포집 및 저장에 관한 특별 보고서
- ^ FAQ – 히트펌프 및 기타 애플리케이션에서의 초임계2 CO 2007-10-06년 웨이백 머신에 아카이브
- ^ Ye, Xiang-Rong; Lin, YH & Wai, CM (2003). "Supercritical fluid fabrication of metal nanowires and nanorods templated by multiwalled carbon nanotubes". Advanced Materials. 15 (4): 316–319. doi:10.1002/adma.200390077.
- ^ "SFD compared to CVD". navolta.com. Navolta. Archived from the original on 5 October 2014. Retrieved 3 October 2014.
- ^ Cinquemani, C; Boyle, C; Bach, E & Schollmeyer, E (2007). "Inactivation of microbes using compressed carbon dioxide - An environmentally sound disinfection process for medical fabrics". Journal of Supercritical Fluids. 42 (3): 392–397. doi:10.1016/j.supflu.2006.11.001.
- ^ Fraser, D (1951). "Bursting bacteria by release of gas pressure". Nature. 167 (4236): 33–34. Bibcode:1951Natur.167...33F. doi:10.1038/167033b0. PMID 14796728. S2CID 8130763.
- ^ Berche, Bertrand; Henkel, Malte; Kenna, Ralph (2009). "Critical phenomena: 150 years since Cagniard de la Tour". Journal of Physical Studies. 13 (3): 3001–1–3001–4. arXiv:0905.1886. Bibcode:2009arXiv0905.1886B. doi:10.1590/S1806-11172009000200015. S2CID 5153362.
추가 정보
- Brunner, G. (2010). "Applications of Supercritical Fluids". Annual Review of Chemical and Biomolecular Engineering. 1: 321–342. doi:10.1146/annurev-chembioeng-073009-101311. PMID 22432584.
외부 링크
- 초임계2 CO/물 등의 밀도, 엔탈피, 엔트로피 및 기타 열역학 데이터에 대한 편리한 계산기
- 초임계 유체 임계점과 초임계 유체에서의 용해도를 보여주는 비디오
- New Scientist 환경 발견:지구상에서 가장 뜨거운 물
- Poliakoff, Martyn (28 April 2008). "Supercritical fluids". Test Tube. Brady Haran for the University of Nottingham.