글루타치온S전달효소
Glutathione S-transferase이 기사는 대부분의 독자들이 이해하기에는 너무 전문적일 수 있다.세부사항을 할 수 해 . (2021년 2월) (템플릿메시지 및 에 대해 ) |
| 글루타치온S전달효소 | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 | |||||||||
| 식별자 | |||||||||
| EC 번호 | 2.5.1.18 | ||||||||
| CAS 번호 | 50812-37-8 | ||||||||
| 데이터베이스 | |||||||||
| 인텐츠 | IntEnz 뷰 | ||||||||
| 브렌다 | 브렌다 엔트리 | ||||||||
| ExPASy | NiceZyme 뷰 | ||||||||
| 케그 | KEGG 엔트리 | ||||||||
| 메타사이크 | 대사 경로 | ||||||||
| 프라이머리 | 프로필 | ||||||||
| PDB 구조 | RCSB PDB PDBe PDBum | ||||||||
| 진 온톨로지 | AmiGO / QuickGO | ||||||||
| |||||||||
이전에 리간딘으로 알려진 글루타치온 S-전달효소(GST)는 해독을 목적으로 글루타치온의 환원된 형태(GSH)의 이종 생물 기질에 대한 결합을 촉매하는 능력으로 가장 잘 알려진 진핵 및 원핵 II상 대사 이소자임 계열이다.GST 패밀리는 세 개의 슈퍼 패밀리, 즉 세포질, 미토콘드리아 및 마이크로솜([1][2][3]MAPEG라고도 함)으로 구성됩니다.GST 슈퍼패밀리의 구성원은 아미노산 배열이 매우 다양하며, 공공 데이터베이스에 축적된 배열의 많은 부분은 알려지지 않은 [4]기능이다.효소기능구상(EFI)은 GST를 새로운 GST 기능을 식별하기 위한 모델 슈퍼패밀리로 사용하고 있다.
GST는 일부 포유류의 [5][6]장기에서 세포질 단백질의 최대 10%를 구성할 수 있다.GST는 GSH의 결합을 술프하이드릴기를 통해 촉매 작용시켜 다양한 종류의 기질에 친전자성 중심을 두고 화합물을 수용성을 [7][8]증가시킨다.이 활동은 과산화지질과 같은 내인성 화합물을 해독하고 이생균제의 분해를 가능하게 한다.GST는 또한 독소와 결합할 수 있고 GST의 [9][10]초기 용어인 리간딘을 발생시킨 수송 단백질로 기능할 수 있다.
분류
| 글루타치온S전달효소, C말단 도메인 | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 | |||||||||
| 식별자 | |||||||||
| 기호. | GST_C | ||||||||
| 팜 | PF00043 | ||||||||
| 인터프로 | IPR004046 | ||||||||
| SCOP2 | 2gst/SCOPe/SUPFAM | ||||||||
| OPM 슈퍼 패밀리 | 178 | ||||||||
| OPM단백질 | 59,000 | ||||||||
| CDD | cd00299 | ||||||||
| |||||||||
단백질 배열 및 구조는 GST의 3개 슈퍼 패밀리(세포, 미토콘드리아, MAPEG)에 대한 중요한 추가 분류 기준이다. GST의 세포질 슈퍼 패밀리 클래스는 40% 이상의 배열 호몰로지를 가지지만, 다른 클래스 클래스는 25% 미만을 가질 수 있다.세포질 GST는 그 구조에 따라 알파, 베타, 델타, 엡실론, 제타, 세타, 뮤, 누, 파이, 시그마, 타우, 파이, 오메가 등 13개 등급으로 나뉜다.미토콘드리아 GST는 등급 카파에 속한다.마이크로솜 GST의 MPEG 슈퍼패밀리는 I-IV로 지정된 서브그룹으로 구성되며, 이들 서브그룹 간 아미노산 배열은 20% 미만의 동일성을 공유한다.인간 세포질 GST는 알파, 제타, 세타, 뮤, 파이, 시그마 및 오메가 클래스에 속하며, MAPEG 슈퍼 패밀리의 클래스 I, II, IV에 속하는 6개의 동질효소는 [8][12][13]존재하는 것으로 알려져 있다.
명명법
1992년에 처음 제안된 표준화된 GST 명명법은 관심 동질효소가 속하는 종을 GST의 약어 앞에 있는 소문자 이니셜(예: 인간의 경우 "h")로 식별한다.아이소자임 클래스는 이후 대문자(예: 알파의 경우 "A")로 식별되며, 그 뒤에 클래스 하위 패밀리(또는 하위 단위)를 나타내는 아라비아 숫자가 이어진다.미토콘드리아 GST와 세포질 GST는 모두 이합체로서 존재하며, 같은 클래스의 멤버 사이에 헤테로디머만이 형성되기 때문에 효소 이합체의 두 번째 서브패밀리 성분은 하이픈으로 표시되고, 이어서 아랍어 숫자가 [12][13]추가된다.따라서 인간 글루타치온 S-전달효소가 pi-class subfamily 1의 호모디머일 경우 그 이름은 "hGSTP1-1"로 표기된다.
GST의 초기 명명법은 세파덱스 G75 크로마토그래피를 사용하여 [14]"Y" 분율("X 및 Z" 분율"과 대조적으로 "Y" 분율에서의 분리를 언급하며 이들을 "Y" 단백질이라고 불렀다.GST 서브유닛이 확인되었을 때 필요에 따라 단량체 아이소폼(예: Yb1)을 식별하는 수치와 함께 Ya, Yp 등으로 지칭되었다.리트왁 외 연구진은 이전에 "Y"[10] 단백질로 알려진 단백질을 커버하기 위해 "리간딘"이라는 용어를 제안했다.
임상 화학 및 독성학에서는 알파 GST, 뮤 GST 및 파이 GST라는 용어가 가장 일반적으로 사용됩니다.
구조.
| 식별자 | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| 기호. | GST_N | ||||||||
| 팜 | PF02798 | ||||||||
| 빠맘 클랜 | CL0172 | ||||||||
| 인터프로 | IPR004045 | ||||||||
| 프로 사이트 | PS50404 | ||||||||
| SCOP2 | 1g7o/SCOPe/SUPFAM | ||||||||
| |||||||||
글루타치온 결합 부위 또는 "G-사이트"는 세포질 및 미토콘드리아 GST의 티오레독신 유사 도메인에 위치한다.여러 등급 사이에서 가장 큰 가변성을 갖는 영역은 세 가지 아미노산 잔기 중 하나가 글루타티온의 글리신 잔기와 상호작용하는 나선α2이다.글루타티온과의 상호작용에 기초하여 티로신 잔기를 사용하여 글루타티온을 활성화하는 Y-GST 그룹과 세린 또는 시스테인 [8][4]잔기를 사용하는 S/C-GST의 두 하위 그룹이 특징지어졌다.
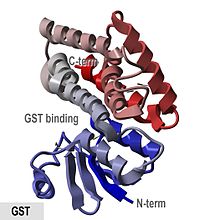
- "GST 단백질은 N-말단 나선 및 베타-스트랜드 도메인과 모든 나선형 C-말단 도메인을 가진 구상 단백질입니다."
돼지 pi-class 효소 pGTSP1-1은 구조가 결정된 최초의 GST이며, 알파 [8][15]헬리크로 구성된 C-말단 도메인과 티오레독신 유사 N-말단 도메인을 포함하는 세포질 GST 슈퍼패밀리의 다른 구성원을 대표한다.
포유류의 세포질 GST는 이합체이며, 두 개의 서브유닛은 반드시 동일하다고는 할 수 없지만 동일한 종류의 GST에서 왔다.단량체의 크기는 [12][16]약 25kDa입니다.이들은 상당히 [17]겹치는 다양한 기판에서 활성화됩니다.다음 표는 UniProtKB/Swiss-Prot 데이터베이스에서 발견된 것처럼 호모 사피엔스에 존재하는 것으로 알려진 각 클래스의 GST 효소를 나열합니다.
| GST 클래스 | 호모 사피엔스 GST 클래스 멤버(22) |
|---|---|
| 알파 | GSTA1, GSTA2, GSTA3, GSTA4, GSTA5 |
| 델타 | |
| 카파 | GSTK1 |
| 뮤 | GSTM1, GSTM1L(RNAi), GSTM2, GSTM3, GSTM4, GSTM5 |
| 오메가 | GSTO1, GSTO2 |
| 파이 | GSTP1 |
| 세타 | GST1, GST2, GST4 |
| 제타 | GSTZ1(일명 MAAI-말릴아세테이트 이성질화효소) |
| 마이크로솜 | MGST1, MGST2, MGST3 |
진화
이 섹션은 확장해야 합니다.추가해서 도와주시면 됩니다. (2021년 1월) |
천연 독소에 의한 환경 도전은 두 [Low et al 2007 1][18]가지 모두를 대사하는[Low et al 2007 2][Low et al 2007 3] Drosophila GST의 진화를 형성함으로써 DDT [Low et al 2007 1][Low et al 2007 2][Low et al 2007 3]도전에 대한 Drosophilae 준비에 도움을 주었다.
기능.
GST의 활성은 합성 효소 감마-글루타밀시스테인 합성효소 및 글루타티온 합성효소로부터 GSH의 꾸준한 공급과 세포에서 GSH의 결합체를 제거하기 위한 특정 전달체의 작용에 좌우된다.GST의 주된 역할은 GSH에 의한 친전자성 탄소, 황 또는 질소 원자에 대한 친핵성 공격을 촉매하여 중요한 세포단백질 및 [13][19]핵산과의 상호작용을 방지하는 것이다.구체적으로, 이 역할에서의 GST의 기능은 두 가지이다: 효소의 소수성 H-사이트와 인접한 친수성 G-사이트에서 기질을 결합하고, 이들은 함께 효소의 활성 부위를 형성하며, 이후 GSH의 티올기를 활성화하여 [12]기질에 대한 친핵 공격을 가능하게 한다.글루타티온 분자는 N-말단 도메인과 C-말단 도메인 사이의 틈에서 결합하며, 촉매적으로 중요한 잔류물은 N-말단 [20]도메인에 상주하도록 제안된다.GST 이합체의 두 서브유닛은 본질적으로 헤테로 또는 호모다이머를 불문하고 단일 비기질 결합 부위와 GSH 결합 부위를 포함한다.그러나 세포질 mu 및 α클래스에 의해 형성되는 것과 같은 헤테로다이머 GST 복합체에서는 두 서브유닛 사이의 균열은 헤테로다이머를 [19][21]형성하는 효소의 능력을 설명할 수 있는 추가적인 고친화성 비기질 이종생물 결합 부위의 홈이 될 수 있다.
그 화합물 이런 식으로 GSTs의 대상이 되어;사실, GSTs β1-8,9-epoxide, 무효 intermediate aflatox으로 구성되어의 결합에 대한 책임이 있거나 그렇지 않으면 외생 환경 독소의 화학적 요원과 다른 마약, 살충제, 제초제, 발암 물질, 그리고 variably-derived epoxides 등 다양한 아우른다.in1 B. 설치류에서 독소를 보호하는 중요한 수단이다.해독반응은 메르캅투르산 [19]합성의 첫 4단계로 구성되며 GSH에 대한 결합은 기질을 보다 용해성 있게 만들고 다제내성관련단백질 1([8]MRP1)과 같은 운반체에 의해 세포에서 제거되도록 한다.수출 후 결합생성물은 메르캅투르산으로 변환되어 소변 또는 [13]담즙을 통해 배설된다.
대부분의 포유류의 이소엔자임은 기질 1-클로로-2, 4-디니트로벤젠에 친화력을 가지며, 이 기질을 이용한 분광광도측정법은 GST 활성을 [22]보고하기 위해 일반적으로 사용된다.그러나 빌리루빈과 같은 일부 내인성 화합물은 GST의 활성을 억제할 수 있다.포유동물에서 GST 등소형은 세포 특이적 분포(예를 들어 간세포의 α-GST, 사람의 [23]간 담도의 δ-GST)를 가진다.
GST는 클로피도그렐 프로드러그의 [24]생체활성화 과정에서 역할을 한다.
셀 시그널링에서의 역할
GST는 GSH에 이종 생물 물질을 결합하여 세포 환경을 해독하는 능력으로 가장 잘 알려져 있지만, 중요한 세포 신호 전달과 함께 비기질 리간드와 결합할 수도 있다.다양한 등급의 몇몇 GST 동질효소는 세포 증식과 죽음을 조절하는 MAPK 경로에 관여하는 키나제의 기능을 억제하여 키나제가 신호 [25]캐스케이드를 촉진하는 역할을 수행하는 것을 막는 것으로 나타났다.
포유동물 GST 계열의 잘 특징지어진 동질효소인 세포질 GSTP1-1은 주로 심장, 폐 및 뇌 조직에서 발현된다. 사실, 그것은 [25][26]간 밖에서 발현되는 가장 흔한 GST이다.대부분의 인간 종양 세포주에서의 과발현과 내화학요법성 종양에서의 유병률에 기초하여 GSTP1-1은 암의 발생과 약물 치료에 대한 잠재적 내성에 역할을 하는 것으로 생각된다.이에 대한 추가적인 증거는 GSTP가 선택적으로 JNK에 의한 C-Jun 인산화를 억제하여 아포토시스를 [25]예방할 수 있다는 지식에서 나온다.낮은 세포 스트레스 기간 동안 복합체는 GSTP와 JNK의 C 말단 사이의 직접 단백질-단백질 상호작용을 통해 형성되어 JNK의 작용과 그에 따른 JNK 경로의 유도를 효과적으로 방지한다.세포산화 스트레스는 복합체의 해리, GSTP의 올리고머화, JNK 경로의 유도를 유발하여 아포토시스를 [27]일으킨다.프로아포토시스 JNK 경로의 GSTP 억제와 약물 내성 종양 세포에서의 아이소자임의 과잉 발현 사이의 연관성은 GSTP의 [25]기질이 아닌 약물에 의해 매개되는 아포토시스로부터 벗어나는 종양 세포의 능력을 설명할 수 있다.
GSTP와 마찬가지로 GSTM1은 JNK의 상류인 ASK1에 작용하지만 직접 단백질-단백질 상호작용을 통해 아포토시스 경로를 조절하는 데 관여한다.GSTM1은 복잡한 형성을 통해 ASK1을 시퀀싱하고 MAPK 시그널링 캐스케이드의 pro-apotic p38 및 JNK 부분을 유도하지 않는다는 점에서 메커니즘과 결과는 GSTP 및 JNK와 유사합니다.GSTP와 마찬가지로 GSTM1은 산화 응력이 없는 상태에서 파트너와 상호작용하지만 ASK1 역시 열충격 반응에 관여하며 ASK1 분리 시에도 마찬가지이다.GST의 높은 수치는 화학요법제를 포함한 다양한 물질에 의해 유도되는 아포토시스 저항성과 관련이 있다는 사실은 MAPK 시그널링 [27]예방에서의 GST의 추정적 역할을 뒷받침한다.
암 발생에 미치는 영향
암 발생과 화학요법 내성에서 GST, 특히 GSTP의 역할을 뒷받침하는 증거가 증가하고 있다.GSTP와 암 사이의 연관성은 많은 암에서 GSTP의 과잉 발현에서 가장 명백하지만, 종양 세포의 변형된 표현형이 비정상적으로 조절된 키나아제 신호 경로 및 과압된 단백질에 대한 세포 중독과 관련이 있다는 사실로도 뒷받침된다.대부분의 항암제가 GSTP에 대한 좋지 않은 기질이라는 것은 많은 종양 세포주에서의 GSTP 상승의 역할은 화합물을 해독하는 것이 아니라 다른 목적을 가지고 있어야 한다는 것을 나타낸다. 이 가설은 또한 약물 [28]내성이 없는 종양 세포주에서의 GSTP 과잉 발현에 대한 일반적인 발견에 의해 신빙성을 부여한다.
임상적 의의
GST는 암 발생 및 화학요법 약물 내성에 대한 역할 외에도 GSH에 관여함으로써 다양한 질환에 관련된다. 비록 GST 다형성이 다양한 유형의 암에 대한 민감성에 미치는 영향에 대한 증거는 미미하지만, 수많은 연구 ha.ve는 천식, 아테롬성 동맥경화증, 알레르기, 그리고 다른 염증 [19]질환의 유전자형 변이를 포함시켰다.
당뇨병은 산화적 손상을 수반하는 질병이고, 당뇨병 환자의 GSH 대사가 기능하지 않기 때문에, GST는 당뇨병 약물 치료의 잠재적 표적이 될 수 있다.또한 인슐린 투여는 PI3K/AKT/mTOR 경로를 통해 GST 유전자 발현을 증가시키고 세포 내 산화 스트레스를 감소시키는 반면 글루카곤은 그러한 유전자 [29]발현을 감소시키는 것으로 알려져 있다.
특히 오메가급 GST(GST) 유전자는 알츠하이머, 파킨슨병, 근위축성 측삭경화증과 같은 신경학적 질병과 관련이 있다. 다시, 산화적 스트레스는 GST 유전자 발현 감소로 질병의 [30]발병 연령이 낮아지는 결과를 초래하는 것으로 여겨진다.
장기 손상을 나타내는 GST 방출
GST의 높은 세포 내 농도는 세포 특이적 세포 분포와 결합되어 정의된 세포 유형에 대한 손상 위치 파악 및 모니터링을 위한 바이오마커로서 기능할 수 있다.예를 들어, 간세포는 높은 수준의 알파 GST를 포함하고 혈청 알파 GST는 이식, 독성 및 바이러스 [31][32][33]감염에서 간세포 손상의 지표로 확인되었다.
마찬가지로 사람의 경우 신장 근위관 세포는 고농도의 알파 GST를 포함하고 원위관 세포는 pi GST를 [34]포함하고 있다.이 특정 분포는 이식, 신독성 및 허혈성 [35]손상에서 신장 관상 손상을 정량화하고 국소화하는 데 요로 GST의 측정을 가능하게 한다.
설치류 전임상연구에서 소변 및 혈청 알파 GST는 각각 [36][37]신장 근위관 및 간세포 괴사의 민감하고 특이적인 징후로 나타났다.
GST 태그 및 GST 풀다운 검사
GST는 풀다운 어세이(pull-down assay)로 알려진 프로세스에서 해당 단백질에 첨가되어 용액에서 정제될 수 있습니다.이는 관심 단백질을 코드하는 염기서열 옆에 GST DNA 코드서열을 삽입함으로써 달성됩니다.따라서 전사 및 번역 후 GST 단백질과 관심 단백질이 융합 단백질로 함께 발현된다.GST 단백질은 GSH에 대한 결합 친화력이 강하기 때문에 이 화합물로 코팅된 비즈를 단백질 혼합물에 첨가할 수 있습니다. 그 결과 GST에 부착된 관심 단백질이 비즈에 부착되어 나머지 GST 단백질로부터 분리됩니다.비즈를 회수하여 유리 GSH로 세척하여 해당 단백질을 비즈에서 분리하여 정제 단백질을 만듭니다.이 기술은 직접 단백질-단백질 상호작용을 설명하기 위해 사용될 수 있다.이 분석의 단점은 관심 단백질이 GST에 부착되어 원어민 [38][39]상태를 바꾼다는 것입니다.
GST-태그는 GST-퓨전 단백질을 포함하는 단백질을 분리 및 정제하는 데 종종 사용됩니다.태그의 크기는 220개의 아미노산([40]약 26kDa)으로, Myc-tag 또는 FLAG-tag와 같은 태그에 비해 상당히 큽니다.단백질의 N 말단 또는 C 말단에 융합될 수 있다.GST는 정제태그로서 기능할 뿐만 아니라 부착단백질의 샤페론으로서 기능하여 올바른 접힘을 촉진하고 세균에 발현되었을 때 봉입체에 응집되는 것을 방지한다.GST 태그는 GST 태그와 관심 단백질 사이에 적절한 절단 부위가 삽입된 경우(일반적으로 GST 태그 부착 [38][41]플라스미드의 많은 상용 공급원에 포함됨) 트롬빈 단백질 분해 효소를 추가하여 정제 후 쉽게 제거할 수 있다.
「 」를 참조해 주세요.
레퍼런스
- ^ a b PDB: 1R5A;Udomsinprasert R, Pongjaroenkit S, Wongsantichon J, Oakley AJ, Prapanthadara LA, Wilce MC, Ketterman AJ (June 2005). "Identification, characterization and structure of a new Delta class glutathione transferase isoenzyme". The Biochemical Journal. 388 (Pt 3): 763–71. doi:10.1042/BJ20042015. PMC 1183455. PMID 15717864.
- ^ Sheehan D, Meade G, Foley VM, Dowd CA (November 2001). "Structure, function and evolution of glutathione transferases: implications for classification of non-mammalian members of an ancient enzyme superfamily". The Biochemical Journal. 360 (Pt 1): 1–16. doi:10.1042/0264-6021:3600001. PMC 1222196. PMID 11695986.
- ^ Allocati N, Federici L, Masulli M, Di Ilio C (January 2009). "Glutathione transferases in bacteria". The FEBS Journal. 276 (1): 58–75. doi:10.1111/j.1742-4658.2008.06743.x. PMID 19016852.
- ^ a b Atkinson HJ, Babbitt PC (November 2009). "Glutathione transferases are structural and functional outliers in the thioredoxin fold". Biochemistry. 48 (46): 11108–16. doi:10.1021/bi901180v. PMC 2778357. PMID 19842715.
- ^ Boyer TD (March 1989). "The glutathione S-transferases: an update". Hepatology. 9 (3): 486–96. doi:10.1002/hep.1840090324. PMID 2646197. S2CID 85179401.
- ^ Mukanganyama S, Bezabih M, Robert M, Ngadjui BT, Kapche GF, Ngandeu F, Abegaz B (August 2011). "The evaluation of novel natural products as inhibitors of human glutathione transferase P1-1". Journal of Enzyme Inhibition and Medicinal Chemistry. 26 (4): 460–7. doi:10.3109/14756366.2010.526769. PMID 21028940. S2CID 41391243.
- ^ Douglas KT (1987). "Mechanism of action of glutathione-dependent enzymes". Advances in Enzymology and Related Areas of Molecular Biology. Advances in Enzymology and Related Areas of Molecular Biology. Vol. 59. pp. 103–67. doi:10.1002/9780470123058.ch3. ISBN 9780470123058. PMID 2880477.
- ^ a b c d e Oakley A (May 2011). "Glutathione transferases: a structural perspective". Drug Metabolism Reviews. 43 (2): 138–51. doi:10.3109/03602532.2011.558093. PMID 21428697. S2CID 16400885.
- ^ Leaver MJ, George SG (1998). "A piscine glutathione S-transferase which efficiently conjugates the end-products of lipid peroxidation". Marine Environmental Research. 46 (1–5): 71–74. doi:10.1016/S0141-1136(97)00071-8.
- ^ a b Litwack G, Ketterer B, Arias IM (December 1971). "Ligandin: a hepatic protein which binds steroids, bilirubin, carcinogens and a number of exogenous organic anions". Nature. 234 (5330): 466–7. Bibcode:1971Natur.234..466L. doi:10.1038/234466a0. PMID 4944188. S2CID 4216672.
- ^ 프로그램 데이터베이스:2GST, 지 씨 X, 존슨을 해나갔죠, Sesay MA, 디커트. L, 프라사드 SM과 암몬 HL, 암스트롱은 공인 등록 간호사, 길리 랜드 GL(1994년 2월)."는 글 투타 티온 S-전달 효소의 생체 이물 기질 결합으로서 제품 단지에 대한 엑스 레이 결정학 상의 분석에 의해의의 diastereomers이 드러나의 구조와 기능(S-glutathionyl)-10-hydroxy-9,10-dihydrophenanthrene".생화학. 33(5):1043–52. doi:10.1021/bi00171a002.PMID 8110735.
- ^ a b c d Eaton DL, Bammler TK (June 1999). "Concise review of the glutathione S-transferases and their significance to toxicology". Toxicological Sciences. 49 (2): 156–64. doi:10.1093/toxsci/49.2.156. PMID 10416260.
- ^ a b c d Josephy PD (June 2010). "Genetic variations in human glutathione transferase enzymes: significance for pharmacology and toxicology". Human Genomics and Proteomics. 2010: 876940. doi:10.4061/2010/876940. PMC 2958679. PMID 20981235.
- ^ Levi AJ, Gatmaitan Z, Arias IM (November 1969). "Two hepatic cytoplasmic protein fractions, Y and Z, and their possible role in the hepatic uptake of bilirubin, sulfobromophthalein, and other anions". The Journal of Clinical Investigation. 48 (11): 2156–67. doi:10.1172/JCI106182. PMC 297469. PMID 4980931.
- ^ Park AK, Moon JH, Jang EH, Park H, Ahn IY, Lee KS, Chi YM (March 2013). "The structure of a shellfish specific GST class glutathione S-transferase from antarctic bivalve Laternula elliptica reveals novel active site architecture". Proteins. 81 (3): 531–7. doi:10.1002/prot.24208. PMID 23152139. S2CID 45431154.
- ^ Landi S (October 2000). "Mammalian class theta GST and differential susceptibility to carcinogens: a review". Mutation Research. 463 (3): 247–83. doi:10.1016/s1383-5742(00)00050-8. PMID 11018744.
- ^ Raza H (November 2011). "Dual localization of glutathione S-transferase in the cytosol and mitochondria: implications in oxidative stress, toxicity and disease". The FEBS Journal. 278 (22): 4243–51. doi:10.1111/j.1742-4658.2011.08358.x. PMC 3204177. PMID 21929724.
- ^ Tang, A H; Tu, C P (1994-11-11). "Biochemical characterization of Drosophila glutathione S-transferases D1 and D21". Journal of Biological Chemistry. 269 (45): 27876–27884. doi:10.1016/S0021-9258(18)46868-8. ISSN 0021-9258. PMID 7961718. Retrieved 2021-01-03.
- ^ a b c d Hayes JD, Flanagan JU, Jowsey IR (2005). "Glutathione transferases". Annual Review of Pharmacology and Toxicology. 45: 51–88. doi:10.1146/annurev.pharmtox.45.120403.095857. PMID 15822171.
- ^ Nishida M, Harada S, Noguchi S, Satow Y, Inoue H, Takahashi K (August 1998). "Three-dimensional structure of Escherichia coli glutathione S-transferase complexed with glutathione sulfonate: catalytic roles of Cys10 and His106". Journal of Molecular Biology. 281 (1): 135–47. doi:10.1006/jmbi.1998.1927. PMID 9680481.
- ^ Vargo MA, Colman RF (January 2001). "Affinity labeling of rat glutathione S-transferase isozyme 1-1 by 17β-iodoacetoxy-estradiol-3-sulfate". The Journal of Biological Chemistry. 276 (3): 2031–6. doi:10.1074/jbc.M008212200. PMID 11031273.
- ^ Habig WH, Pabst MJ, Fleischner G, Gatmaitan Z, Arias IM, Jakoby WB (October 1974). "The identity of glutathione S-transferase B with ligandin, a major binding protein of liver". Proceedings of the National Academy of Sciences of the United States of America. 71 (10): 3879–82. Bibcode:1974PNAS...71.3879H. doi:10.1073/pnas.71.10.3879. PMC 434288. PMID 4139704.
- ^ Beckett GJ, Hayes JD (1987). "Glutathione S-transferase measurements and liver disease in man". Journal of Clinical Biochemistry and Nutrition. 2: 1–24. doi:10.3164/jcbn.2.1.
- ^ 알카탄 A, 알살라민 EClopidogrel 치료의 임상 효과 및 안전성에 영향을 미치는 1상 대사 효소와 관련된 유전자의 다형성.전문가 오피니언 약물 메타독소.2021년 4월 30일 도이: 10.1080/1742555.2021.1925249.인쇄 전에 에퍼브.PMID 33931001.
- ^ a b c d Laborde E (September 2010). "Glutathione transferases as mediators of signaling pathways involved in cell proliferation and cell death". Cell Death and Differentiation. 17 (9): 1373–80. doi:10.1038/cdd.2010.80. PMID 20596078.
- ^ Adler V, Yin Z, Fuchs SY, Benezra M, Rosario L, Tew KD, Pincus MR, Sardana M, Henderson CJ, Wolf CR, Davis RJ, Ronai Z (March 1999). "Regulation of JNK signaling by GSTp". The EMBO Journal. 18 (5): 1321–34. doi:10.1093/emboj/18.5.1321. PMC 1171222. PMID 10064598.
- ^ a b Townsend DM, Tew KD (October 2003). "The role of glutathione-S-transferase in anti-cancer drug resistance". Oncogene. 22 (47): 7369–75. doi:10.1038/sj.onc.1206940. PMC 6361125. PMID 14576844.
- ^ Tew KD, Manevich Y, Grek C, Xiong Y, Uys J, Townsend DM (July 2011). "The role of glutathione S-transferase P in signaling pathways and S-glutathionylation in cancer". Free Radical Biology & Medicine. 51 (2): 299–313. doi:10.1016/j.freeradbiomed.2011.04.013. PMC 3125017. PMID 21558000.
- ^ Franco R, Schoneveld OJ, Pappa A, Panayiotidis MI (2007). "The central role of glutathione in the pathophysiology of human diseases". Archives of Physiology and Biochemistry. 113 (4–5): 234–58. doi:10.1080/13813450701661198. PMID 18158646. S2CID 35240599.
- ^ Board PG (May 2011). "The omega-class glutathione transferases: structure, function, and genetics". Drug Metabolism Reviews. 43 (2): 226–35. doi:10.3109/03602532.2011.561353. PMID 21495794. S2CID 27736207.
- ^ Beckett GJ, Chapman BJ, Dyson EH, Hayes JD (January 1985). "Plasma glutathione S-transferase measurements after paracetamol overdose: evidence for early hepatocellular damage". Gut. 26 (1): 26–31. doi:10.1136/gut.26.1.26. PMC 1432412. PMID 3965363.
- ^ Hughes VF, Trull AK, Gimson A, Friend PJ, Jamieson N, Duncan A, Wight DG, Prevost AT, Alexander GJ (November 1997). "Randomized trial to evaluate the clinical benefits of serum alpha-glutathione S-transferase concentration monitoring after liver transplantation". Transplantation. 64 (10): 1446–52. doi:10.1097/00007890-199711270-00013. PMID 9392310.
- ^ Loguercio C, Caporaso N, Tuccillo C, Morisco F, Del Vecchio Blanco G, Del Vecchio Blanco C (March 1998). "Alpha-glutathione transferases in HCV-related chronic hepatitis: a new predictive index of response to interferon therapy?". Journal of Hepatology. 28 (3): 390–5. doi:10.1016/s0168-8278(98)80311-5. PMID 9551675.
- ^ Harrison DJ, Kharbanda R, Cunningham DS, McLellan LI, Hayes JD (June 1989). "Distribution of glutathione S-transferase isoenzymes in human kidney: basis for possible markers of renal injury". Journal of Clinical Pathology. 42 (6): 624–8. doi:10.1136/jcp.42.6.624. PMC 1141991. PMID 2738168.
- ^ Sundberg AG, Appelkvist EL, Bäckman L, Dallner G (1994). "Urinary pi-class glutathione transferase as an indicator of tubular damage in the human kidney". Nephron. 67 (3): 308–16. doi:10.1159/000187985. PMID 7936021.
- ^ Harpur E, Ennulat D, Hoffman D, Betton G, Gautier JC, Riefke B, Bounous D, Schuster K, Beushausen S, Guffroy M, Shaw M, Lock E, Pettit S (August 2011). "Biological qualification of biomarkers of chemical-induced renal toxicity in two strains of male rat". Toxicological Sciences. 122 (2): 235–52. doi:10.1093/toxsci/kfr112. PMID 21593213.
- ^ Bailey WJ, Holder D, Patel H, Devlin P, Gonzalez RJ, Hamilton V, Muniappa N, Hamlin DM, Thomas CE, Sistare FD, Glaab WE (December 2012). "A performance evaluation of three drug-induced liver injury biomarkers in the rat: alpha-glutathione S-transferase, arginase 1, and 4-hydroxyphenyl-pyruvate dioxygenase" (PDF). Toxicological Sciences. 130 (2): 229–44. doi:10.1093/toxsci/kfs243. PMID 22872058.
- ^ a b Benard V, Bokoch GM (2002). "Assay of Cdc42, Rac, and Rho GTPase activation by affinity methods". G Protein Pathways - Part C, Effector Mechanisms. Methods in Enzymology. Vol. 345. pp. 349–59. doi:10.1016/s0076-6879(02)45028-8. ISBN 9780121822460. PMID 11665618.
- ^ Ren L, Chang E, Makky K, Haas AL, Kaboord B, Walid Qoronfleh M (November 2003). "Glutathione S-transferase pull-down assays using dehydrated immobilized glutathione resin". Analytical Biochemistry. 322 (2): 164–9. doi:10.1016/j.ab.2003.07.023. PMID 14596823.
- ^ Long F, Cho W, Ishii Y (September 2011). "Expression and purification of 15N- and 13C-isotope labeled 40-residue human Alzheimer's β-amyloid peptide for NMR-based structural analysis". Protein Expression and Purification. 79 (1): 16–24. doi:10.1016/j.pep.2011.05.012. PMC 3134129. PMID 21640828.
- ^ Tinta T, Christiansen LS, Konrad A, Liberles DA, Turk V, Munch-Petersen B, Piškur J, Clausen AR (June 2012). "Deoxyribonucleoside kinases in two aquatic bacteria with high specificity for thymidine and deoxyadenosine". FEMS Microbiology Letters. 331 (2): 120–7. doi:10.1111/j.1574-6968.2012.02565.x. PMID 22462611.
Low et al 2007
- Low, Wai Yee; Ng, Hooi Ling; Morton, Craig J.; Parker, Michael W.; Batterham, Philip; Robin, Charles (2007). "Molecular Evolution of Glutathione S-Transferases in the Genus Drosophila". Genetics. Genetics Society of America/Oxford University Press (OUP). 177 (3): 1363–1375. doi:10.1534/genetics.107.075838. ISSN 0016-6731. PMC 2147980. PMID 18039872.
- ^ a b "우리는 이 사이트에서 관찰된 병렬 진화는 환경 독소에 대한 적응 반응이며 역사적 대립 유전자의 배열은 이 독소가 합성 살충제가 아니었음을 암시합니다."
- ^ a b "카자흐스탄, 스웨덴, 우크라이나, 그리고 미국의 1개 라인은 1940년 이전에 수집되었기 때문에 DDT 이전의 라인을 나타냅니다."
- ^ a b "배열 데이터에서 모든 D. melanogaster는 GSTD1의 잔류물 171에 리신을 가지고 있으며, D. simulans 모든 라인은 글리신을 가지고 있습니다.이것은 D. melanogaster의 K171이 전 세계 인구에서 고정될 가능성이 있다는 것을 보여준다.이들 대립 유전자 중 4개는 DDT 사용 전 수집된 라인에서 얻어진 것이므로 DDT 선택에 따라 G171K 변화가 발생했을 가능성은 낮다.게다가 4개의 DDT 전 대립 유전자는 DDTase 활성을 가진 것으로 판명된 GstD1 대립 유전자와 동일한 아미노산 배열을 가지고 있어 DDTase 활성이 DDT보다 앞서 있음을 시사한다.
외부 링크
- 글루타치온 S-전달효소 개요
- 미국 국립의학도서관의 글루타치온+S-전달효소(MeSH)
- EC 2.5.1.18
- GST 융합단백질 제조
- GST 유전자 융합 시스템 핸드북



