파시오라간
Fasciola hepatica| 파시오라간 | |
|---|---|
 | |
| 성체 근막간검체 | |
| 과학적 분류 | |
| 왕국: | 애니멀리아 |
| 문: | 평탄한 문양 |
| 주문: | 플라기오르기아목 |
| 패밀리: | 파시올레과 |
| 속: | 파시오라 |
| 종류: | 간염균 |
| 이항명 | |
| 파시오라간 | |
일반적인 간 요행 또는 양 간 요행으로도 알려진 파시오라 간 요행은 편형동물문인 트레마토다강의 기생 트레마토드이다.그것은 인간을 포함한 다양한 포유류의 간을 감염시키고, 양과 소에 의해 전세계 사람에게 전염된다.이 요행에 의해 발생하는 질병은 근막증 또는 근막증이라고 불리는데, 이것은 일종의 헬민티아스로 방치된 열대성 질환으로 [2]분류되어 왔다.근막증은 현재 식물/식품에 의한 떨림충 감염으로 분류되며,[3] 종종 식물에 있는 기생충의 메타세카리아 엔시스테드를 먹음으로써 감염된다.전 세계에 분포하는 F. hepatica는 수십 년 동안 양과 소의 중요한 기생충으로 알려져 왔고, 이러한 가축 종들에게 상당한 경제적 손실을 입혀 영국에서만 [4]2300만 파운드에 달합니다.비교적 큰 규모와 경제적 중요성 때문에, 그것은 많은 과학적 연구의 대상이 되어 왔고, 어떤 지진해충 종들 중에서 가장 잘 알려져 있을 것이다.F. 간티카의 가장 가까운 친척은 Fasciola gigantica입니다.이 두 마리 플룩은 자매종이다; 그들은 많은 형태학적 특징을 [5]공유하며 서로 짝짓기를 할 수 있다.
라이프 사이클
Fasciola 간염은 최종 호스트의 간에서 발생하며 그 라이프 사이클은 간접적입니다.이 요행의 최종 숙주는 소, 양, 버팔로이다.야생 반추동물과 인간을 포함한 다른 포유동물들도 결정적인 숙주 역할을 할 수 있다.[6]F. 간염의 라이프 사이클은 중간 숙주와 여러 환경 유충 단계를 [7]거칩니다.F. 간염의 중간 숙주는 슴도치과의 공기를 마시는 민물 달팽이입니다.비록 간염에 걸리기 쉬운 림네이드 종들이 여러 개 기술되어 있지만, 기생충은 각 대륙의 한 두 개의 주요 종에서만 발병한다.갈바 트란카툴라는 유럽, 아시아, 아프리카, 그리고 남아메리카에서 주요 달팽이 숙주이다.Lymnaea viator, L. neotropica, Pseudosuccinea columella, L. cubensis는 [5][6]중앙아메리카와 남아메리카에서 가장 흔한 중간 숙주입니다.몇몇 다른 림네이드 달팽이들은 자연적 또는 실험적으로 F. 간염에 감염될 수 있지만, 요충의 전염에서 그들의 역할은 [5]낮다.F. 간염의 자연적 또는 실험적 중간 숙주 역할을 할 수 있는 림네이드 달팽이 목록은 다음을 포함한다.[8]
- 오스트로페레아올룰라
- 오스트로페레아토멘토사
- 오스트로페레아비리디스
- 포사리아불리모이데스
- 갈바트란카툴라
- 린나이아쿠시니
- 쯔바오시
- 린나이아 디아파나
- 히가시카시카미
- 림네아 네오트로피카
- 림나이아 오컬타
- 림네아스테이아
- 림네아 비아트릭스
- 옴피스콜라 글라브라
- 히가시노우치네코루멜라
- 귓바퀴근
- 라고티스 기수
- 나탈렌시스기둥근
- 기수 페레그라
- 루비기노사쿠라
- 스텐키콜라카페라타
- 스텐키콜라후스쿠스
- 히가시노우키
- 강직성 강직증
메타세카리아는 민물 달팽이에서 세카리아로 방출되어 수생식물을 포함한 다양한 표면에 낭종을 형성한다.포유류의 숙주는 이 식물을 먹고 감염될 수 있다.인간은 오염된 물을 마시고 물냉이 같은 민물 식물을 먹음으로써 이러한 감염에 감염될 수 있다.포유동물 숙주의 십이지장 안에서 메타세카리아는 낭종 안에서 방출된다.십이지장에서, 그들은 장 내벽을 통과하여 복막강으로 파고든다.그리고 나서 그들은 장과 간을 거쳐 담관으로 이동한다.담관 안에서, 그것들은 성인 [9]요행으로 발전한다.사람의 경우, F. 간염이 메타세카리아에서 성인 요행으로 성숙하는 데 걸리는 시간은 대략 3~4개월이다.성충은 하루에 [10]요행당 최대 25,000개의 알을 낳을 수 있다.이 알들은 대변을 통해 민물로 방출된다.일단 민물에 들어가면, 알이 생겨나고, 기적으로 부화할 수 있게 하고, 그 후 림내과(Lymnaeidae)의 적절한 중간 달팽이 숙주를 찾습니다.이 달팽이 안에서, 기적은 포자낭으로 발전하고, 그리고 다시 홍반으로 발전하고, 그 다음에 서카리아로 발전합니다.체르카리아는 달팽이에서 방출되어 메타체르카리아를 형성하고 라이프 사이클이 [9]다시 시작됩니다.
형태학 및 해부학
Fasciola hepatica는 길이 30mm,[11] 폭 13mm에 이르는 세계에서 가장 큰 플루크 중 하나입니다(Fasciola gigantica는 더 크고 최대 75mm까지 도달할 수 있습니다).잎 모양이며 뒷면(뒤쪽)은 뾰족하고 앞면(뒤쪽)은 넓다.구강흡입기는 작지만 강력하며, 앞쪽 끝의 원뿔 모양의 돌기 끝에 위치합니다. 어리버리아세트골은 구강 흡인기보다 더 큰 흡인기로 앞쪽 [9]끝에 위치합니다. 어리버리
테그먼트
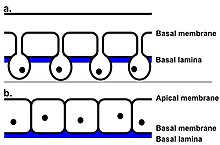
요행의 바깥쪽 표면은 테그먼트라고 불린다.이것은 경단백질로 구성되어 있으며,[12] 주된 기능은 숙주의 파괴적인 소화계로부터 요행을 보호하는 것입니다.그것은 또한 표면 플라즈마 막의 재생과 영양소의 적극적인 흡수를 위해 사용되며, 일부 화합물의 흡수는 [13][14]플루크를 숙주의 소화 시스템에 의해 죽임을 당하는 것을 훨씬 더 저항하게 만듭니다.피부의 표면에는 작은 가시도 있다.처음에 이 가시들은 단일 지점이고, 그 후 요행이 담관으로 들어가기 직전에, 그들은 다중 연결된다.요행의 앞쪽 끝에는 10에서 15개의 포인트가 있는 반면 뒤쪽 끝에는 30개의 [15]포인트가 있습니다.피부는 세포상피입니다.이것은 다핵 세포막을 만들기 위해 각각 하나의 핵을 포함하는 많은 세포들의 융합으로 만들어진다는 것을 의미한다.F. 간염의 경우, 기저막과 꼭대기막 사이의 외부 세포질에는 핵이 없다.따라서 이 영역을 핵산염이라고 한다.대신, 핵은 피막 세포로도 알려진 세포 본체에서 발견되며, 이것들은 얇은 세포질 가닥을 통해 외부 세포질에 연결됩니다.피막 세포는 일반적인 세포질 소기관(미토콘드리아, 골지체, 그리고 소포체)[16]을 포함합니다.피부는 요행이 숙주를 감염시키는 데 중요한 역할을 한다.연구 결과 피부의 특정 부분(이 경우 Teg라는 항원)이 실제로 포유동물 숙주의 면역 반응을 억제할 수 있는 것으로 나타났다.이것은 이 요행이 면역 반응을 약화시킬 수 있고, 성공적인 감염 가능성을 증가시킬 수 있다는 것을 의미한다.요행이 성인으로 발전하고 [17]그 수명을 지속하기 위해서는 성공적인 감염이 필요하다.
소화기 계통
간장의 소화관은 맹인 내장으로 통하는 하나의 입을 가지고 있다. 항문이 없다.입은 요행의 복부 쪽에 있는 앞쪽 흡인기 안에 있습니다. 어리버리이 입은 인두로 이어지며, 그 다음에 좁은 식도가 이어진다.상피세포의 얇은 층이 늘어선 식도는 대장으로 열린다.항문이 없기 때문에 장이 갈라지고, 각각의 가지가 몸의 [18]후단 부근에서 맹목적으로 끝납니다.플룩은 숙주 내에서 먹이를 먹을 때 더 작은 모세혈관과 담관으로 이동합니다.그들은 음식, 담즙,[18] 림프, 그리고 조직 조각을 담관의 벽에서 빼내고 빨아들이기 위해 입 빨대를 사용합니다. 어리버리F. 간염은 숙주의 장내에서 일어나는 세포외 소화에 의존한다.그 폐자재는 입을 통해 분출된다.비폐기물은 요행의 테그먼트와 일반 표면을 통해 다시 흡착됩니다.테그먼트는 [18]표면적을 늘리기 위해 많은 작은 접힘을 포함시킴으로써 흡착을 촉진합니다.
호흡계
F. 간은 호흡기가 없다: 성충은 산소 없이 혐기적으로 호흡한다.숙주 내에서 섭취한 글리코겐은 해당과정에 의해 분해되어 이산화탄소와 지방산을 생성한다.이 과정은 요행에 [19]에너지를 제공한다.반면 기생충의 자유생활 기적은 일반적으로 산소가 풍부한 환경에서 발생한다.기생충의 자유생활 단계는 그들의 [20]환경에서 가장 많은 에너지를 얻기 위해 곡예비행을 하는 것으로 생각된다.
배설계
F. 간 배설 시스템은 하나의 주요 배설관을 둘러싼 관망을 포함합니다.이 관은 요행의 뒤쪽 끝에 있는 배설 기공으로 이어진다.이 주요 관은 몸의 등쪽과 배쪽 영역 내에서 4개의 부분으로 나뉩니다.F. 간 배설계의 역할은 배설과 [19]삼투압 조절이다.배설 시스템 내의 각 튜브는 프로토네프리지아라고 알려진 화염 셀에 연결되어 있습니다.이 세포들은 변형된 실질 조직 세포들이다.F. 간에서 그들의 역할은 배설하는 것이지만, 더 중요한 것은 삼투압 조절 기능을 하는 것이다.따라서 화염 전지는 주로 여분의 [19]수분을 제거하기 위해 사용됩니다.
신경계 및 감각기관
F. 간 신경계는 한 쌍의 신경신경절로 구성되어 있으며, 각각 식도 양쪽에 위치하고 있습니다.식도 주변에는 두 신경절을 연결하는 신경 고리가 있다.신경은 이 고리에서 나와 몸의 뒤쪽 끝에 도달한다.후단에서, 한 쌍의 신경은 다른 신경보다 두꺼워진다; 이것들은 측두신경줄이라고 알려져 있다.이 외측 신경줄에서 다른 신경은 분기한다.F.[21][22] 간에는 감각기관이 없다.
생식계
F. 간성 플룩은 양성애자이고, 각각은 수컷과 암컷의 생식기를 모두 포함하고 있다.수컷과 암컷의 생식기는 몸 안에 있는 생식기 아트리움이라고 불리는 같은 방으로 개방된다.생식기 [21]아트리움은 생식기 모공을 통해 요행의 바깥쪽으로 열리는 외배낭이다.고환은 두 개의 분기된 관으로 이루어져 있으며, 이것들은 몸의 중간과 뒷부분에 위치하고 있습니다.세관의 상피 라이닝으로부터 정자가 생성된다.그리고 나서 정자는 정낭으로 통과하고 정낭으로 들어간다.정낭에서 사정관을 돌출시키고, 이것은 생식기 심방으로 열리며, 많은 전립샘들이 이 [21]구멍을 둘러싸고 있습니다.앞 고환의 오른쪽에는 가지 모양의 관 모양의 난소가 있다.여기서부터 짧은 난관이 비텔린 덕트로 통한다.이 도관은 접합부를 통해 난소, 자궁, 그리고 노른자 저장고를 연결합니다.이 접합부에서, 자궁은 생식기 심방으로 열린다; 이 구멍은 메를리스선으로 둘러싸여 있다.일부 플룩스에서는 자궁의 끝부분이 근육과 [21]가시에 의해 강화된다.
간세포는 성충을 통해 성적으로, 성충을 통해, 그리고 무성적으로 번식한다.미라키디아는 중간 달팽이 [23]숙주 내에서 무성생식을 할 수 있다.
게놈
2015년 게놈 염기서열 초안을 발간한 간티카균은 지금까지 염기서열 분석 결과 중 핵 게놈 크기가 가장 큰 것으로 알려졌다.이는 약 1.[24]3Gb로 트레머토드 [25]중 두 번째로 큰 634.5Mb의 오피소르키스 비버리니의 2배에 달한다.게놈은 10쌍의 염색체에 포함되어 있다.단백질 코드 배열은 전체 [24]게놈의 약 32%에 해당하는 약 21.8Mb와 반복 DNA 배열을 포함한다.예측되는 유전자의 수는 14,[26]642개이다.미토콘드리아 게놈은 12개의 단백질 인코딩,[27] 2개의 리보솜, 22개의 전달 RNA 유전자를 포함하는 14462 bp로 구성되어 있다.
유병률
현재 F. 간염은 기생충과 벡터 매개성 질병 중 가장 넓은 지리적 확산을 가지고 있다.유럽에서 시작된 이 나라는 남극 [30]대륙을 제외한 모든 대륙에 걸쳐 50여 개국으로 확장되었다.이와는 대조적으로, F. gigantica는 일반적으로 아프리카,[28] 아시아, 중동의 열대 지역에 지리적으로 더 제한적인 것으로 간주되며, 두 종 사이에 일부 중복이 있다.
기후는 간염균과 중간 숙주인 달팽이 모두에게 영향을 미친다.예를 들어 간경련과 유충의 발생과 Galba Trunkatula의 번식은 10~25°C의 온도 범위를 필요로 한다.또한, 둘 다 건조 위험이 있기 때문에 공기 중에 높은 수준의 수분을 필요로 합니다.이 때문에 간염의 유병률은 감염 강도와 함께 주로 강우량과 [30]온도에 따라 결정된다.
기생 적응
F. 간피카 성분은 숙주의 소화기 [14]계통의 효소로부터 물을 통과시키는 동안에도 그것을 보호합니다.자유수영 애벌레는 섬모를 가지고 있고, 서카리아는 그들이 수중 환경을 헤엄치는 것을 돕고 또한 그들이 [29]낭종을 형성하는 식물에 도달할 수 있게 해주는 근육질의 꼬리를 가지고 있습니다.숙주 내에 부착하기 위해, 간피카에는 구강흡입기와 몸의 가시가 있습니다. 어리버리그들의 인두는 또한 그들이 몸 안의 조직, [31]특히 담관 안에 있는 조직들을 빨 수 있도록 도와줍니다.성인 요행수의 호흡은 혐기성이기 때문에 [19]간에는 산소가 없기 때문에 이상적입니다.간염균은 많은 알을 낳도록 적응되어 있으며, 이는 많은 알이 환경에 방출되면서 파괴되기 때문에 생존 가능성을 높인다.또한 간엽충은 암수동물이기 때문에 모든 플루크균이 알을 낳을 수 있어 개체군이 [21]낳는 자손의 수가 증가한다.
F. 간염의 게놈은 [32]2015년에 발표되었다.1.3 Gb로, 그것의 게놈은 알려진 가장 큰 병원체 게놈 중 하나이다.게놈은 많은 다형성을 포함하고 있으며, 이것은 요행이 진화하고 숙주의 가용성, 약물 또는 백신 [24]개입과 같은 환경의 변화에 빠르게 적응할 수 있는 가능성을 나타냅니다.
역학
전염병에 대한 자세한 내용은 질병 페이지인 근막증(Fasciolosis)을 참조하십시오.
낭종이 덮인 수생식물을 먹거나 메타세카리아가 함유된 물을 마시면 감염이 시작된다.영국에서는 F. 간염이 반추동물의 질병을 자주 유발하는데, 가장 흔한 것은 3월과 12월 [33]사이입니다.
인간은 물냉이를 먹거나 물냉이 주스를 떨어뜨리는 페루 음료인 '에모리엔테'를 마셔서 감염된다.소와 양은 저지대의 늪지대 [33]목초지에서 기생충의 감염 단계를 섭취할 때 감염된다.
인간 감염은 세계 75개국 이상에서 보고되었다.아시아와 아프리카에서는 F. 간티카와 F. 기간티카에 감염되는 반면, 남미와 중미,[34] 유럽에서는 F. 간티카에 의해서만 근막증이 발생한다.
F. 간염의 존재는 소의 소결핵 검출을 방해할 수 있다.F. 간염과 함께 감염된 소는 M. bovis에만 감염된 소에 비해 단일 피내 비교 자궁경부 투베르쿨린([35]SICCT) 검사에 약하게 반응한다.따라서, F. 간염에 의한 감염은 소의 결핵을 발견하는 것을 어렵게 할 수 있다; 물론 이것은 농업에서 [36]큰 문제이다.
근막증
F. 간염과 F. 기간티카 모두 근막증을 일으킬 수 있다.사람의 증상은 만성 질환인지 급성 질환인지에 따라 다르다.급성 단계 동안, 미성숙한 벌레들은 발열, 메스꺼움, 부은 간(Fh8에 의해 유발됨), 피부 발진, 그리고 극심한 [37]복통 등의 증상을 일으키며 내장에 침투하기 시작합니다.지렁이가 담관에서 성숙할 때 만성적으로 발생하며 간헐적인 통증, 황달, [37]빈혈 등의 증상을 일으킬 수 있다.소와 양의 경우, 만성적인 설사, 만성적인 체중 감소, 빈혈, 그리고 [38]우유 생산량 감소를 포함합니다.일부는 증상이 없다.F. 간염은 양과 소의 내부 출혈과 간 [4]손상으로 인해 돌연사를 일으킬 수 있습니다.
근막증은 유제품과 육류 산업에서 생산과 경제적 손실의 중요한 원인이다.몇 년 동안 유병률은 증가했고 [39]앞으로도 계속 증가할 것으로 보인다.가축은 종종 플루크제,[40][41] 브로모페노포스, 트리라벤다졸, 그리고 비티오놀을 포함한 플루크에게 독성이 있는 화학 물질로 처리된다.많은 기생충에 널리 사용되는 이베르멕틴은 플라지칸텔과 [42][43]마찬가지로 간충에 대한 효과가 낮다.인간의 경우 제어 유형은 설정에 따라 달라집니다.한 가지 중요한 방법은 물냉이와 같은 식용 수초의 성장과 판매를 엄격하게 통제하는 것이다.이것은 매우 풍토적인 지역에서 특히 중요하다.일부 농장은 오염된 물로 관개되기 때문에,[9] 그러한 땅에서 재배된 채소는 먹기 전에 깨끗이 씻어서 익혀야 한다.
근막증을 예방하는 가장 좋은 방법은 림네이드 달팽이 개체 수를 줄이거나 달팽이가 [38]있는 지역에서 가축을 분리하는 것이다.이 두 가지 방법이 항상 가장 실용적인 것은 아니기 때문에, 잠재적으로 감염되기 전에 무리를 치료함으로써 통제가 일반적으로 행해진다.
진단.
변에서 황갈색 계란을 발견함으로써 진단을 내릴 수 있다.F. magna의 알은 양, 염소 또는 소에게 거의 전달되지 않지만, 그들은 Fasciolides magna의 알과 구별할 수 없습니다.감염된 간을 먹고 난자가 대변을 통해 몸 밖으로 나오면 잘못된 양성 반응이 나올 수 있다.무간식사 중 매일 검사를 하면 이 잘못된 [44]진단이 드러날 것이다.
효소연계면역흡수검사(ELISA) 테스트는 선택되는 진단검사입니다.ELISA는 시판되고 있으며 혈청 및 우유에서 항간질 항체를 검출할 수 있습니다. 대변 샘플에 사용하기 위한 새로운 테스트가 [45]개발되고 있습니다.ELISA를 사용하는 것은 웨스턴 블롯이나 Arc2 면역확산을 [33]사용하는 것보다 더 구체적이다.F. 간에서 분비되는 단백질 분해 효소는 항원 [46]면역에 실험적으로 사용되어 왔다.
「 」를 참조해 주세요.
레퍼런스
- ^ 린나이 (1758년-1759년)Systema Naturae per Regna Tria Naturae, Secundum Classes, Ordines, 속, 종, cum Haracteribus, Differentiis, Synonis, Locis. 토무스 1세홀미애:임펜시스 다이렉트로랑티 살비이doi: 10.5962/104l.542
- ^ "Neglected Tropical Diseases". cdc.gov. June 6, 2011. Retrieved 28 November 2014.
- ^ Mas-Coma, S; Bargues, MD; Valero, MA (2005). "Fascioliasis and other plant-borne trematode zoonoses". International Journal for Parasitology. 35 (11): 1255–1278. doi:10.1016/j.ijpara.2005.07.010. PMID 16150452.
- ^ a b "NADIS - National Animal Disease Information Service -". www.nadis.org.uk. Retrieved 2016-04-30.
- ^ a b c Mas‐Coma, Santiago; Valero, María Adela; Bargues, María Dolores (2009). "Fasciola, Lymnaeids and Human Fascioliasis, with a Global Overview on Disease Transmission, Epidemiology, Evolutionary Genetics, Molecular Epidemiology and Control". Advances in Parasitology. Vol. 69. pp. 41–146. doi:10.1016/S0065-308X(09)69002-3. ISBN 978-0-12-374795-2. PMID 19622408.
- ^ a b Torgerson, P; Claxton JR (1999). "Epidemiology and Control". In Dalton, JP (ed.). Fasciolosis. Wallingford, Oxon, UK: CABI Pub. pp. 113–149. ISBN 978-0-85199-260-0.
- ^ Andrews, JS (1999). "Life cycle of Fasciola hepatica". In Dalton, JP (ed.). Fasciolosis. Wallingford, Oxon, UK: CABI Pub. pp. 1–30. ISBN 978-0-85199-260-0.
- ^ Correa, C. A.; Escobar, J. S.; Durand, P.; Renaud, F.; David, P.; Jarne, P.; Pointier, J.-P.; Hurtrez-Boussès, S. (2010). "Bridging gaps in the molecular phylogeny of the Lymnaeidae (Gastropoda: Pulmonata), vectors of Fascioliasis". BMC Evolutionary Biology. 10: 381. doi:10.1186/1471-2148-10-381. PMC 3013105. PMID 21143890.
- ^ a b c d "Parasites – Fascioliasis (Fasciola Infection)". cdc.gov. January 10, 2013. Retrieved 12 March 2016.
- ^ Valero, M. Adela; Panova, Miroslava; Comes, Ana M.; Fons, Roger; Mas-Coma, Santiago (April 2002). "Patterns in size and shedding of Fasciola hepatica eggs by naturally and experimentally infected murid rodents". Journal of Parasitology. 88 (2): 308–313. doi:10.1645/0022-3395(2002)088[0308:PISASO]2.0.CO;2. hdl:10550/16781. PMID 12054003. S2CID 41190159.
- ^ Prevention, CDC - Centers for Disease Control and. "CDC - Fasciola - Biology". www.cdc.gov. Retrieved 2016-04-30.
- ^ Bils, R. F.; Martin, W. E. (1966). "Fine Structure and Development of the Trematode Integument". Transactions of the American Microscopical Society. 85 (1): 78–88. doi:10.2307/3224777. JSTOR 3224777. PMID 5908220.
- ^ Wilson, R. Alan; Wright, Janelle M.; de Castro-Borges, William; Parker-Manuel, Sophie J.; Dowle, Adam A.; Ashton, Peter D.; Young, Neil D.; Gasser, Robin B.; Spithill, Terry W. (November 2011). "Exploring the Fasciola hepatica tegument proteome". International Journal for Parasitology. 41 (13–14): 1347–1359. doi:10.1016/j.ijpara.2011.08.003. PMID 22019596.
- ^ a b Hamali, Bulut; Kudlacek, Oliver; Sehr, Eva Maria; Molin, Martina; Jaentsch, Kathrin; Freissmuth, Michael; Burger, Melanie; Schicker, Klaus; Wischnitzki, Elisabeth (2018). "Identification and characterization of the Fasciola hepatica sodium- and chloride-dependent taurine transporter". PLOS Neglected Tropical Diseases. 12 (4): e0006428. doi:10.1371/journal.pntd.0006428. PMC 5942844. PMID 29702654.
- ^ Bennett, Clive E. (1975). "Scanning Electron Microscopy of Fasciola hepatica L. during Growth and Maturation in the Mouse". The Journal of Parasitology. 61 (5): 892–8. doi:10.2307/3279230. JSTOR 3279230. PMID 1185431.
- ^ Southgate, V. R. (2009). "Observations on the epidermis of the miracidium and on the formation of the tegument of the sporocyst of Fasciola hepatica". Parasitology. 61 (2): 177–90. doi:10.1017/S0031182000040993. PMID 5483910.
- ^ Hamilton, C. M.; Dowling, D. J.; Loscher, C. E.; Morphew, R. M.; Brophy, P. M.; O'Neill, S. M. (2009). "The Fasciola hepatica Tegumental Antigen Suppresses Dendritic Cell Maturation and Function". Infection and Immunity. 77 (6): 2488–2498. doi:10.1128/IAI.00919-08. PMC 2687350. PMID 19332532.
- ^ a b c Kotpal, RL (2012). Modern Text Book of Zoology: Invertebrates. New Delhi: Rastogi Publications. p. 338. ISBN 978-81-7133-903-7.
- ^ a b c d Bhatnagar, MC; Bansal, G (2009). Non-Chordata. Delhi: Krishna Prakashan Media. pp. 153–154. ISBN 978-81-8283-036-3.
- ^ Boyunaga, H.; Schmitz, M.G.J.; Brouwers, J.F.H.M.; Van Hellemond, J.J.; Tielens, A.G.M. (2002). "Fasciola hepatica miracidia are dependent on respiration and endogenous glycogen degradation for their energy generation". Parasitology. 122 (2): 169–73. doi:10.1017/S0031182001007211. PMID 11272647. S2CID 24663107.
- ^ a b c d e Puranik, P; Bhate, A (2007). Animal Forms And Functions: Invertebrata. New Delhi: Sarup & Sons. pp. 172–175. ISBN 978-81-7625-791-6.
- ^ Mandal, P; F.B. (2012). Invertebrate Zoology. Delhi: PHI Learning. ISBN 978-81-203-4615-4.
- ^ Hurtrez-Boussès, Sylvie; Meunier, Cécile; Durand, Patrick; Renaud, François (2001). "Dynamics of host–parasite interactions: the example of population biology of the liver fluke (Fasciola hepatica)". Microbes and Infection. 3 (10): 841–849. doi:10.1016/S1286-4579(01)01442-3. PMID 11580979.
- ^ a b c Cwiklinski, Krystyna; Dalton, John Pius; Dufresne, Philippe J; La Course, James; Williams, Diana JL; Hodgkinson, Jane; Paterson, Steve (2015). "The Fasciola hepatica genome: gene duplication and polymorphism reveals adaptation to the host environment and the capacity for rapid evolution". Genome Biology. 16 (1): 71. doi:10.1186/s13059-015-0632-2. PMC 4404566. PMID 25887684.
- ^ Young, Neil D.; Nagarajan, Niranjan; Lin, Suling Joyce; Korhonen, Pasi K.; Jex, Aaron R.; Hall, Ross S.; Safavi-Hemami, Helena; Kaewkong, Worasak; et al. (2014). "The Opisthorchis viverrini genome provides insights into life in the bile duct". Nature Communications. 5 (1): 4378. Bibcode:2014NatCo...5.4378Y. doi:10.1038/ncomms5378. PMC 4104445. PMID 25007141.
- ^ McNulty, Samantha N.; Tort, Jose F.; Rinaldi, Gabriel; Fischer, Kerstin; Rosa, Bruce A.; Smircich, Pablo; Fontenla, Santiago; Choi, Young-Jun; et al. (2017). "Genomes of Fasciola hepatica from the Americas Reveal Colonization with Neorickettsia Endobacteria Related to the Agents of Potomac Horse and Human Sennetsu Fevers". PLOS Genetics. 13 (1): e1006537. doi:10.1371/journal.pgen.1006537. PMC 5257007. PMID 28060841.
- ^ Le, T.H.; Blair, D.; McManus, D.P. (2003). "Complete DNA sequence and gene organization of the mitochondrial genome of the liverfluke, Fasciola hepatica L. (Platyhelminthes; Trematoda)". Parasitology. 123 (6): 609–21. doi:10.1017/S0031182001008733. PMID 11814048. S2CID 41357043.
- ^ a b Tolan, Robert W. (February 2011). "Fascioliasis Due to Fasciola hepatica and Fasciola gigantica Infection: An Update on This 'Neglected' Neglected Tropical Disease". Laboratory Medicine. 42 (2): 107–116. doi:10.1309/LMLFBB8PW4SA0YJI.
- ^ a b McManus, DP; Dalton, JP (2007). "Vaccines against the zoonotic trematodes Schistosoma japonicum, Fasciola hepatica and Fasciola gigantica". Parasitology. 133 (S2): S43–61. doi:10.1017/S0031182006001806. hdl:10453/15032. PMID 17274848. S2CID 8952857.
- ^ a b c Mas-Coma, S. (September 2005). "Epidemiology of fascioliasis in human endemic areas". Journal of Helminthology. 79 (3): 207–216. doi:10.1079/joh2005296. PMID 16153314. S2CID 20879979.
- ^ Halferty, L.; Brennan, G.P.; Hanna, R.E.B.; Edgar, H.W.; Meaney, M.M.; McConville, M.; Trudgett, A.; Hoey, L.; Fairweather, I. (August 2008). "Tegumental surface changes in juvenile Fasciola hepatica in response to treatment in vivo with triclabendazole". Veterinary Parasitology. 155 (1–2): 49–58. doi:10.1016/j.vetpar.2008.04.011. PMID 18511199.
- ^ "Archived copy". parasite.wormbase.org. Archived from the original on 22 March 2016. Retrieved 11 January 2022.
{{cite web}}: CS1 maint: 제목으로 아카이브된 복사(링크) - ^ a b c "Gorgas Case 5 - 2015 Series". The Gorgas Course in Clinical Tropical Medicine. University of Alabama. 2 March 2015. Retrieved 10 March 2015.
- ^ "Fascioliasis epidemiology". WHO. Archived from the original on March 13, 2014.
- ^ 피부 테스트영국 동식물위생국
- ^ Claridge, Jen; Diggle, Peter; McCann, Catherine M.; Mulcahy, Grace; Flynn, Rob; McNair, Jim; Strain, Sam; Welsh, Michael; Baylis, Matthew; Williams, Diana J.L. (January 2012). "Fasciola hepatica is associated with the failure to detect bovine tuberculosis in dairy cattle". Nature Communications. 3 (1): 853. Bibcode:2012NatCo...3..853C. doi:10.1038/ncomms1840. PMC 3989536. PMID 22617293.
- ^ a b "WHO Fascioliasis". www.who.int. Archived from the original on May 8, 2013. Retrieved 2016-04-30.
- ^ a b Scott, Phil. "Fascioliasis (liver fluke) in cattle" (PDF). NADIS Health Bulletin. Archived from the original (PDF) on 2016-05-31. Retrieved 2016-04-30.
- ^ Howell, Alison; Baylis, Matthew; Smith, Rob; Pinchbeck, Gina; Williams, Diana (2015). "Epidemiology and impact of Fasciola hepatica exposure in high-yielding dairy herds". Preventive Veterinary Medicine. 121 (1–2): 41–48. doi:10.1016/j.prevetmed.2015.05.013. PMC 4528078. PMID 26093971.
- ^ Virginia P. Studdert; Clive C. Gay; Douglas C. Blood (2011). Saunders Comprehensive Veterinary Dictionary. Elsevier Health Sciences.
- ^ Ruckebusch, Y.; Toutian, P.-L.; Koritz, G.D., eds. (2012). Veterinary Pharmacology and Toxicology. Springer Science & Business Media. p. 762. ISBN 978-94-009-6604-8.
- ^ Sibille, Pierre; Calléja, Cécile; Carreras, Florence; Bigot, Karine; Galtier, Pierre; Boulard, Chantal (2000). "Fasciola hepatica: Influence of Gender and Liver Biotransformations on Flukicide Treatment Efficacy of Rats Infested and Cured with Either Clorsulon/Ivermectin or Triclabendazole". Experimental Parasitology. 94 (4): 227–237. doi:10.1006/expr.2000.4501. PMID 10831390.
- ^ Ortega, YR (2006-11-22). Foodborne Parasites. Georgia, USA: Springer. p. 186. ISBN 978-0387-30068-9.
- ^ Valero, M. Adela; Perez-Crespo, Ignacio; Periago, M. Victoria; Khoubbane, Messaoud; Mas-Coma, Santiago (2009). "Fluke egg characteristics for the diagnosis of human and animal fascioliasis by Fasciola hepatica and F. gigantica". Acta Tropica. 111 (2): 150–159. doi:10.1016/j.actatropica.2009.04.005. PMID 19375410.
- ^ Mezo, Mercedes; González-Warleta, Marta; Carro, Carmen; Ubeira, Florencio M. (2004). "An Ultrasensitive Capture Elisa for Detection of Fasciola Hepatica Coproantigens in Sheep and Cattle Using a New Monoclonal Antibody (MM3)". Journal of Parasitology. 90 (4): 845–852. doi:10.1645/GE-192R. PMID 15357080. S2CID 31734209.
- ^ Cornelissen, Jan B.W.J.; Gaasenbeek, Cor P.H.; Borgsteede, Fred H.M; Holland, Wicher G; Harmsen, Michiel M; Boersma, Wim J.A (2001). "Early immunodiagnosis of fasciolosis in ruminants using recombinant Fasciola hepatica cathepsin L-like protease". International Journal for Parasitology. 31 (7): 728–737. doi:10.1016/S0020-7519(01)00175-8. PMID 11336755.
외부 링크
- 미시간 대학교 동물 다양성 웹
- 기생충 파시오라(parasite.org.au)
- Stanford University Fascioliasis Info 페이지 2009-03-10년 웨이백 머신에 보관
- 생명 백과사전
- 분류법 및 명명법은 ITIS.gov에서 확인할 수 있습니다.
- UniProt의 분자 데이터베이스
- Ballweber, Lora Rickard (2021-11-19). "Fasciola hepatica in Ruminants - Digestive System". Merck Veterinary Manual. Retrieved 2022-04-27.