골지 기구
Golgi apparatus| 세포생물학 | |
|---|---|
| 동물세포도 | |
 |
골기 콤플렉스, 골기 몸체, 혹은 간단히 골기로도 알려진 골기 기구(/ˈɡldldʒi/)는 대부분의 진핵 세포에서 발견되는 오르가넬이다.[1]세포질 내에 있는 엔도엠브레인 시스템의 일부로서, 그것은 단백질을 세포 안에 있는 막으로 묶인 음낭으로 포장한 다음, 음낭이 목적지로 보내진다.그것은 분비물, 라이소솜, 내포성 경로의 교차점에 있다.단백질이 기구를 통해 이동함에 따라 단백질에 다양한 당분모노머를 부착하는 글리코실화 효소 세트를 함유하고 있어 분비를 위한 단백질의 처리에 특히 중요하다.
1897년 이탈리아의 과학자 카밀로 골기에 의해 확인되었고 1898년 그의 이름을 따서 명명되었다.[2]
디스커버리
큰 크기와 독특한 구조로 인해 골지 기구는 자세히 발견되고 관찰된 최초의 오르간호 중 하나였다.1898년 이탈리아의 의사 카밀로 골기에 의해 신경계에 대한 조사 중에 발견되었다.[3][2]처음 그것을 현미경으로 관찰한 후, 그는 그 구조를 망상망막내부(internal reticolare interno)라고 명명했다.일부 사람들은 이 구조물의 외관이 골기가 사용한 관찰 기술에 의해 만들어진 착시현상에 불과하다고 주장하면서 처음에는 이 발견을 의심했다.20세기 현대현미경의 발달로 그 발견이 확정되었다.[4]초기 골기 기구에 대한 언급은 "골기-홀mgren 기구", "골기-홀mgren 도관", "골기-콥치 기구"[2] 등 다양한 명칭으로 언급되었다.'골기 기구'라는 용어는 1910년에 사용되어 1913년에 과학 문헌에 처음 등장하였고, '골기 복합체'는 1956년에 도입되었다.[2]
아세포 국산화
골기장치의 아세포 국산화술은 진핵생물마다 다르다.포유류에서, 단일 골지 기구는 보통 세포핵 근처에 위치하며, 중심핵에 가깝다.관형 연결은 스택을 서로 연결하는 역할을 한다.골지 기구의 국소화 및 관 연결은 마이크로 관에 의존한다.실험에서, 미세 관이 고갈됨에 따라 골기 유령은 상호 연결을 상실하고 세포질 전체에 걸쳐 개별 스택이 되는 것으로 보인다.[5]효모에서는 여러 개의 골기 유령이 세포질 전체에 흩어져 있다(사카로미스 세레비시아아에서 관찰된 바와 같이).식물에서는 골지 스택이 중심부에 집중되지 않고 골지 리본을 형성하지 않는다.[6]골지공장의 구성은 미세관이 아닌 액틴 케이블에 의존한다.[6]골기의 공통점은 내소성 망막(ER) 출구 부지에 인접해 있다는 점이다.[7]
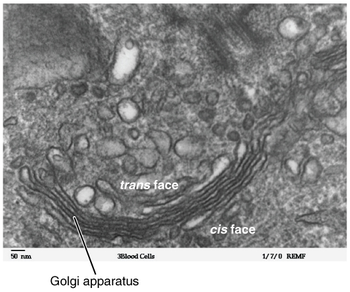
구조
대부분의 진핵생물에서, 골기 기구는 일련의 구획으로 구성되어 있으며, 내포성 망막에서 싹을 틔우는 배시관으로부터 유래된 시스테르네(시스테르나, "딕티요솜"이라고도 한다)라고 알려진 융합되고 평평해진 막-폐쇄 디스크의 모음이다.포유류 세포는 전형적으로 40에서 100개의 시스테르나를 포함한다.[8]보통 4~8개의 시스테르나가 한 무더기 안에 존재하지만, 일부 양성자에서는 무려 60개의 시스테르나가 관찰되었다.[4]이 시스래 모음은 시스, 메디알, 트랜스 컴파트먼트로 분해되어 시스 골지 네트워크(CGN)와 트랜스 골지 네트워크(TGN)의 두 가지 주요 네트워크를 이룬다.씨지엔은 최초의 시스테날 구조로 TGN은 최종으로, 단백질이 라이소솜이나 분비물인 베시클 또는 세포 표면으로 향하는 베시클에 포장된다.TGN은 보통 스택 가까이에 위치하지만 스택으로부터 분리될 수도 있다.TGN은 효모와 식물에서 초기 엔도솜 역할을 할 수 있다.[6][9]
진핵생물 중 골기 기구에는 구조적, 조직적 차이가 있다.일부 효모에서는 골지 쌓기가 관찰되지 않는다.피치아 목사는 골기를 쌓아올린 반면 사카로미스는 그렇지 않다.[6]식물에서는 골지 기구의 개별 스택이 독립적으로 작동하는 것처럼 보인다.[6]
골기 기구는 많은 양의 물질을 합성하고 분비하는 세포에서 더 크고 더 많은 경향이 있다. 예를 들어 면역 체계의 항체-소독 혈장 B 세포는 골기 콤플렉스가 두드러진다.
모든 eukaryotes에서, 각각의 cisternal 스택은 cis 진입면과 트랜스 출구면을 가지고 있다.이러한 얼굴들은 독특한 형태학과 생화학으로 특징지어진다.[10]개별 스택 내에는 선택적으로 단백질 화물을 수정하는 효소의 종류가 있다.이러한 변화는 단백질의 운명에 영향을 미친다.골지 기구의 구획화는 효소를 분리하는 데 유리하여 연속적이고 선택적인 처리 단계를 유지하는데, 이때 초기 수정을 촉매하는 효소가 시스 면 시스테르나에 모이고, 이후 수정을 촉매하는 효소는 골지 스택의 트랜스 면 시스테르나에서 발견된다.[5][10]
함수
골지 기구는 내소성 망막(ER)으로부터 받은 단백질 제품의 주요 수집·배출소다.ER에서 합성된 단백질은 베시클로 포장되어 골지 기구와 융합된다.이 화물 단백질들은 변형되어 세포외전증이나 세포 내 사용을 위해 분비되도록 운명 지어진다.이 점에서, 골기는 우체국과 유사하다고 생각할 수 있다: 그것은 우체국이 세포의 다른 부분이나 세포 밖의 공간에 보내는 물품들을 포장하고 라벨을 붙인다.골지 기구는 지질 운반과 리소솜 형성에도 관여한다.[11]
골지 기구의 구조와 기능은 밀접하게 연결되어 있다.각각의 스택은 효소의 다른 종류를 가지고 있어서, 그것들이 시스테르나에서 트랜스 골지 면으로 이동하면서 화물 단백질의 점진적인 처리를 가능하게 한다.[5][10]골지 스택 내의 효소 반응은 효소가 고정되어 있는 막 표면 근처에서만 발생한다.이 특징은 발광에 수용성 단백질과 효소가 있는 ER과는 대조적이다.효소 처리의 많은 부분은 단백질의 변환 후 수정이다.예를 들어, 리소솜 단백질에 대한 올리고당류의 인산염은 초기 CNG에서 발생한다.[5]시스 시스테나는 마노스의 잔여물 제거와 관련이 있다.[5][10]마노오스 잔류물 제거 및 N-acetylglucosamine 첨가는 내과에서 발생한다.[5]갈락토스와 시알산의 추가는 시스테르네에서 발생한다.[5]티로신과 탄수화물의 황화는 TGN 내에서 발생한다.[5]단백질의 다른 일반적인 변환 후 수정에는 탄수화물(글리코실화)[12]과 인산염(인산화)의 첨가도 포함된다.단백질 수정은 단백질의 최종 목적지를 결정하는 신호 시퀀스를 형성할 수 있다.예를 들어, 골지 기구는 리소솜으로 향하는 단백질에 마노오스-6-인산염 라벨을 추가한다.골기 기구의 또 다른 중요한 기능은 프로테오글리칸의 형성에 있다.골기의 효소는 글리코사미노글리칸에 단백질을 첨가하여 프로테오글리칸을 만든다.[13]글리코사미노글리칸은 동물의 세포외 기질 내에 존재하는 오래도록 다당류 분자다.
베수체 수송
거친 말단소성 망막을 빠져나온 염소는 골기장치의 시스 면으로 운반되어 골기막과 융합하여 내용물을 루멘으로 비운다.일단 루멘 안으로 들어가면, 분자들은 수정되고, 다음 목적지로 이동하기 위해 분류된다.
내소성 망막 또는 골기 기구가 아닌 세포의 영역으로 향하는 단백질은 골기 시스테르나를 통해 트랜스 면을 향해 이동하며, 복잡한 막망과 관련 골기 네트워크(TGN)로 알려져 있다.골기의 이 영역은 단백질이 운반하는 신호 순서에 따라 최소한 세 가지 다른 종류의 음소 중 하나에 배치되어 단백질을 분류하여 목적지로 운송하는 지점이다.
| 종류들 | 설명 | 예 |
|---|---|---|
| 외피성 소변기(원형) | Vesicle은 세포외 분비를 위한 단백질을 함유하고 있다.포장을 마친 후, 염낭이 싹을 틔우고 즉시 플라즈마 막 쪽으로 이동하며, 거기서 그들은 결합하여 세포외 공간으로 내용물을 방출한다. | 활성화된 혈장 B 세포에 의한 항체 방출 |
| 분비물 음소(조절) | Vesicles는 세포외에서 방출되는 단백질을 함유하고 있다.포장을 마친 후, 염전들은 싹이 트고 방출 신호가 올 때까지 세포에 저장된다.적절한 신호가 수신되면 그들은 멤브레인 쪽으로 이동하고 퓨즈를 통해 내용물을 방출한다.이 과정은 조절된 분비물이라고 알려져 있다. | 뉴런으로부터의 신경전달물질 방출 |
| 리소소소말 방파제 | Vesicles에는 리소솜으로 향하는 단백질과 리보솜, 많은 산성 하이드롤을 함유한 분해성 유기체, 또는 리소솜과 같은 저장 유기체들이 들어 있다.이 단백질들은 소화 효소와 막 단백질을 모두 포함한다.음낭은 먼저 후기 내시경과 퓨즈를 하고, 내용물은 알 수 없는 메커니즘을 통해 리소솜으로 전달된다. | 리소솜을 위한 소화제 |
Vesicular 운송 및 인신매매의 최신 모델
모델 1: 안정적 컴파트먼트 사이의 항원궤도 배관
- 이 모델에서 골기는 함께 작동하는 안정된 구획의 집합체로 간주된다.각 구획에는 단백질 화물을 개조하는 효소의 독특한 컬렉션이 있다.단백질은 ER에서 COPII 코팅된 베시클을 사용하여 시스 표면으로 전달된다.그리고 나서 카고는 COPI 코팅된 vesicle에서 트랜스 페이스 쪽으로 진행한다.이 모델은 COPI vesicle이 두 방향으로 움직이는 것을 제안한다: 앤터로그레이드 vesicle은 분비성 단백질을 운반하는 반면, 역행하는 vesicle은 골지 특유의 밀매 단백질을 재활용한다.[14]
- 이 모델은 1980년대 초반부터 1990년대 후반까지 널리 받아들여졌다.[14]
모델 2: 시스테날 진행/성형
- 이 모델에서는 ER로부터 COPII vesicle의 융합을 통해 골지 스택의 첫 번째 cis-cisterna가 형성되기 시작하며, 이후 진행되어 성숙한 TGN cisterna가 된다.일단 성숙되면, TGN 시스테르나는 용해되어 분비성 베시클이 된다.이러한 진행이 일어나는 동안 COPI vesicle은 나이가 많은 시스테르나에서 젊은 시스테르나로 전달하여 골지 특이 단백질을 지속적으로 재활용한다.다른 재활용 패턴이 골지 스택 전체에 걸쳐 생화학이 다르게 설명될 수 있다.따라서 골기 내부의 칸막이는 성숙된 골기 기구의 이산 운동 단계로 간주된다.[14]
모델 3: 이형관 운송을 통한 시스테날 진행/만성
- 이 모델은 시스테날 진행/만성 모델의 확장이다.그것은 골지 리본을 형성하는 시스테르네 사이에 관 모양의 연결부가 존재하며, 그 안에서 스택 내의 시스테르가 연결된다.이 모델은 관절이 ER-Golgi 시스템의 양방향 교통에 중요하다고 가정한다. 관은 소형 화물의 고속 무궤도 교통 및/또는 고유 골지 단백질의 역행 교통을 허용한다.[14][15]
- 장점:이 모델은 화물의 신속한 밀거래도 설명하는 시스테날 진행/만성 모델의 강점과 고유 골지 단백질이 COPI vesicle과 독립적으로 재활용할 수 있는 방법을 포괄한다.[14]
- 약점:이 모델은 콜라겐과 같은 큰 단백질 화물의 운송 운동학을 설명할 수 없다.또한 관형 연결은 식물 세포에서 널리 퍼지지 않는다.이러한 연결들이 가지고 있는 역할은 보편적 특성이 아닌 세포 고유의 전문화에 기인할 수 있다.만약 막이 연속적인 것이라면, 그것은 골기 기구 전체에서 관찰된 독특한 생화학적 그라데이션들을 보존하는 메커니즘의 존재를 암시한다.[14]
모델 4: 혼합 골지에서의 신속한 파티셔닝
- 이 급속 분할 모델은 전통적인 배관 밀매 관점을 가장 과감하게 바꾼 것이다.이 모델의 지지자들은 골기가 단백질 화물의 처리와 수출에서 별도로 기능하는 도메인을 포함하는 단일 단위로 작동한다고 가정한다.ER의 화물은 이 두 영역 사이를 이동하며, 임의로 골지의 모든 수준에서 최종 위치로 빠져나간다.이 모델은 화물이 기하급수적인 동력학에 의해 가장 잘 묘사된 패턴으로 골기에서 빠져나간다는 관찰에 의해 뒷받침된다.도메인의 존재는 형광 현미경 데이터에 의해 뒷받침된다.[14]
모델 5: 시스테날 모델 프로제너로서의 안정적인 컴파트먼트
- 이것이 가장 최근의 모델이다.이 모델에서 골기는 Rab(G-단백질)에 의해 정의된 안정적 컴파트먼트의 집합체로 보여진다.GTPases.[14]
- 장점:이 모형은 수많은 관측치와 일관되며 시스테날 진행/만성 모델의 강점을 포함한다.또한 포유류 내시경에서 Rab GTPase 역할에 대해 알려진 것은 골기 내에서의 투여 역할을 예측하는 데 도움을 줄 수 있다.이 모델은 '메가비클' 수송 매개체의 관측을 설명할 수 있다는 점에서 독특하다.[14]
- 약점:이 모델은 골지 기구의 형태학적 변화를 설명하지 않으며 COPI vesicle에 대한 역할을 정의하지도 않는다.이 모델은 개별 골지 스택이 관찰되는 식물, 조류, 곰팡이 등에 잘 적용되지 않는다(스택 간 도메인 이전은 어려울 것 같다).게다가, 메가비클은 골기내 전달체로 확립되어 있지 않다.[14]
골기 전체에 걸쳐 배관통행을 설명하려는 여러 모델이 있지만, 어떤 개별 모델도 골기 기구의 모든 관측치를 독립적으로 설명할 수는 없다.현재, eukaryotes에 걸친 많은 관찰을 수용하면서 과학자들 사이에서 cisternal 진행/만성 모델이 가장 많이 받아들여지고 있다.다른 모델들은 여전히 질문을 짜고 미래의 실험을 안내하는데 중요하다.대답할 수 없는 근본적인 질문으로는 COPI vesicle의 방향성과 단백질 화물 운송을 조절하는 Rab GTPases의 역할이 있다.[14]
브레펠딘 A
브레펠딘 A(Brefeldin A, BFA)는 골기함수를 시험하는 방법으로 분비 경로를 교란시키기 위해 실험적으로 사용되는 곰팡이 대사물이다.[16]BFA는 일부 ADP-리보실레이션 요인(ARF)의 활성화를 차단한다.[17]ARF는 내시경과 골기에 대한 COP의 결합을 통해 배시관 밀매를 규제하는 작은 GTPases이다.[17]BFA는 ARF의 GTP 바인딩을 중재하는 여러 구아닌 뉴클레오티드 교환 인자(GEF)의 기능을 억제한다.[17]따라서 BFA로 세포를 치료하면 분비 경로에 장애가 발생하여 골기 기구의 분해를 촉진하고 골기 단백질을 내소체와 ER에 분배한다.[16][17]
갤러리
마우스 셀에 리본으로 연결된 두 개의 골지 스택.영화에서 찍은거야.
참조
- ^ Pavelk M, Mironov AA (2008). "Golgi apparatus inheritance". The Golgi Apparatus: State of the art 110 years after Camillo Golgi's discovery. Berlin: Springer. p. 580. doi:10.1007/978-3-211-76310-0_34. ISBN 978-3-211-76310-0.
- ^ a b c d Fabene PF, Bentivoglio M (October 1998). "1898-1998: Camillo Golgi and "the Golgi": one hundred years of terminological clones". Brain Research Bulletin. 47 (3): 195–8. doi:10.1016/S0361-9230(98)00079-3. PMID 9865849.
- ^ Golgi C (1898). "Intorno alla struttura delle cellule nervose" (PDF). Bollettino della Società Medico-Chirurgica di Pavia. 13 (1): 316. Archived (PDF) from the original on 2018-04-07.
- ^ a b Davidson MW (2004-12-13). "The Golgi Apparatus". Molecular Expressions. Florida State University. Archived from the original on 2006-11-07. Retrieved 2010-09-20.
- ^ a b c d e f g h Alberts, Bruce; et al. (1994). Molecular Biology of the Cell. Garland Publishing. ISBN 978-0-8153-1619-0.
- ^ a b c d e Nakano A, Luini A (August 2010). "Passage through the Golgi". Current Opinion in Cell Biology. 22 (4): 471–8. doi:10.1016/j.ceb.2010.05.003. PMID 20605430.
- ^ Suda Y, Nakano A (April 2012). "The yeast Golgi apparatus". Traffic. 13 (4): 505–10. doi:10.1111/j.1600-0854.2011.01316.x. PMID 22132734.
- ^ Duran JM, Kinseth M, Bossard C, Rose DW, Polishchuk R, Wu CC, Yates J, Zimmerman T, Malhotra V (June 2008). "The role of GRASP55 in Golgi fragmentation and entry of cells into mitosis". Molecular Biology of the Cell. 19 (6): 2579–87. doi:10.1091/mbc.E07-10-0998. PMC 2397314. PMID 18385516.
- ^ Day, Kasey J.; Casler, Jason C.; Glick, Benjamin S. (2018). "Budding Yeast Has a Minimal Endomembrane System". Developmental Cell. 44 (1): 56–72.e4. doi:10.1016/j.devcel.2017.12.014. PMC 5765772. PMID 29316441.
- ^ a b c d Day KJ, Staehelin LA, Glick BS (September 2013). "A three-stage model of Golgi structure and function". Histochemistry and Cell Biology. 140 (3): 239–49. doi:10.1007/s00418-013-1128-3. PMC 3779436. PMID 23881164.
- ^ Campbell, Neil A (1996). Biology (4 ed.). Menlo Park, CA: Benjamin/Cummings. pp. 122, 123. ISBN 978-0-8053-1957-6.
- ^ William G. Flynne (2008). Biotechnology and Bioengineering. Nova Publishers. pp. 45–. ISBN 978-1-60456-067-1. Retrieved 13 November 2010.
- ^ Prydz K, Dalen KT (January 2000). "Synthesis and sorting of proteoglycans". Journal of Cell Science. 113. 113 Pt 2 (2): 193–205. doi:10.1242/jcs.113.2.193. PMID 10633071.
- ^ a b c d e f g h i j k l m n o p q Glick BS, Luini A (November 2011). "Models for Golgi traffic: a critical assessment". Cold Spring Harbor Perspectives in Biology. 3 (11): a005215. doi:10.1101/cshperspect.a005215. PMC 3220355. PMID 21875986.
- ^ Wei JH, Seemann J (November 2010). "Unraveling the Golgi ribbon". Traffic. 11 (11): 1391–400. doi:10.1111/j.1600-0854.2010.01114.x. PMC 4221251. PMID 21040294.
- ^ a b Marie M, Sannerud R, Avsnes Dale H, Saraste J (September 2008). "Take the 'A' train: on fast tracks to the cell surface". Cellular and Molecular Life Sciences. 65 (18): 2859–74. doi:10.1007/s00018-008-8355-0. PMC 7079782. PMID 18726174.
- ^ a b c d D'Souza-Schorey C, Chavrier P (May 2006). "ARF proteins: roles in membrane traffic and beyond". Nature Reviews. Molecular Cell Biology. 7 (5): 347–58. doi:10.1038/nrm1910. PMID 16633337. S2CID 19092867.
- ^ Papanikou E, Day KJ, Austin J, Glick BS (2015). "COPI selectively drives maturation of the early Golgi". eLife. 4. doi:10.7554/eLife.13232. PMC 4758959. PMID 26709839.
외부 링크
| 스콜리아는 골지 기구 (Q83181)에 대한 프로필을 가지고 있다. |
 위키미디어 커먼즈 골지 기구 관련 매체
위키미디어 커먼즈 골지 기구 관련 매체