필린
Pilin이 글은 수렴 진화에 대한 설명과 클래스 목록이 누락되어 있습니다.(2020년 12월) |
필린은 박테리아의 필러스 구조에서 발견되는 섬유성 단백질의 한 부류를 말한다.이러한 구조는 유전 물질의 교환 또는 세포 접착 메커니즘으로 사용될 수 있습니다.비록 모든 박테리아가 고환이나 기모충을 가지고 있는 것은 아니지만, 세균 병원균은 종종 기모충을 숙주 세포에 붙이기 위해 기모충을 사용한다.그램음성균은 필리가 더 흔하며, 개별 필린 분자는 비공유성 단백질-단백질 상호작용에 의해 연결되며, 그램양성균은 종종 중합된 LPXTG 필린을 [1]가지고 있다.
IV형 필린
| 타입 IV의 필린 | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 | |||||||||
| 식별자 | |||||||||
| 기호. | 삐리 | ||||||||
| 팜 | PF00114 | ||||||||
| 인터프로 | IPR001082 | ||||||||
| 프로 사이트 | PDOC00342 | ||||||||
| SCOP2 | 1 paj / SCOPe / SUPFAM | ||||||||
| OPM 슈퍼 패밀리 | 68 | ||||||||
| OPM단백질 | 2힐 | ||||||||
| |||||||||
타입 IV 필린 단백질은 매우 긴 N 말단 알파 나선을 특징으로 하는 α+β 단백질이다.이러한 필리의 조립은 개별 단량체의 N 말단 나선 사이의 상호작용에 의존합니다.필러스 구조는 중심 기공을 라이닝하는 섬유 중심에 있는 나선형 구조를 배열하는 반면, 역평행 베타 시트는 섬유 [2]외부를 차지합니다.
세균변형에서 ComP필린의 역할
유전자 변형은 수용세균세포가 인접한 세포에서 DNA를 채취해 상동재조합을 통해 수용세균의 게놈에 통합하는 과정이다.Neisseria meningitidis에서 DNA 변환은 기증자 DNA의 코드 영역에 9-10mer의 짧은 DNA 흡수 배열(DUS)의 존재를 필요로 한다.DUS의 특정 인식은 타입 IV필린인 ComP에 [3][4]의해 매개된다.수막구균 타입 IV 필리는 필라멘트 표면에 노출될 것으로 예상되는 전기양성 스트라이프를 통해 작은 필린 ComP를 통해 DNA를 결합합니다.ComP 는, 일부의 DUS 에 대해서, 뛰어난 바인딩 프리퍼런스를 표시합니다.뇌수막 유전체 내 DUS의 분포는 특정 유전자를 선호하며, 이는 유전체 유지와 [5][6]복구에 관여하는 유전자에 대한 편견이 있음을 시사한다.
샤페론우셔필린
컵 가문은 보호자와 적어도 안내원을 사용하는 것으로 알려져 있다.Ig폴드를 [7]나타냅니다.
Saf, N 터미널 확장
| Saf-Nte_pilin | |||||||||
|---|---|---|---|---|---|---|---|---|---|
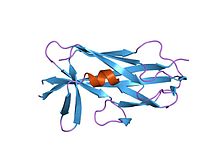 19-잔류 SafA Nte펩타이드와 복합체 내 살모넬라 장내 SafA 필린(f17a 돌연변이) | |||||||||
| 식별자 | |||||||||
| 기호. | Saf-Nte_pilin | ||||||||
| 팜 | PF09460 | ||||||||
| 인터프로 | IPR018569 | ||||||||
| |||||||||
Saf pilin N 말단 확장 단백질 도메인은 샤페론/유저 경로라고 하는 복잡한 메커니즘을 통해 필리가 형성되도록 도와줍니다.그것은 모든 [8]c-u pilins에서 발견된다.
이 단백질 도메인은 그러한 박테리아에게 매우 중요하다. 예를 들어, 필리가 형성되지 않으면 숙주를 감염시킬 수 없기 때문이다.Saf는 c-u pilus [8]시스템을 포함하는 살모넬라 오퍼론이다.
기능.
이 단백질 도메인은 필리를 형성하는데 중요한 기능을 한다.이것들은 숙주에 대한 세포 접착과 성공적인 [9]감염으로 생물막 형성에 중요한 독성 인자들이다.
구조.
이 단백질 도메인은 필러스 형성 복합체의 인접한 Saf-Nte 및 Saf-필린 체인으로 구성됩니다.샤페론/유셔(CU) 필리로, N 말단 확장(Nte)은 약 10~20개의 아미노산입니다.살모넬라 사프 필리는 FGl 샤페론에 의해 조립됩니다.서브유닛-서브유닛 [10]상호작용의 필수적인 부분을 구성하는 일련의 교대 소수성 잔류물을 포함하고 있기 때문에 구조는 잘 보존되어 있다.
메커니즘
조립 반응의 메커니즘은 기증자 가닥 교환 DSE라고 불리며, 그램 음성 박테리아에서 Philus 조립은 이 도메인의 C-와 N-말단 사이의 기증자 가닥 교환 메커니즘을 포함한다.C 말단 서브유닛은 불완전한 Ig-폴드를 형성하며, 그 후 다른 1개의 10-18 잔기 N 말단으로 보완된다.
N 말단 배열은 첫 번째 필러스 서브유닛의 [11]홈에서 P2에서 P5 결합 포켓을 차지하는 교대 소수성 잔기의 모티브를 포함한다.
LPXTG 필린
LPXTG 필린은 그램 양성 구균에 흔하다.Sortase에서 [1]사용되는 C-terminal 모티브에서 이름이 붙여졌습니다.LPXTGase도 있어요.
분자 도구의 개발
그램 양성세균의 LPXTG Pili는 자발적으로 형성된 이소펩티드 결합을 포함한다.이러한 결합은 필린 단백질에 향상된 기계적[12] 및 단백질[13] 분해 안정성을 제공합니다.최근, 스트렙토코커스 [14]피오제네스의 필린 단백질은 이소펩타그라고 불리는 새로운 분자 도구를 개발하기 위해 두 조각으로 나뉘었다.이소펩타그는 관심 단백질에 결합할 수 있는 짧은 펩타이드이며 자발적으로 형성된 이소펩타이드 결합을 통해 결합 파트너를 결합할 수 있습니다.이 새로운 펩타이드 태그는 과학자들이 영구적인 공유 결합을 통해 그들의 관심 단백질을 목표로 삼고 분리할 수 있게 해줍니다.
「 」를 참조해 주세요.
레퍼런스
- ^ a b Telford JL, Barocchi MA, Margarit I, Rappuoli R, Grandi G (2006). "Pili in gram-positive pathogens". Nat. Rev. Microbiol. 4 (7): 509–19. doi:10.1038/nrmicro1443. PMID 16778837. S2CID 6369483.
- ^ Forest KT, Tainer JA (1997). "Type-4 pilus-structure: outside to inside and top to bottom--a minireview". Gene. 192 (1): 165–9. doi:10.1016/s0378-1119(97)00008-5. PMID 9224887.
- ^ Berry JL, Cehovin A, McDowell MA, Lea SM, Pelicic V (2013). "Functional analysis of the interdependence between DNA uptake sequence and its cognate ComP receptor during natural transformation in Neisseria species". PLOS Genet. 9 (12): e1004014. doi:10.1371/journal.pgen.1004014. PMC 3868556. PMID 24385921.
- ^ Cehovin A, Simpson PJ, McDowell MA, Brown DR, Noschese R, Pallett M, Brady J, Baldwin GS, Lea SM, Matthews SJ, Pelicic V (2013). "Specific DNA recognition mediated by a type IV pilin". Proc. Natl. Acad. Sci. U.S.A. 110 (8): 3065–70. Bibcode:2013PNAS..110.3065C. doi:10.1073/pnas.1218832110. PMC 3581936. PMID 23386723.
- ^ Davidsen T, Rødland EA, Lagesen K, Seeberg E, Rognes T, Tønjum T (2004). "Biased distribution of DNA uptake sequences towards genome maintenance genes". Nucleic Acids Res. 32 (3): 1050–8. doi:10.1093/nar/gkh255. PMC 373393. PMID 14960717.
- ^ Caugant DA, Maiden MC (2009). "Meningococcal carriage and disease--population biology and evolution". Vaccine. 27 Suppl 2: B64–70. doi:10.1016/j.vaccine.2009.04.061. PMC 2719693. PMID 19464092.
- ^ Verger D, et al. (2007). "Crystal structure of the P-pilus rob subunit PapA". PLOS ONE. 3 (5): e73. doi:10.1371/journal.ppat.0030073. PMC 1868955. PMID 17511517.
- ^ a b Waksman, G; Hultgren, SJ (November 2009). "Structural biology of the chaperone-usher pathway of pilus biogenesis". Nature Reviews. Microbiology. 7 (11): 765–74. doi:10.1038/nrmicro2220. PMC 3790644. PMID 19820722.
- ^ Salih O, Remaut H, Waksman G, Orlova EV (May 2008). "Structural analysis of the Saf pilus by electron microscopy and image processing". Journal of Molecular Biology. 379 (1): 174–87. doi:10.1016/j.jmb.2008.03.056. PMID 18448124.
- ^ Waksman G, Hultgren SJ (November 2009). "Structural biology of the chaperone-usher pathway of pilus biogenesis". Nature Reviews. Microbiology. 7 (11): 765–74. doi:10.1038/nrmicro2220. PMC 3790644. PMID 19820722.
- ^ Remaut H, Rose RJ, Hannan TJ, Hultgren SJ, Radford SE, Ashcroft AE, Waksman G (June 2006). "Donor-strand exchange in chaperone-assisted pilus assembly proceeds through a concerted beta strand displacement mechanism". Molecular Cell. 22 (6): 831–42. doi:10.1016/j.molcel.2006.05.033. PMID 16793551.
- ^ Alegre-Cebollada J, Badilla CL, Fernández JM (2010). "Isopeptide bonds block the mechanical extension of pili in pathogenic Streptococcus pyogenes". J. Biol. Chem. 285 (15): 11235–11242. doi:10.1074/jbc.M110.102962. PMC 2857001. PMID 20139067.
- ^ Kang HJ, Coulibaly F, Clow F, Proft T, Baker EN (2007). "Stabilizing isopeptide bonds revealed in gram-positive bacterial pilus structure". Science. 318 (5856): 1625–1628. Bibcode:2007Sci...318.1625K. doi:10.1126/science.1145806. PMID 18063798. S2CID 5627277.
- ^ Zakeri B, Howarth M (2010). "Spontaneous intermolecular amide bond formation between side chains for irreversible peptide targeting". J. Am. Chem. Soc. 132 (13): 4526–7. CiteSeerX 10.1.1.706.4839. doi:10.1021/ja910795a. PMID 20235501.
추가 정보
- Khare, Baldeep; V. L. Narayana, Sthanam (August 2017). "Pilus biogenesis of Gram-positive bacteria: Roles of sortases and implications for assembly: Sortases and Implications for Assembly". Protein Science. 26 (8): 1458–1473. doi:10.1002/pro.3191. PMC 5521585. PMID 28493331.


