본질적으로 감광성 망막강변세포
Intrinsically photosensitive retinal ganglion cell본질적으로 감광성이 강한 망막강변세포(ipRGC)는 광감응성 망막강변세포(pRGC)라고도 하며, 또는 멜라노신 함유 망막강변세포(mRGC)라고도 불리는 포유류 눈의 망막에 있는 뉴런의 일종이다.ipRGCs의 존재는 1927년 로드리스, 커넥티드 생쥐가 동공 수축에 의한 빛 자극에 여전히 반응하면서 처음 의심되었는데,[1] 이는 로드와 콘이 망막의 빛에 민감한 유일한 뉴런이 아님을 시사한다.[2]이러한 세포에 대한 연구의 진보가 시작된 것은 1980년대부터이다.최근 연구 결과 이들 망막강변세포는 다른 망막강변세포와 달리 빛에 민감한 단백질인 멜라노핀이 있어 본질적으로 감광성이 높은 것으로 나타났다.그러므로 그것들은 막대 세포와 원뿔 세포 외에 제3종류의 광수용체를 구성한다.[3]
개요
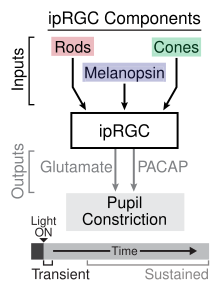
로드와 콘에 비해 ipRGC는 더 느리게 반응하며 장기적으로 빛의 존재를 신호한다.[5]그것들은 망막강변세포의 매우 작은 부분집합(~1%)을 나타낸다.[6]그들의 기능적 역할은 비이미지 형성이며 패턴 비전의 그것과는 근본적으로 다르다. 그들은 주변 광도를 안정적으로 표현한다.최소 세 가지 주요 기능을 가지고 있다.
- 그들은 주로 낮의 길이와 야간 길이의 정보를 제공하면서 24시간 빛/어두운 주기에 순환 리듬을 동기화하는 데 큰 역할을 한다.그들은 직접 레티노히포탈라믹관(RHT)을 통해 시상하부의 초경련핵인 뇌의 순환심박동조율기로 빛 정보를 보낸다.이러한 갱년기 세포의 생리학적 특성은 순환 리듬을 조절하는 일일 빛 엔트로닉(동기화) 메커니즘의 알려진 특성과 일치한다.또한 ipRGC는 SCN-공감신경회로를 통해 모낭 재생과 같은 말초조직에도 영향을 미칠 수 있다.[7]
- 감광성 뇌세포는 번데기 조절의 중심인 중뇌의 온열 전핵과 같은 다른 뇌 표적을 내측으로 만든다.그것들은 동공 크기 조절과 주변 조명 조건에 대한 다른 행동 반응에 기여한다.[8]
- 그것들은 멜라토닌 호르몬 방출의 광자 조절과 급성 광자 억제에 기여한다.[8]
- 쥐에서, 그들은 규칙적인 만족, 빛의 수준, 공간 정보에 대한 인식을 포함하여 의식적인 시각적 지각에 어느 정도 역할을 한다.[8]
광자기성 괴선세포는 인간에게 격리되어 있는데, 여기서 그들은 순환 리듬을 조절하는 것 외에도 로드와 콘 광수용체의 장애로 고통 받는 무봉, 무원상 피험자의 광인식을 어느 정도 중재하는 것으로 나타났다.[9]Farhan H. Zaidi와 동료들의 연구는 사진 지각 갱단 세포가 인간에게 어떤 시각적 기능을 가지고 있을지도 모른다는 것을 보여주었다.
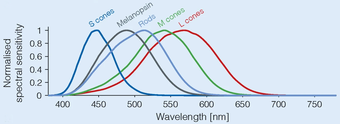
광촉성 갱리온 세포인 멜라노핀의 광전자화는 주로 가시 스펙트럼의 푸른 부분(흡수 정점 ~ 480나노미터[10])에서 빛에 의해 흥분된다.이러한 세포의 광전도 메커니즘은 완전히 이해되지는 않지만, 무척추동물 횡문근 광수용체에서 그것과 유사할 것 같다.빛에 직접 반응하는 것 외에도, 이 세포들은 망막의 시냅스 연결을 통해 로드와 콘으로부터 흥분과 억제 영향을 받을 수 있다.
이러한 뇌 내측성 부위의 축축은 상위의 대적핵과 등측측 유전핵을 포함하여 물체 인식과 관련된 것이다.[8]
구조
ipRGC 수용체
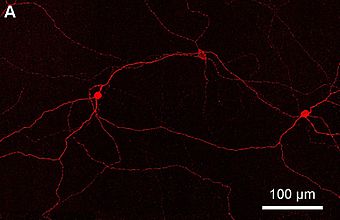
이 광수용체 세포들은 망막과 뇌 둘 다로 투영된다.그것들은 세포막을 따라 광섬유 멜라노핀을 다양한 양으로 함유하고 있는데, 여기에는 광섬유 디스크, 소마, 세포의 덴드라이트까지의 액손까지 포함된다.[3] ipRGCs는 신경전달물질 글루타민, 글리신, GABA를 위한 막 수용체가 포함되어 있다.[11]광감응성 갱도세포는 탈극화하여 빛에 반응하므로 신경충동을 발사하는 속도가 증가하는데, 이는 빛에 반응하여 과극화하는 다른 광수용체 세포와는 정반대인 것이다.[12]
마우스를 대상으로 한 연구 결과는 ipRGC의 축이 비금속 상태임을 시사한다.[3]
멜라놉신
멜라노핀은 다른 광수용체 색소와 달리 흥분성 광소화효소와 광소화효소 역할을 모두 수행할 수 있는 능력을 갖고 있다.이 변환을 위해 뮐러 세포와 망막색소 상피 세포에 의존하는 광수용체 원추와 같은 또 다른 광전도를 겪을 수 있기 전에 두 개의 등소 형태 사이에서 추가 세포가 되돌아가도록 요구하는 대신에 멜라노핀은 모든 전이성 세포들을 11-cis-r-r로 이질화시킬 수 있다.추가 세포의 도움 없이 빛으로 자극을 받았을 때 식각.[11]멜라노핀의 두 이소 형태는 스펙트럼 감도가 서로 다르며, 11-cis-망막 이소 형태는 빛의 짧은 파장에 더 잘 반응하는 반면, 올트랜스 이소 형태는 더 긴 빛의 파장에 더 잘 반응하기 때문이다.[13]
시냅스 입력 및 출력
입력
ipRGC는 상호 시냅스를 통해 도파민성 아마크린 세포(DA세포)에 대한 시냅스 전, 후 시냅스로서 ipRGC는 DA세포에 흥분성 신호를 보내고, DA세포는 iPRGC에 억제 신호를 보낸다.이러한 억제 신호는 도파민과 함께 DA 세포에서 공동 분비되는 GABA를 통해 매개된다.도파민은 ipRGC에서 멜라노신 전사를 상향 조절해 광수용체의 민감도를 높여 광 적응 과정에서 기능을 한다.[3]DA 아마크린 세포 억제와 병행하여, 소마토스타틴 방출 아마크린 세포 자체가 DA 아마크린 세포에 의해 억제되어 ipRGC를 억제한다.[14]ipRGC 덴드라이트에 대한 다른 시냅스 입력에는 원추 양극세포와 로드 양극세포가 포함된다.[11]
출력
ipRGCs의 시냅스 후 대상 중 하나는 시상하부의 초경화핵(SCN)으로, 유기체에서 순환시계 역할을 한다.ipRGCs는 뇌하수체 아데닐리엘 사이클라제 활성화 단백질(PACAP)과 글루탐산염을 레티노하이포탈라믹 트랙(RHT)이라는 단합성 연결을 통해 SCN에 방출한다.[15]글루탐산염은 SCN 뉴런에 대한 흥분효과를 가지고 있으며, PACAP는 시상하부에서 글루탐산염의 영향을 강화하는 것으로 보인다.[16]
ipRGCs의 다른 시냅스 후 대상에는 시냅스(post synaptic targetic)에 위치한 신경 세포군인 IGL(tergenticulate pleft)과 뇌 중간의 신경 세포군인 OPN(operary pretectal nucle)이 있다.오탈라무스는 잠의 통제 센터다.[3] 편도선뿐만[clarify] 아니라.
함수
번데기 광 반사
다양한 광수용체 녹아웃 생쥐를 사용하여 연구원들은 번데기 광 반사(PLR)의 과도 신호와 지속 신호 모두에서 ipRGC의 역할을 확인했다.[17]과도 PLR은 희미한 빛에서 중간 정도의 광강도에서 발생하며, 로드 셀에서 발생하는 광전도의 결과로, IPRGC에 시냅스 입력을 제공하며, 이는 다시 중간뇌의 올리브 전구 핵에 정보를 전달한다.[18]과도 PLR에서 ipRGC로부터 중간뇌로의 정보 전달에 관여하는 신경전달물질은 글루탐산염이다.밝은 빛의 강도에서는 지속적인 PLR이 발생하는데, 여기에는 ipRGC에 입력을 제공하는 로드의 광전도와 멜라노핀을 통한 ipRGC 자체의 광전도가 모두 포함된다.연구자들은 지속적인 PLR에서 멜라노핀의 역할은 적응을 나타내는 로드셀과 대조적으로 가벼운 자극에 적응하지 못하기 때문이라고 제안했다.지속 PLR은 맥동 방식으로 ipRGC에서 PACAP 해제하여 유지된다.[17]
의식적 시각에서 가능한 역할
무봉, 무결핵 인간에 대한 실험은 수용체가 연구될 수 있는 또 다른 역할을 허용했다.2007년에, 사진 지각성 갱년세포에 대한 새로운 역할이 발견되었다.자이디와 동료들은 인간의 망막 갱년기 세포 광수용체가 의식적인 시력뿐만 아니라 순환기 리듬, 행동, 번데기 반응과 같은 비영상 형성 기능에도 기여한다는 것을 보여주었다.[9]이러한 세포들은 대부분 푸른 빛에 반응하기 때문에 중시적 시력에[citation needed] 대한 역할을 가지고 있으며, 막대(어두운)와 원뿔(빛) 광시력을 가진 순이중적 망막의 옛 이론은 단순화되었다는 주장이 제기되어 왔다.Zaidi와 동료들이 무봉, 사기 없는 인간 주제에 대한 연구로 갱년기 세포 광수용체를 위한 이미지 형성(시각적) 역할에도 문을 열었다.
시력에 대한 병렬 경로가 있다는 것을 발견했다. 하나는 외측 망막에서 발생하는 고전적인 막대 기반과 원뿔 기반이고, 다른 하나는 내측 망막에서 발생하는 기본적인 시각 밝기 검출기였다.후자는 전자에 앞서 빛에 의해 활성화되는 것 같다.[9]고전적인 광수용체 또한 새로운 광수용체 시스템에 공급되며, 색 항상성은 포스터가[citation needed] 제안한 중요한 역할일 수 있다.
쥐가 없고 결점이 없는 인간 모델의 저자들에 의해 수용기가 갱년세포에 영향을 미치는 병인 녹내장과 같은 전 세계적으로 실명의 주요 원인들을 포함한 많은 질병을 이해하는 데 도움이 될 수 있다고 제안되어 왔다.
다른 포유류에서, 감수성이 예민한 갱년기는 의식적인 시각에서 진정한 역할을 한다는 것이 증명되었다.제니퍼 에커 외 연구진이 실시한 실험에서 막대기와 원뿔이 부족한 쥐들은 똑같이 휘황찬란한 회색 스크린이 아닌 수직 막대들의 배열로 헤엄치는 법을 배울 수 있었다.[8]
보랏빛에서 푸른빛으로
대부분의 연구는 수용기의 피크 스펙트럼 감도가 460~484nm임을 시사한다.2003년[19] Lockley 외 연구진은 460nm(파란색)의 빛 파장으로 멜라토닌을 억제하는 것이 광학 시각 시스템의 피크 민감도인 555nm(녹색) 빛보다 두 배나 많았다.자이다이, 락클리, 그리고 공저자들이 매가 없고 원추 없는 인간을 이용한 연구에서, 매우 강렬한 481nm의 자극이 어떤 의식적인 빛 지각으로 이어져, 어떤 초보적인 시력이 실현되었다는 것을 의미하는 것으로 밝혀졌다.[9]
디스커버리
1923년 클라이드 E. 킬러는 우연히 길러낸 맹인 생쥐의 눈에 비친 눈동자가 여전히 빛에 반응하는 것을 관찰했다.[2]막대 없는, 원추 없는 생쥐가 번데기 빛 반사체를 유지하는 능력은 추가적인 광수용체 세포를 연상시켰다.[11]
1980년대, 막대기와 원추 결핍 쥐에 대한 연구는 빛 적응과 광증강제에 대한 신경 조절기로 알려진 망막의 도파민 조절을 보여주었다.[3]
러셀 G.가 1991년에 연구가 계속되었다. 이그나시오 프로벤치오를 포함한 포스터와 동료들은 로드와 콘-노크아웃 생쥐를 통해 원형선으로부터 멜라토닌 분비를 조절하거나, 주기율 리듬의 시각적 추진력인 광증강제에 로드와 콘-노크아웃 생쥐를 통해 로드와 콘이 필요치 않다는 것을 보여주었다.[20][11]프로벤치오와 동료들의 후기 연구는 이 광자폰스가 망막의 갱년 세포 층에 존재하는 광전자 멜라노핀에 의해 매개되었다는 것을 보여주었다.[21]
이 광수용체는 2002년 Samer Hattar, David Berson 및 동료들에 의해 확인되었는데, 여기서 그들은 본질적인 빛 반응을 가지고 있고 비영상 형성과 관련된 많은 뇌 영역에 투영된 갱리온 세포를 발현하는 멜라노핀인 것으로 밝혀졌다.[22][23]
2005년 팬더, 멜얀, 추, 그리고 동료들은 멜라노핀 광전자전이 갱리온 세포의 광전도성 색소라는 것을 증명했다.[24][25]데니스 데이시와 동료들은 구세계원숭이의 한 종에서 멜라노신을 발현하는 거대한 갱년세포가 측면 유전핵(LGN)에 투영된 것을 보여주었다.[26][6] 이전에는 중뇌(전뇌핵)와 시상하부(상뇌핵, SCN)에 투영된 것만이 보였다.그러나 수용체에 대한 시각적 역할은 여전히 의심받지 않고 증명되지 않았다.
리서치
인간에 관한 연구
인간에게 수용체를 사냥하려는 시도가 있었지만 인간은 특별한 도전을 제기하며 새로운 모델을 요구했다.다른 동물들과는 달리, 연구자들은 유전학적으로나 갱년기 세포를 직접 연구하기 위해 화학 물질로 막대기와 원뿔의 손실을 윤리적으로 유도할 수 없었다.여러 해 동안 인간의 수용체에 대한 추론만 도출할 수 있었지만, 이것들은 때로는 관련성이 있었다.
2007년에 자이디와 동료들은 무봉, 사기 없는 인간에 대한 그들의 연구를 발표했는데, 이 사람들이 빛의 비시각적 효과에 대한 정상적인 반응을 유지하고 있다는 것을 보여주었다.[9][27]인간에게 있는 비로드, 비콘 광수용체의 정체는 일부 다른 포유류에서 볼 수 있듯이 내측 망막의 괴선세포인 것으로 밝혀졌다.이 작업은 고전적인 막대기와 원뿔형 광수용체 기능을 없앴지만 갱년기 세포 기능을 보존한 희귀질환 환자를 이용해 이뤄졌다.[9][27]막대나 원뿔이 없음에도 불구하고 환자들은 멜라노신 광분해와 일치하는 환경적 및 실험적 빛에 피크 스펙트럼 민감성을 보이며, 원형 광전자 증배, 원형 행동 패턴, 멜라토닌 억제, 동공 반응을 계속 보였다.그들의 뇌는 또한 시각과 이 주파수의 빛을 연관시킬 수 있다.임상의와 과학자들은 이제 인간의 질병과 실명에 대한 새로운 수용기의 역할을 이해하려고 하고 있다.[28][self-published source?]본질적으로 감광성 RGC는 편두통 발작 시 빛에 의한 두통의 악화에도 관련되어 있다.[29]
참고 항목
참조
- ^ Keeler, Clyde E. (1927). "Iris movements in blind mice". American Journal of Physiology. 81 (1): 107–112. doi:10.1152/ajplegacy.1927.81.1.107.
- ^ a b Keeler CE (October 1928). "Blind Mice". Journal of Experimental Zoology. 51 (4): 495–508. doi:10.1002/jez.1400510404.
- ^ a b c d e f Do MT, Yau KW (October 2010). "Intrinsically photosensitive retinal ganglion cells". Physiological Reviews. 90 (4): 1547–81. doi:10.1152/physrev.00013.2010. PMC 4374737. PMID 20959623.
- ^ Blume C, Garbazza C, Spitschan M (2019). "Effects of light on human circadian rhythms, sleep and mood". Somnologie (Berl). 23 (3): 147–156. doi:10.1007/s11818-019-00215-x. PMC 6751071. PMID 31534436.
- ^ Wong KY, Dunn FA, Berson DM (December 2005). "Photoreceptor adaptation in intrinsically photosensitive retinal ganglion cells". Neuron. 48 (6): 1001–10. doi:10.1016/j.neuron.2005.11.016. PMID 16364903.
- ^ a b Berson DM (June 2003). "Strange vision: ganglion cells as circadian photoreceptors". Trends in Neurosciences. 26 (6): 314–20. doi:10.1016/S0166-2236(03)00130-9. PMID 12798601. S2CID 15149809.
- ^ Fan SM, Chang YT, Chen CL, Wang WH, Pan MK, Chen WP, et al. (July 2018). "External light activates hair follicle stem cells through eyes via an ipRGC-SCN-sympathetic neural pathway". Proceedings of the National Academy of Sciences of the United States of America. 115 (29): E6880–E6889. doi:10.1073/pnas.1719548115. PMC 6055137. PMID 29959210.
- ^ a b c d e Ecker JL, Dumitrescu ON, Wong KY, Alam NM, Chen SK, LeGates T, et al. (July 2010). "Melanopsin-expressing retinal ganglion-cell photoreceptors: cellular diversity and role in pattern vision". Neuron. 67 (1): 49–60. doi:10.1016/j.neuron.2010.05.023. PMC 2904318. PMID 20624591.
- ^ a b c d e f Zaidi FH, Hull JT, Peirson SN, Wulff K, Aeschbach D, Gooley JJ, et al. (December 2007). "Short-wavelength light sensitivity of circadian, pupillary, and visual awareness in humans lacking an outer retina". Current Biology. 17 (24): 2122–8. doi:10.1016/j.cub.2007.11.034. PMC 2151130. PMID 18082405.
- "Blind humans lacking rods and cones retain normal responses to nonvisual effects of light". EurekAlert! (Press release). December 13, 2007.
- ^ Berson DM (August 2007). "Phototransduction in ganglion-cell photoreceptors". Pflügers Archiv. 454 (5): 849–55. doi:10.1007/s00424-007-0242-2. PMID 17351786.
- ^ a b c d e Kolb H, Fernandez E, Nelson R (1995-01-01). Kolb H, Fernandez E, Nelson R (eds.). Webvision: The Organization of the Retina and Visual System. University of Utah Health Sciences Center. PMID 21413389.
- ^ Do MT, Kang SH, Xue T, Zhong H, Liao HW, Bergles DE, Yau KW (January 2009). "Photon capture and signalling by melanopsin retinal ganglion cells". Nature. 457 (7227): 281–7. Bibcode:2009Natur.457..281D. doi:10.1038/nature07682. PMC 2794210. PMID 19118382.
- ^ Chellappa SL, Ly JQ, Meyer C, Balteau E, Degueldre C, Luxen A, et al. (April 2014). "Photic memory for executive brain responses". Proceedings of the National Academy of Sciences of the United States of America. 111 (16): 6087–91. Bibcode:2014PNAS..111.6087C. doi:10.1073/pnas.1320005111. PMC 4000819. PMID 24616488.
- ^ Vuong HE, Hardi CN, Barnes S, Brecha NC (December 2015). "Parallel Inhibition of Dopamine Amacrine Cells and Intrinsically Photosensitive Retinal Ganglion Cells in a Non-Image-Forming Visual Circuit of the Mouse Retina". The Journal of Neuroscience. 35 (48): 15955–70. doi:10.1523/jneurosci.3382-15.2015. PMC 4666919. PMID 26631476.
- ^ Colwell CS, Michel S, Itri J, Rodriguez W, Tam J, Lelièvre V, et al. (November 2004). "Selective deficits in the circadian light response in mice lacking PACAP". American Journal of Physiology. Regulatory, Integrative and Comparative Physiology. 287 (5): R1194-201. doi:10.1152/ajpregu.00268.2004. PMID 15217792.
- ^ Butcher GQ, Lee B, Cheng HY, Obrietan K (June 2005). "Light stimulates MSK1 activation in the suprachiasmatic nucleus via a PACAP-ERK/MAP kinase-dependent mechanism". The Journal of Neuroscience. 25 (22): 5305–13. doi:10.1523/jneurosci.4361-04.2005. PMC 6724997. PMID 15930378.
- ^ a b Keenan WT, Rupp AC, Ross RA, Somasundaram P, Hiriyanna S, Wu Z, et al. (September 2016). "A visual circuit uses complementary mechanisms to support transient and sustained pupil constriction". eLife. 5. doi:10.7554/eLife.15392. PMC 5079752. PMID 27669145.
- ^ Gamlin PD, McDougal DH, Pokorny J, Smith VC, Yau KW, Dacey DM (March 2007). "Human and macaque pupil responses driven by melanopsin-containing retinal ganglion cells". Vision Research. 47 (7): 946–54. doi:10.1016/j.visres.2006.12.015. PMC 1945238. PMID 17320141.
- ^ Lockley SW, Brainard GC, Czeisler CA (September 2003). "High sensitivity of the human circadian melatonin rhythm to resetting by short wavelength light". The Journal of Clinical Endocrinology and Metabolism. 88 (9): 4502–5. doi:10.1210/jc.2003-030570. PMID 12970330.
- ^ Foster RG, Provencio I, Hudson D, Fiske S, De Grip W, Menaker M (July 1991). "Circadian photoreception in the retinally degenerate mouse (rd/rd)". Journal of Comparative Physiology A: Sensory, Neural, and Behavioral Physiology. 169 (1): 39–50. doi:10.1007/BF00198171. PMID 1941717. S2CID 1124159.
- ^ Provencio I, Rodriguez IR, Jiang G, Hayes WP, Moreira EF, Rollag MD (January 2000). "A novel human opsin in the inner retina". The Journal of Neuroscience. 20 (2): 600–5. doi:10.1523/jneurosci.20-02-00600.2000. PMC 6772411. PMID 10632589.
- ^ Berson DM, Dunn FA, Takao M (February 2002). "Phototransduction by retinal ganglion cells that set the circadian clock". Science. 295 (5557): 1070–3. Bibcode:2002Sci...295.1070B. doi:10.1126/science.1067262. PMID 11834835. S2CID 30745140.
- ^ Hattar S, Liao HW, Takao M, Berson DM, Yau KW (February 2002). "Melanopsin-containing retinal ganglion cells: architecture, projections, and intrinsic photosensitivity". Science. 295 (5557): 1065–70. Bibcode:2002Sci...295.1065H. doi:10.1126/science.1069609. PMC 2885915. PMID 11834834.
- ^ Panda S, Nayak SK, Campo B, Walker JR, Hogenesch JB, Jegla T (January 2005). "Illumination of the melanopsin signaling pathway". Science. 307 (5709): 600–4. Bibcode:2005Sci...307..600P. doi:10.1126/science.1105121. PMID 15681390. S2CID 22713904.
- ^ Qiu X, Kumbalasiri T, Carlson SM, Wong KY, Krishna V, Provencio I, Berson DM (February 2005). "Induction of photosensitivity by heterologous expression of melanopsin". Nature. 433 (7027): 745–9. Bibcode:2005Natur.433..745Q. doi:10.1038/nature03345. PMID 15674243. S2CID 24999816.
- ^ Dacey DM, Liao HW, Peterson BB, Robinson FR, Smith VC, Pokorny J, et al. (February 2005). "Melanopsin-expressing ganglion cells in primate retina signal colour and irradiance and project to the LGN". Nature. 433 (7027): 749–54. Bibcode:2005Natur.433..749D. doi:10.1038/nature03387. PMID 15716953. S2CID 4401722.
- ^ a b Coghlan A (2007). "How blind people see sunrise and sunset". New Scientist. 196 (2635–2636): 9. doi:10.1016/S0262-4079(07)63172-8.
- ^ Schor J (2008-04-19). "Blue Light and Melatonin" (web page). Morning Light. Retrieved 2008-05-30.
- ^ Noseda R (2010). "A neural mechanism for exacerbation of headache by light". Nature Neuroscience. 13 (2): 239–245. doi:10.1038/nn.2475. PMC 2818758. PMID 20062053.
외부 링크
- 멜라노신 추출, 본질적으로 감광성 망막 강글리온 세포, 웹비전, 미국 유타 대학교
- ipRGCs Brown University, Rhode Island, 미국 로드 아일랜드