브롬화 철(II)
Iron(II) bromide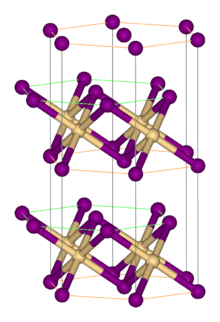 | |
| 이름 | |
|---|---|
| IUPAC 이름 브롬화 철(II) | |
| 기타 이름 제철브로마이드 | |
| 식별자 | |
3D 모델(JSmol) | |
| 켐스파이더 | |
| ECHA InfoCard | 100.029.244 |
펍켐 CID | |
| 유니 | |
CompTox 대시보드 (EPA) | |
| |
| |
| 특성. | |
| 페브르2 | |
| 어금질량 | 215.65 g mol−1 |
| 외관 | 황갈색의 고체 |
| 밀도 | 4.63 g cm−3, 솔리드 |
| 녹는점 | 684°C(1,263°F, 957K) (무수) 27°C(헥사하이드레이트) |
| 비등점 | 934°C(1,713°F, 1,207K) |
| 117 g / 100 ml | |
| 기타 용매의 용해성 | THF, 메탄올, 에탄올 |
자기 감수성(magnetic susibility) | +13,600/10cm−63/cm/cm |
| 구조 | |
| 회전면, hP3, SpaceGroup = P-3m1, No. 164 | |
| 팔면체의 | |
| 위험 | |
| 산업안전보건(OHS/OSH): | |
주요 위험 | 없는 |
| 관련 화합물 | |
기타 음이온 | 불소 철(II) 염화철(II) 요오드화 철(II) |
기타 양이온 | 망간어(Manganese)II) 브로마이드 코발트(II)브로마이드 |
관련 화합물 | 바나듐()II) 브로마이드 브롬화 철(III) |
달리 명시된 경우를 제외하고, 표준 상태(25°C [77°F], 100 kPa)의 재료에 대한 데이터가 제공된다. | |
| Infobox 참조 자료 | |
철(II)브로마이드(Bromide)는 화학식 FeBr을2 함유한 무기 화합물이다. 무수 화합물은 황색 또는 갈색의 파라마그네틱 고체다. FeBr의2 수산화물도 알려져 있는데, 모두 옅은 색의 고체였다. 연구소의 다른 철 화합물에 대한 공통적인 전구체지만, 이 화합물에 대한 적용은 존재하지 않는다.
구조
대부분의 메탈할라이드와 마찬가지로 FeBr은2 할라이드와 교차 연결된 분리된 메탈 센터로 구성된 중합체 구조를 채택한다. 그것은 CdI2 구조로 결정되는데, 그 사이에 팔면 구멍에 Fe(II) 이온이 위치하는 브롬화 이온의 촘촘한 층이 특징이다.[1] 할로겐화물의 패킹은 CdCl2 모티브를 채택한 FeCl의2 패킹과는 약간 다르다.
합성 및 반응
FeBr은2 농축 하이드로브롬산과 철분말의 메탄올 용액을 이용해 합성된다. 수소 가스와 함께 메탄올 솔바이트[Fe(MeOH)]6Br을2 첨가한다. 메탄올 콤플렉스를 진공에서 가열하면 순수 FeBr이2 된다.[2]
FeBr은2 브로민화 테트라에틸아모늄의 등가물 2개와 반응하여 [(CH25)4N]2FeBr을4 부여한다.[3] FeBr은2 브로마이드와 브로민에 반응하여 강렬한 색상의 혼합 밸류 종[FeBrBr39]−[4]을 형성한다.
자기
FeBr은2 4.2K에서 강한 변광성을 가지고 있으며 오랫동안 원형 변광성 화합물로 연구되어 왔다.[5][6]
참조
- ^ Haberecht, J.; Borrmann, Η.; Kniep, R. (2001). "Refinement of the crystal structure of iron dibromide, FeBr2". Zeitschrift für Kristallographie - New Crystal Structures. 216 (1–4). doi:10.1524/ncrs.2001.216.14.544.
- ^ Winter, G. (1973). "Iron(II) Halides". Inorganic Syntheses. Inorganic Syntheses. Vol. 14. pp. 99–104. doi:10.1002/9780470132456.ch20. ISBN 9780470132456.
- ^ N. S. Gill, F. B. 테일러 무기체 합성 1967, 제9권 136-142페이지. 도이: 10.1002/9780470132401.ch37
- ^ Holleman, A.F.; Wiberg, E. "In 유기화학" 학술언론: 샌디에이고, 2001. ISBN 0-12-352651-5
- ^ Wilkinson, M. K.; Cable, J. W.; Wollan, E. O.; Koehler, W. C. (15 January 1959). "Neutron Diffraction Investigations of the Magnetic Ordering in FeBr2, CoBr2, FeCl2, and CoCl2". Physical Review. 113 (2): 497–507. Bibcode:1959PhRv..113..497W. doi:10.1103/PhysRev.113.497.
- ^ Jacobs, I. S.; Lawrence, P. E. (10 December 1967). "Metamagnetic Phase Transitions and Hysteresis in FeCl2". Physical Review. 164 (2): 866–878. Bibcode:1967PhRv..164..866J. doi:10.1103/PhysRev.164.866.