골드(III)브로마이드
Gold(III) bromide | |
 | |
| 이름 | |
|---|---|
| IUPAC 이름 골드(III)브로마이드 | |
| 기타 이름 오릭브로마이드 골드브로마이드 골드(III)브로마이드 골드 트리브로미드 디골드 헥사브로마이드 | |
| 식별자 | |
3D 모델(JSmol) | |
| 체비 | |
| 켐스파이더 | |
| ECHA InfoCard | 100.030.582 |
펍켐 CID | |
| 유니 | |
CompTox 대시보드 (EPA) | |
| |
| |
| 특성. | |
| 아우브르3 | |
| 어금질량 | 436.69 g/190 |
| 외관 | 검붉은 색에서 검붉은 색의 결정체. |
| 녹는점 | 97.5°C(207.5°F, 370.6K) |
| 약간 용해성[1] | |
| 위험 | |
| NFPA 704(화재 다이아몬드) | |
달리 명시된 경우를 제외하고, 표준 상태(25°C [77°F], 100 kPa)의 재료에 대한 데이터가 제공된다. | |
| Infobox 참조 자료 | |
골드(III)브로마이드(Blad-red to black crystaline solid)[2][3][4]는 검붉은 색부터 검은색의 결정 경험적 공식인 아우브르3(AuBr)를 가지고 있지만, 주로 두 개의 금 원자가 두 개의 브롬 원자에 의해 브리징되는 분자 공식인 아우브르26(AuBr)를 가진 디머로 존재한다.[3][4][5] 흔히 금(III)브로마이드, 금(金) 트리브로마이드, 드물지만 전통적으로 오릭 브로마이드, 때로는 디골드 육각화라고 부른다. 다른 금 할리드와 유사하게, 이 화합물은 구리 또는 은 복합체가 하나 또는 두 개의 산화 상태를 유지하는 반면, 3의 산화 상태에서 안정적인 그룹 11 전환 금속의 조정 복합체라는 점에서 독특하다.[6]
역사
금 할로겐화물의 연구나 연구에 대한 최초의 언급은 19세기 초에서 중반으로 거슬러 올라가며, 이 특정 화학 분야의 광범위한 조사와 관련된 세 명의 주요 연구자가 있다. 톰슨, 쇼틀렌더, 그리고 크뤼스.[7][8][9][10]
구조
디몰드 헥사브로마이드인 디머는 염화금(III)과 같은 다른 금 3할라이드 조광 화합물의 그것과 유사한 구조적 특성을 가지고 있다. 금 중심은 약 90도의 결합 각도로 정사각형 평면 조율을 보인다.[4][5]
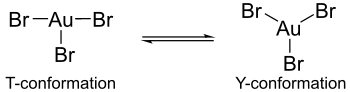
계산에 따르면, 가상의 삼할리드의 단항체 형태에서, 얀-텔러 효과는 금 할리드 복합체의 구조에서 차이를 일으킨다. 예를 들어, 금(III) 브롬화물은 1개의 긴 금브로민 결합과 2개의 짧은 금-브로민 결합을 포함하고 있는 반면, 금(III) 염화물과 금(III) 불소는 2개의 긴 금-할로겐 결합과 1개의 짧은 금-할로민 결합으로 구성된다.[5] 더욱이 골드 트리플로미드는 중심금 원자를 중심으로 삼염화 금이나 삼불화 금과 같은 조율을 나타내지 않는다. 후자의 콤플렉스에서 조정은 T-적합성을 나타내지만 골드 트리브로마이드에서는 Y-적합성과 T-적합성 사이의 동적 균형에 더 가깝기 때문에 조정은 존재한다. 이러한 조정 차이는 얀-텔러 효과에 기인할 수 있지만, 불소와 염소 리간드로 발견된 π-백 본딩에 비해 브롬 리간드와 금 원자의 π-백 본딩이 감소했기 때문이다. 골드 트리플로미드가 트리플루오린드, 트리클로로미드보다 안정성이 떨어지는 것도 이 같은 this백 본딩 감소 때문이다.[5]
준비
금(III)브로마이드의 가장 일반적인 합성법은 140 °C에서 금과 잉여 액체브로민을 가열하는 것이다.[2]
- 2 Au + 3 Br2 → Au2Br6
또는 염화금(III)과 수산화물(Hydrobromic acid)의 할로겐화 교환 반응도 금(III) 브롬화물의 합성에서 성공적인 것으로 입증되었다.
- Au2Cl6 + 6 HBr → 6 HCl + Au2Br6
이러한 반응은 하이드로브롬산에 비해 상대적으로 안정된 염산의 생산에 의해 추진된다.[11]
화학적 특성
중성 단량체 AuBr뿐만3 아니라 다른 중성 금 3할라이드 종은 3번 조정기가 선호되지 않는다는 가스 단계에서 격리되지 않았다.[6][12] 주로 금(III)은 선호하는 조정 번호 4에 해당하는 사각 평면 조율을 표시한다.[4]
구체적으로 용액에서 금(III) 삼할라이드는 네 번째 리간드를 추가하여 더 선호되는 4-조정 콤플렉스를 형성하는 경향이 있다.[6][12] 골드 트리브로마이드에 관해서는, 금(III) 브롬화 하이드레이트, AuBr3⋅를 구입하는 것이 일반적이다.HO2, 중앙 금 원자가 3의 조정 번호를 나타내는 화합물의 무수 형태보다는 4의 조정 번호를 나타낸다.
또는 네 번째 리간드를 추가하지 않으면 골드 트리브로미드가 과점하여 앞에서 언급한 할로겐 다리용 조광기 콤플렉스를 형성하게 된다.[6]
- 2 AuBr3 → AuBr26
게다가, 염화 금(III)과 마찬가지로, 골드 트리브로미드는 루이스 산이며 여러 콤플렉스를 형성할 수 있다.[12] 예를 들어 하이드로브롬산이 있으면 디머가 용해되고 브로모아우르산이 형성된다.[4]
- HBr (aq) + AuBr3 (aq) → H+AuBr4− (aq)
조광기는 습한 공기에서도 빠르게 가수분해를 겪는다.[2][4]
사용하다
촉매 화학
금(III) 브롬화물은 다양한 반응에서 촉매제로 쓰이지만 가장 흥미로운 용도 중 하나가 디엘-알데르 반응에서 발견된다. 구체적으로, 이 화합물은 에니날 유닛과 카보닐 화합물 사이의 반응을 촉진하여 6-membed 주기 화합물을 형성한다.[13]
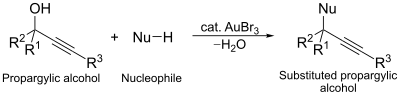
골드 트리브로미드의 또 다른 촉매적 사용은 프로파기알코올의 핵소독성 대체 반응에 있다. 이 반응에서 금단지는 알코올 활성제의 역할을 하여 치환을 용이하게 한다.[14]
케타민 검출
골드(III) 브로마이드는 케타민 유무에 대한 검사 시약으로 사용할 수 있다.[15]
0.25% AuBr3 0.1M NaOH는 갈색-황색 솔루션을 제공할 준비가 되어 있다. 이를 2방울 떨어뜨려 얼룩판에 넣고 소량의 케타민이 첨가된다. 이 혼합물은 약 1분 안에 진한 보라색 색을 내는데, 약 2분 안에 검게 물든 보라색으로 바뀐다.
아세트아미노펜, 아스코르브산, 헤로인, 락토오스, 만니톨, 모르핀, 자당류 모두 페놀과 히드록실 그룹의 다른 화합물들과 마찬가지로 보라색으로 즉각적인 색 변화를 일으킨다.
케타민과 함께 흔히 발견되는 어떤 것도 같은 시기에 같은 색의 변화를 주지 않았다.
"초기의 자주색은 금과 케타민 사이에 콤플렉스가 형성되었기 때문일지도 몰라. 보라색에서 짙은 검붉은 색으로 변하는 원인은 알 수 없지만, 소량의 콜로이드 금을 생산하는 리독스 반응 때문일 수 있다고 말했다.[15]
| 위키미디어 커먼즈에는 골드 트리브로미드와 관련된 미디어가 있다. |
참조
- ^ "Gold(III) bromide 99.999% trace metals". Sigma Aldrich. Sigma Aldrich. Retrieved 27 May 2021.
- ^ a b c 맥킨타이어, J. E. (ed.) 무기 화합물 사전; 채프먼 & 홀: 런던, 1992; 제 1, 페이지 121권
- ^ a b 노스캐롤라이나 주 그린우드, 노스캐롤라이나 주, 어니쇼 주, A. 원소의 화학; 버터워스-히네만: 1997년 옥스퍼드; 페이지 1183-1185
- ^ a b c d e f 면, FA; 윌킨슨, G.; 머릴로, C.A., 보흐만, M. 고급 무기화학; 존 와일리 & 선즈: 뉴욕, 1999; 페이지 1101-1102
- ^ a b c d 슐츠, A., 하기타이, M. 화학. J. 2001, 제7권 3657-3670호
- ^ a b c d 슈워트페거, P. J. 암 Chem. Soc. 1989, 111, 페이지 7261-7262
- ^ 렌지필드, F. J. 암 1901년 Soc. 26 페이지 324
- ^ 톰슨, J. J. 프랙트. 화학. 1876, 제13권, 페이지 337
- ^ 쇼틀렌더, 저스틴러스 리빅스 앤 화학, 제217권, 페이지 312
- ^ 크뤼스, G. 베르 Dtsch, Chemich. Ges. 1887, 제20권, 페이지 2634
- ^ D.B. 델아미코; 칼데라초, A. 모빌로; 펠리지, G. 로비노, P.J. 켐. Soc, Dalton Trans. 1991, 페이지 3009-3016
- ^ a b c 슈워트페거, 보이드, 펜실베이니아 주, 브리엔 주, 버렐 주, K. inorg. Chem. 1992, vol. 31, 페이지 3411-3422
- ^ 아사오, N.; 아이카와, H.; 야마모토, Y. J. Am. Chem. Soc. 2004, 126, 페이지 7458-7459
- ^ 조지, 엠.; 부카드, 브이.; 캄파뉴, 제이. 암. 화학. Soc. 2005, 127, 페이지 14180-14181
- ^ a b Sarwar, Mohammad. "A New, Highly Specific Color Test for Ketamine". The Microgram. Drug Enforcement Administration. Archived from the original on 2010-10-17. Retrieved 2012-01-26.