트롬보스폰딘 1호
Thrombospondin 1THBS1로 약칭되는 트롬보스폰딘 1은 인간에서 THBS1 유전자에 의해 암호화된 단백질이다.[5][6]
트롬보스폰딘 1은 이황화연계 호모트리메릭 단백질의 하위단위다.이 단백질은 세포와 세포간의 상호작용을 매개하는 접착성 당단백질이다.이 단백질은 피브리노겐, 피브로넥틴, 라미네인, 콜라겐 타입 V와 VII에 결합할 수 있으며 알파-V/베타-1을 통합할 수 있다.이 단백질은 혈소판 응집, 혈관신생, 종양성 등의 역할을 하는 것으로 밝혀졌다.[7][8]
함수
트롬보스폰딘-1 단백질은 트롬보스폰딘과에 속한다.다영역 매트릭스 당단백질인데 건강한 조직에서 신근육화 및 종양구조의 자연 억제제임을 보여 왔다.내피 세포 접착, 운동성 및 성장의 양과 음의 변조는 모두 TSP1에 기인한다.이는 TSP1이 CD36, αv 통합체, β1 통합체, 싱데칸 및 통합 관련 단백질(IAP 또는 CD47)을 포함하여 최소 12개의 세포 접착 수용체와 상호작용하는 것을 고려하면 놀랄 일이 아니다.또한 플라스미노겐, 우로키나아제, 매트릭스 메탈로프로테아제, 트롬빈, 카테핀, 엘라스타아제 등 혈관신생과 관련된 수많은 단백질과 상호작용한다.
트롬보스폰딘-1은 릴린 수용체인 아포ER2와 VLDLR에 결합되어, 이로 인해 로스트랄 철새천에서의 신경 이동에 영향을 미친다.[9]
TSR의 다양한 기능은 여러 가지 인식 모티브에 기인한다.이러한 모티브의 특성화는 이러한 모티브를 포함하는 재조합 단백질을 사용하게 했다; 이러한 재조합 단백질은 암 치료에 유용한 것으로 간주된다.TSP-1 3TSR(THBS1 항혈관신생 도메인의 재조합형 버전 3가지 혈소폰딘-1 타입 1 반복측정)은 변환 성장 인자 베타 1(TGFβ1)을 활성화하고 내피 세포 이동, 혈관신생, 종양 성장을 억제할 수 있다.[10]
구조
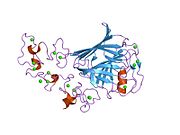
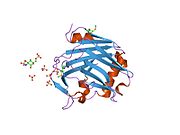
트롬보스폰딘의 활동은 여러 도메인, 특히 아미노-단자 헤파린 결합 도메인, 프로콜라겐 도메인, I가 반복하는 적절한 딘 타입, 구상 카복시-단자 도메인 등에 매핑되었다.단백질은 또한 표피 성장 인자 같은 호몰로지(homology)와 RGD 시퀀스를 포함하는 II형 반복측정(type II repeat)을 포함하고 있다.[11]
엔터미너스
TSP1의 N-단자 헤파린 결합 영역은 25kDa 파편으로 분리되었을 때, 고농도의 세포이동의 강력한 유도체로 나타났다.그러나, TSP1의 헤파린 결합 도메인을 세분화했을 때, 나머지 항기생성 도메인은 내피세포(EC) 이동 증가가 일어나는 저농도에서 항기생성 활성이 감소한 것으로 나타났다.이는 부분적으로 다른 도메인이 효과를 발휘하도록 허용하면서, 세포에 대한 TSP1의 부착을 중재하는 헤파린 결합 도메인의 능력에 의해 설명될 수 있다.TSP1의 헤파린 결합 부위가 고농도 대 저농도에서 수행하는 별도의 역할은 TSP1의 양면성을 조절하고 혈관신생의 양성 및 음성 조절자라는 평판을 주는 역할을 부분적으로 담당할 수 있다.[12]
프로콜라겐 도메인
TSP1의 Procollagen 도메인과 I 타입이 모두 신근분화 및 EC 마이그레이션을 억제하는 것으로 나타났다.그러나 이들 파편들의 작용 메커니즘이 같을 것 같지는 않다.TSP1의 I 타입은 3-4시간 노출 후 보이든 챔버 어세이에서 EC 이전을 억제할 수 있는 반면, Procollagen 도메인을 통한 EC 이주를 억제하기 위해서는 36-48시간의 노출 기간이 필요하다.[12]초리오알란토 멤브레인(CAM) 검사에서는 TSP1의 I형이 항혈관신생성이라는 것을 보여주는 반면, 프로콜라겐 시퀀스에는 항혈관신생 활성성이 결여되어 있다는 것도 알 수 있다.이것은 부분적으로 TSP1의 애니모-단자 종단부가 종에 걸쳐 카르복시-단자 종단보다 더 다르기 때문일 수 있지만, 또한 다른 작용 메커니즘을 제안할 수도 있다.[13]
TSP1은 반복하는 I형 세 가지 유형을 포함하며, 이 중 두 번째 유형만 혈관신생을 억제하는 것으로 밝혀졌다.I형 반복 모티브는 혈관신생을 억제하는 데 전체 단백질보다 효과가 뛰어나며, 활동영역이 1개만이 아니라 2개다.아미노 말단에는 섬유질 성장인자(FGF-2 또는 bFGF) 구동 혈관신생을 차단하는 트립토판이 풍부한 모티브가 포함되어 있다.이 지역은 또한 FGF-2 바인딩 EC를 방지하는 것으로 밝혀져, 그 작용 메커니즘이 FGF-2를 분리하는 것일 수 있음을 시사한다.두 번째 활동 영역인 TSP1의 CD36 결합 영역은 내가 반복하는 유형의 카르복시-단자 반에서 찾을 수 있다.[13]CD36 수용체를 활성화하면 세포외 신호에 대한 ECs 민감도가 증가한다는 것이 제안되었다.[14][15]1타입의 반복은 헤파린, 피브로넥틴, TGF-β 등과 결합되어 잠재적으로 EC에 대한 이러한 분자의 영향에 반감을 불러일으키는 것으로 나타났다.[16]단, CD36은 일반적으로 TSP1의 지배적인 억제 신호 수용체로 간주되며, CD36의 EC 표현은 마이크로혈관 EC로 제한된다.
수용성 1형은 증식을 억제하고 사멸을 촉진하여 EC 수치를 감소시키는 것으로 나타났다.섬유소세포에 내피세포를 부착하는 것은 부분적으로 이 현상을 역전시킨다.그러나 이 영역에는 그 자체의 두 얼굴의 성질이 없는 것은 아니다.내가 반복하는 유형의 결합 단백질 조각은 EC와 흑색종 세포 모두에 부착 인자로 작용하는 것으로 나타났다.[17]
C-terminus
TSP1의 카르복시 말단 영역은 세포 부착을 중재하는 것으로 믿어지고 TSP1, IAP(또는 CD47)의 또 다른 중요한 수용체에 결합하는 것으로 밝혀졌다.[18]이 수용체는 질소산화물 자극 TSP1 매개 혈관 세포 반응 및 cGMP 신호에 필요한 것으로 간주된다.[19]TSP1의 다양한 영역과 수용체는 암세포에 대한 친접착성 및 화학적 활동을 보이는 것으로 나타나 이 분자가 항혈관신생성 특성과는 무관한 암세포 생물학에 직접적인 영향을 미칠 수 있음을 시사했다.[20][21]
암치료
TSP1이 세포표면수용체(CD47)에 결합하는 것을 차단함으로써 정상조직은 암 방사선치료에 대한 높은 저항력을 혼란시키고 종양사멸을 돕는다는 연구결과가 나왔다.[22]
상호작용
트롬보스폰딘 1은 다음과 상호작용하는 것으로 나타났다.
참조
- ^ a b c GRCh38: 앙상블 릴리스 89: ENSG00000137801 - 앙상블, 2017년 5월
- ^ a b c GRCm38: 앙상블 릴리스 89: ENSMUSG000040152 - 앙상블, 2017년 5월
- ^ "Human PubMed Reference:". National Center for Biotechnology Information, U.S. National Library of Medicine.
- ^ "Mouse PubMed Reference:". National Center for Biotechnology Information, U.S. National Library of Medicine.
- ^ Wolf FW, Eddy RL, Shows TB, Dixit VM (Apr 1990). "Structure and chromosomal localization of the human thrombospondin gene" (PDF). Genomics. 6 (4): 685–91. doi:10.1016/0888-7543(90)90505-O. hdl:2027.42/28657. PMID 2341158.
- ^ Jaffe E, Bornstein P, Disteche CM (May 1990). "Mapping of the thrombospondin gene to human chromosome 15 and mouse chromosome 2 by in situ hybridization". Genomics. 7 (1): 123–6. doi:10.1016/0888-7543(90)90528-3. PMID 2335352.
- ^ "Entrez Gene: THBS1 thrombospondin 1".
- ^ Atanasova, VS; Russell, RJ; Webster, TG; Cao, Q; Agarwal, P; Lim, YZ; Krishnan, S; Fuentes, I; Guttmann-Gruber, C; McGrath, JA; Salas-Alanis, JC; Fertala, A; South, AP (July 2019). "Thrombospondin-1 Is a Major Activator of TGF-β Signaling in Recessive Dystrophic Epidermolysis Bullosa Fibroblasts". The Journal of Investigative Dermatology. 139 (7): 1497–1505.e5. doi:10.1016/j.jid.2019.01.011. PMID 30684555.
- ^ Blake SM, Strasser V, Andrade N, Duit S, Hofbauer R, Schneider WJ, Nimpf J (Nov 2008). "Thrombospondin-1 binds to ApoER2 and VLDL receptor and functions in postnatal neuronal migration". The EMBO Journal. 27 (22): 3069–80. doi:10.1038/emboj.2008.223. PMC 2585172. PMID 18946489.
- ^ Lopez-Dee ZP, Chittur SV, Patel B, Stanton R, Wakeley M, Lippert B, Menaker A, Eiche B, Terry R, Gutierrez LS (2012). "Thrombospondin-1 type 1 repeats in a model of inflammatory bowel disease: transcript profile and therapeutic effects". PLOS ONE. 7 (4): e34590. Bibcode:2012PLoSO...734590L. doi:10.1371/journal.pone.0034590. PMC 3318003. PMID 22509329.
- ^ Forslöw A, Liu Z, Sundqvist KG (Jan 2007). "Receptor communication within the lymphocyte plasma membrane: a role for the thrombospondin family of matricellular proteins". Cellular and Molecular Life Sciences. 64 (1): 66–76. doi:10.1007/s00018-006-6255-8. PMID 17160353. S2CID 1394973.
- ^ a b Tolsma SS, Volpert OV, Good DJ, Frazier WA, Polverini PJ, Bouck N (Jul 1993). "Peptides derived from two separate domains of the matrix protein thrombospondin-1 have anti-angiogenic activity". The Journal of Cell Biology. 122 (2): 497–511. doi:10.1083/jcb.122.2.497. PMC 2119646. PMID 7686555.
- ^ a b Iruela-Arispe ML, Lombardo M, Krutzsch HC, Lawler J, Roberts DD (Sep 1999). "Inhibition of angiogenesis by thrombospondin-1 is mediated by 2 independent regions within the type 1 repeats". Circulation. 100 (13): 1423–31. doi:10.1161/01.cir.100.13.1423. PMID 10500044.
- ^ Guo N, Krutzsch HC, Inman JK, Roberts DD (May 1997). "Thrombospondin 1 and type I repeat peptides of thrombospondin 1 specifically induce apoptosis of endothelial cells". Cancer Research. 57 (9): 1735–42. PMID 9135017.
- ^ Sid B, Sartelet H, Bellon G, El Btaouri H, Rath G, Delorme N, Haye B, Martiny L (Mar 2004). "Thrombospondin 1: a multifunctional protein implicated in the regulation of tumor growth". Critical Reviews in Oncology/Hematology. 49 (3): 245–58. doi:10.1016/j.critrevonc.2003.09.009. PMID 15036264.
- ^ Guo N, Zabrenetzky VS, Chandrasekaran L, Sipes JM, Lawler J, Krutzsch HC, Roberts DD (Jul 1998). "Differential roles of protein kinase C and pertussis toxin-sensitive G-binding proteins in modulation of melanoma cell proliferation and motility by thrombospondin 1". Cancer Research. 58 (14): 3154–62. PMID 9679984.
- ^ Prater CA, Plotkin J, Jaye D, Frazier WA (Mar 1991). "The properdin-like type I repeats of human thrombospondin contain a cell attachment site". The Journal of Cell Biology. 112 (5): 1031–40. doi:10.1083/jcb.112.5.1031. PMC 2288870. PMID 1999454.
- ^ Kosfeld MD, Frazier WA (Aug 1992). "Identification of active peptide sequences in the carboxyl-terminal cell binding domain of human thrombospondin-1". The Journal of Biological Chemistry. 267 (23): 16230–6. doi:10.1016/S0021-9258(18)41990-4. PMID 1644809.
- ^ Isenberg JS, Ridnour LA, Dimitry J, Frazier WA, Wink DA, Roberts DD (Sep 2006). "CD47 is necessary for inhibition of nitric oxide-stimulated vascular cell responses by thrombospondin-1". The Journal of Biological Chemistry. 281 (36): 26069–80. doi:10.1074/jbc.M605040200. PMID 16835222.
- ^ Chandrasekaran S, Guo NH, Rodrigues RG, Kaiser J, Roberts DD (Apr 1999). "Pro-adhesive and chemotactic activities of thrombospondin-1 for breast carcinoma cells are mediated by alpha3beta1 integrin and regulated by insulin-like growth factor-1 and CD98". The Journal of Biological Chemistry. 274 (16): 11408–16. doi:10.1074/jbc.274.16.11408. PMID 10196234.
- ^ Taraboletti G, Roberts DD, Liotta LA (Nov 1987). "Thrombospondin-induced tumor cell migration: haptotaxis and chemotaxis are mediated by different molecular domains". The Journal of Cell Biology. 105 (5): 2409–15. doi:10.1083/jcb.105.5.2409. PMC 2114831. PMID 3680388.
- ^ Maxhimer 존 바릴, Soto-Pantoja DR, Ridnour LA시츄 HB, Degraff WG, Tsokos M, 윙크 DA, Isenberg JS, 로버츠 DD(10월 2009년)."정상적인 조직에서 Radioprotection과 CD47의 봉쇄로써 종양의 성장 지연 신호".병진의 과학 1(3):3ra7.doi:10.1126/scitranslmed.3000139.PMC2811586.PMID 20161613.에서 *Lay 요약:"'Holy 곧 성배의 Of 암 치료:.연구진은 파이팅 방사선 Damage"부터 건강한 세포를 보호하는 것을 찾았다.sciencedaily.com.2009년 10월 21일.
- ^ Wang S, Herndon ME, Ranganathan S, Godyna S, Lawler J, Argraves WS, Liau G (Mar 2004). "Internalization but not binding of thrombospondin-1 to low density lipoprotein receptor-related protein-1 requires heparan sulfate proteoglycans". Journal of Cellular Biochemistry. 91 (4): 766–76. doi:10.1002/jcb.10781. PMID 14991768. S2CID 12198474.
- ^ Mikhailenko I, Krylov D, Argraves KM, Roberts DD, Liau G, Strickland DK (Mar 1997). "Cellular internalization and degradation of thrombospondin-1 is mediated by the amino-terminal heparin binding domain (HBD). High affinity interaction of dimeric HBD with the low density lipoprotein receptor-related protein". The Journal of Biological Chemistry. 272 (10): 6784–91. doi:10.1074/jbc.272.10.6784. PMID 9045712.
- ^ Godyna S, Liau G, Popa I, Stefansson S, Argraves WS (Jun 1995). "Identification of the low density lipoprotein receptor-related protein (LRP) as an endocytic receptor for thrombospondin-1". The Journal of Cell Biology. 129 (5): 1403–10. doi:10.1083/jcb.129.5.1403. PMC 2120467. PMID 7775583.
- ^ Bein K, Simons M (Oct 2000). "Thrombospondin type 1 repeats interact with matrix metalloproteinase 2. Regulation of metalloproteinase activity". The Journal of Biological Chemistry. 275 (41): 32167–73. doi:10.1074/jbc.M003834200. PMID 10900205.
- ^ Silverstein RL, Leung LL, Harpel PC, Nachman RL (Nov 1984). "Complex formation of platelet thrombospondin with plasminogen. Modulation of activation by tissue activator". The Journal of Clinical Investigation. 74 (5): 1625–33. doi:10.1172/JCI111578. PMC 425339. PMID 6438154.
- ^ DePoli P, Bacon-Baguley T, Kendra-Franczak S, Cederholm MT, Walz DA (Mar 1989). "Thrombospondin interaction with plasminogen. Evidence for binding to a specific region of the kringle structure of plasminogen". Blood. 73 (4): 976–82. doi:10.1182/blood.V73.4.976.976. PMID 2522013.
외부 링크
- Trombospondin+1(미국 국립 의학 라이브러리 의료 과목 제목)