분자 이미징
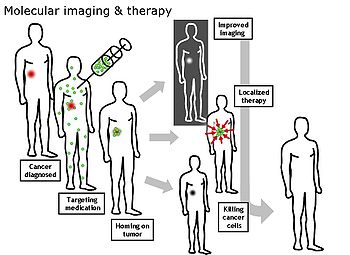
Molecular imaging분자 이미징은 살아있는 환자의 의학적 관심 분자를 이미징하는 의료 이미징 분야입니다.이는 조직학과 같은 보존된 조직 샘플로부터 분자 정보를 얻는 기존의 방법과는 대조적이다.관심 분자는 신체에 의해 자연적으로 생성된 분자나 실험실에서 생산되어 의사가 환자에게 주입한 합성 분자가 될 수 있다.오늘날 임상적으로 사용되는 분자 이미징의 가장 일반적인 예는 조영제(예: 마이크로버블, 금속 이온 또는 방사성 동위원소)를 환자의 혈류에 주입하고 영상 양식(예: 초음파, MRI, CT, PET)을 사용하여 환자의 체내 움직임을 추적하는 것이다.분자 이미징은 비침습적인 방법으로 유기체 내부의 기본적인 분자 과정을 더 잘 이해할 필요성으로부터 방사선학 분야에서 비롯되었다.
분자 이미징의 궁극적인 목표는 유기체 내부에서 일어나는 모든 생화학적 과정을 실시간으로 관찰할 수 있는 것이다.분자 이미징의 현재 연구는 세포/분자 생물학, 화학 및 의학 물리학을 포함하며 1) 이전에 검출할 수 없었던 유형의 분자를 검출하기 위한 이미징 방법의 개발 2) 이용 가능한 조영제의 수와 유형의 확장, 3) 다음에 대한 정보를 제공하는 기능성 조영제의 개발에 초점을 맞추고 있다.세포와 조직이 건강과 질병 모두에서 수행하는 다양한 활동들
개요
분자 이미징은 분자생물학과 생체내 이미징의 교차점에서 20세기 중반에 등장했다.그것은 세포 기능을 시각화하고 그것들을 방해하지 않고 살아있는 유기체의 분자 과정을 추적하는 것을 가능하게 한다.이 분야의 다양한 잠재력은 암, 신경 및 심혈관 질환 등의 진단에 적용할 수 있다.이 기술은 또한 새로운 약물의 임상 전 및 임상 테스트를 최적화함으로써 이러한 장애의 치료 개선에 기여합니다.그들은 또한 더 빠르고 정확한 진단으로 인해 큰 경제적 영향을 미칠 것으로 예상된다.분자 및 기능 이미징은 인간 게놈의 기술 이후 새로운 방향으로 나아가고 있다.응용 및 산업 연구뿐만 아니라 기초 연구의 새로운 경로는 과학자들의 임무를 더 복잡하게 만들고 그에 대한 요구를 증가시킨다.따라서 맞춤형 교육 프로그램이 필요합니다.
분자 이미징은 바이오마커로 알려진 프로브가 특정 표적이나 경로를 이미지화하는 데 사용된다는 점에서 기존 이미지와는 다릅니다.바이오마커는 주변과 화학적으로 상호작용하고 관심 영역 내에서 일어나는 분자 변화에 따라 이미지를 변화시킵니다.이 과정은 밀도 또는 수분 함량과 같은 품질의 차이를 주로 이미지화한 이전의 이미지 방법과는 확연히 다릅니다.미세 분자 변화를 영상화하는 이 능력은 질병의 조기 발견과 치료, 그리고 기본적인 의약품 개발을 포함한 의학 응용에 있어 믿을 수 없을 정도로 많은 흥미로운 가능성을 열어줍니다.또한 분자 이미징은 정량적 테스트를 가능하게 하여 이러한 영역의 연구에 더 많은 객관성을 부여한다.새로운 기술 중 하나는 질량분석에 [citation needed]기초한 MALDI 분자 이미징이다.
분자 이미징 분야에서 많은 연구가 이루어지고 있다.많은 연구가 현재 질병의 전형적인 증상이 발견되기 전에 발생하는 질병 전 상태 또는 분자 상태로 알려진 것을 발견하는 데 초점이 맞춰져 있다.다른 중요한 연구 정맥은 유전자 발현 영상화와 새로운 바이오마커의 개발이다.SMMI(분자 이미징 이노베이션 및 번역을 위한 SNMI 센터) 등의 조직이 이 분야의 연구를 지원하기 위해 설립되었습니다.유럽에서는 DiMI(Diagnostics in Molecular Imaging) 또는 EMIL(European Molecular Imaging Laboratory)과 같은 다른 "뛰어난 네트워크"가 이 새로운 과학에 대해 연구 활동과 연구를 통합하고 있습니다.이와 같이, European Master Program "EMMI"는 분자 이미징 분야의 신세대 전문가를 양성하기 위해 설립되고 있습니다.
최근에는 생세포 현미경, TIRF(Total Internal Reflection Fluorescopy) 현미경, STED(Stimulated Emission Depletion) 나노경, 원자력 현미경(AFM) 등 다양한 현미경 및 나노경 기술에 분자 이미징이라는 용어가 사용되고 있다.
이미징 모드
비침습적 분자 이미징에 사용할 수 있는 다양한 양식이 있습니다.각각 다른 장점과 단점을 가지고 있으며, 어떤 이들은 다른 사람들보다 여러 대상을 더 잘 묘사합니다.
자기공명영상
MRI는 공간 분해능이 매우 높다는 장점이 있으며 형태학적 이미징과 기능적 이미징에 매우 능숙합니다.하지만 MRI에는 몇 가지 단점이 있습니다.첫째, MRI 감도는 10mol−3/L−5~10mol/L 정도로 다른 영상과 비교하여 매우 제한적일 수 있습니다.이 문제는 고에너지 상태의 원자와 저에너지 상태의 원자의 차이가 매우 작기 때문에 발생합니다.예를 들어, 임상 MRI의 전형적인 전계 강도인 1.5 Tesla에서 높은 에너지 상태와 낮은 에너지 상태의 차이는 약 200만 [citation needed]분자에 9개입니다.MR 감도를 증가시키기 위한 개선사항으로는 자기장 강도의 증가, 광펌핑에 의한 과분극, 동적 핵분극 또는 부수소 유도 분극이 있다.감도를 [1]높이는 화학 교환에 기초한 다양한 신호 증폭 방식도 있습니다.
MRI를 이용한 질병 바이오마커의 분자 이미징을 위해서는 높은 특이성과 높은 이완성(감도)을 가진 표적 MRI 조영제가 필요하다.지금까지 많은 연구가 MRI에 의한 분자 이미징을 달성하기 위해 표적 MRI 조영제를 개발하는 데 전념해 왔다. 일반적으로 표적화를 달성하기 위해 펩타이드, 항체 또는 작은 리간드와 HER-2 어피체와 같은 작은 단백질 도메인이 적용되어 왔다.조영제의 민감도를 높이기 위해 이러한 표적 부분은 일반적으로 높은 페이로드 MRI 조영제 또는 높은 [2]이완성을 가진 MRI 조영제에 연결됩니다.특히, 최근 미크론 크기의 산화철 입자(MPIO)의 개발로 동맥과 [3]정맥에 의해 발현되는 단백질을 검출하기 위한 전례 없는 수준의 민감도에 도달했다.
광학 이미징
광학 이미징에는 여러 가지 방법이 사용됩니다.다양한 방법은 형광, 생물 발광, 흡수 또는 반사율에 따라 [4]대조된다.
광학 이미징의 가장 중요한 속성은 광학 이미징과 초음파는 다른 의료 이미징 [citation needed]양식처럼 강력한 안전 문제를 가지고 있지 않다는 것이다.
광학 이미징의 단점은 특히 가시 파장에서 작업할 때 투과 깊이가 부족하다는 것입니다.투과 깊이는 빛의 흡수 및 산란과 관련이 있으며, 이는 주로 여기 소스의 파장의 함수입니다.빛은 살아있는 조직(예: 헤모글로빈, 멜라닌, 지질)에서 발견되는 내인성 색소에 의해 흡수됩니다.일반적으로 빛의 흡수 및 산란은 파장이 증가함에 따라 감소한다.최대 700 nm(예: 가시 파장) 이하에서는 이러한 영향으로 몇 밀리미터의 얕은 침투 깊이가 발생합니다.따라서 스펙트럼의 가시 영역에서는 조직 특성의 피상적 평가만 가능하다.900 nm를 넘으면 흡수가 신호 대 백그라운드 비를 방해할 수 있습니다.근적외선(NIR) 영역(700~900nm)에서는 조직의 흡수계수가 상당히 낮기 때문에 빛이 몇 센티미터 [5]깊이까지 더 깊이 투과할 수 있다.
근적외선 이미징
형광 탐침과 라벨은 광학 이미징에 중요한 도구입니다.일부 연구자들은 아포토시스 세포와 괴사 [6]세포에 결합할 수 있는 펩타이드 프로브를 사용하여 급성 심근경색의 랫드 모델에 NIR 이미지를 적용했다.생체 내 이미징에는 Kodak X-SITE 염료 및 복합체, Pz 247, DyLight 750 및 800 플루어, Cy 5.5 및 7 플루어, Alexa Fluor 680 및 750 염료, IRDYE 680 및 800 Fluor를 포함한 다수의 근적외선(NIR) 형광체가 사용되었습니다.광안정성과 밝은 방출을 가진 양자 점은 많은 관심을 불러일으켰지만, 그 크기가 장기 [citation needed]독성을 나타내면서 순환계와 신장계로부터의 효율적인 제거를 방해한다.
여러 연구에서 적외선 염료 라벨이 부착된 프로브를 광학 이미징에 사용하는 것이 입증되었습니다.
- αvβ3-integrin 양성 흑색종 [7]이종이식물의 촬상에는 In과 NIR 불소포자가 이중 라벨된 사이클로펜타펩타이드와 NIR 불소포자를 사용했다.
- αvβ3-integrin을 대상으로 하는 근적외선 표지 RGD는 다양한 [8]암을 대상으로 하는 수많은 연구에서 사용되어 왔다.
- NIR 불소포자는 종양진행 [9]이미징을 위해 표피성장인자(EGF)와 결합되었다.
- NIR 형광체를 Cy5.5와 비교한 결과, 긴 파장 염료가 광학 [10]이미징을 위한 보다 효과적인 표적제를 생산할 수 있음을 시사했다.
- 파미드로네이트는 NIR 불소체로 라벨이 부착되어 있으며 [11]살아있는 동물의 골아세포 활성을 검출하기 위한 뼈 이미징제로 사용되고 있다.
- PSMA(prostate specific membrane [12]antigen)의 잠재적 억제제인 NIR 불소포자 표지의 GPI.
- 센티넬 림프절 [13]매핑을 위한 추적제로서 NIR 불소포자로 라벨이 부착된 인간 혈청 알부민 사용.
- NIR 불소 [14]포자로 표시된 2-디옥시-D-포도당.
벡터에 NIR 프로브를 추가하면 벡터의 생체적합성과 생물분포가 바뀔 수 있다는 점에 유의해야 합니다.따라서, 켤레 벡터가 네이티브 형태와 비슷하게 행동할 것이라고 명백하게 가정할 수 없다.
단일 광자 방출 컴퓨터 단층 촬영

1970년대 컴퓨터 단층촬영의 개발로 장기나 조직의 방사성 동위원소 분포를 매핑할 수 있게 되었고, 현재는 단일 광자 방출 컴퓨터 단층촬영(SPEC)이라고 불리는 기술로 이어졌다.
SPECT에 사용되는 이미징제는 PET에 사용되는 양전자 방출체(F 등)와 반대로 감마선을 방출합니다.특정 용도에 따라 사용할 수 있는 방사 트레이서(Tc, In, I, Tl 등)의 범위가 있습니다.
제논(133
Xe) 가스는 그러한 방사선 추적기 중 하나입니다.폐 기능 평가를 위한 진단 흡입 연구, 폐 영상촬영, rCBF 평가 등에 유용한 것으로 나타났습니다.이 가스의 검출은 감마 카메라(콜리메이터, NaI 결정 및 광전자 증배관 세트로 구성된 섬광 검출기)를 통해 이루어진다.
감마카메라를 환자 주위에 회전시킴으로써 필터링된 역투영 또는 다른 단층촬영 기법을 사용하여 방사선 트레이서 분포의 3차원 화상을 얻을 수 있다.SPECT에 사용되는 방사성 동위원소는 반감기가 비교적 길기 때문에(몇 시간에서 며칠), 생산하기 쉽고 비교적 저렴하다.이는 PET 또는 fMRI보다 상당히 저렴하기 때문에 분자 이미징 기술로서의 SPECT의 주요 장점을 나타냅니다.단, 공간적(즉, 입자가 정확히 있는 위치) 또는 시간적(즉, 조영제 신호가 이 밀리초 또는 밀리초 해상도로 발생했는지)이 부족합니다.또한 조영제의 방사능으로 인해 피험자에 대한 방사성 동위원소 투여, 특히 연쇄 연구의 경우 안전 측면도 있다.
양전자 방출 단층 촬영
양전자방출단층촬영(PET)은 핵의학 이미징 기술로 3차원 영상이나 신체 기능적 과정을 보여준다.PET의 이면에 있는 이론은 충분히 간단하다.우선 분자는 양전자 방출 동위원소로 태그가 붙는다.이러한 양전자는 두 개의 511 keV 광자를 방출하면서 근처의 전자와 함께 전멸하며 반대 방향으로 180도 떨어져 있습니다.이 광자들은 스캐너에 의해 검출되며, 이것은 특정 영역의 양전자 소멸 밀도를 추정할 수 있다.충분한 상호작용과 소멸이 일어났을 때, 원래 분자의 밀도는 그 영역에서 측정될 수 있다.대표적인 동위원소에는 C, N, O, F, Cu, Cu, I, Br, Rb, Zr 및 Ga가 있으며, F는 임상적으로 가장 많이 이용된다.PET의 주요 단점 중 하나는 대부분의 프로브가 사이클로트론으로 만들어져야 한다는 것입니다.대부분의 탐침은 반감기가 몇 시간 안에 측정되기 때문에 사이클로트론이 현장에 있어야 합니다.이러한 요인들로 인해 PET는 엄청나게 비싸질 수 있습니다.하지만 PET 이미징은 많은 장점이 있다.우선 감도가 가장 중요합니다.일반적인 PET 스캐너는 10mol/L에서−12 10mol/L 농도를−11 검출할 수 있습니다.
「 」를 참조해 주세요.
레퍼런스
- ^ Gallagher, F.A. (2010). "An introduction to functional and molecular imaging with MRI". Clinical Radiology. 65 (7): 557–566. doi:10.1016/j.crad.2010.04.006. ISSN 0009-9260. PMID 20541655.
- ^ Shenghui, Xue; Jingjuan Qiao; Fan Pu; Mathew Cameron; Jenny J. Yang (17 Jan 2013). "Design of a novel class of protein-based magnetic resonance imaging contrast agents for the molecular imaging of cancer biomarkers". Wiley Interdiscip Rev Nanomed Nanobiotechnol. 5 (2): 163–79. doi:10.1002/wnan.1205. PMC 4011496. PMID 23335551.
- ^ Gauberti M, Montagne A, Quenault A, Vivien D (2014). "Molecular magnetic resonance imaging of brain-immune interactions". Front Cell Neurosci. 8: 389. doi:10.3389/fncel.2014.00389. PMC 4245913. PMID 25505871.
- ^ Weissleder R, Mahmood U (May 2001). "Molecular imaging". Radiology. 219 (2): 316–33. doi:10.1148/radiology.219.2.r01ma19316. PMID 11323453.
- ^ Kovar JL, Simpson MA, Schutz-Geschwender A, Olive DM (August 2007). "A systematic approach to the development of fluorescent contrast agents for optical imaging of mouse cancer models". Anal. Biochem. 367 (1): 1–12. doi:10.1016/j.ab.2007.04.011. PMID 17521598. 2009년 2월 11일, Wayback Machine에서 PDF로 아카이브 완료
- ^ Acharya, B; Wang, K; Kim, IS; Kang, W; Moon, C; Lee, BH (2013). "In vivo imaging of myocardial cell death using a peptide probe and assessment of long-term heart function". Journal of Controlled Release. 172 (1): 367–73. doi:10.1016/j.jconrel.2013.08.294. PMID 24021357.
- ^ Houston JP, Ke S, Wang W, Li C, Sevick-Muraca EM (2005). "Quality analysis of in vivo near-infrared fluorescence and conventional gamma images acquired using a dual-labeled tumor-targeting probe". J Biomed Opt. 10 (5): 054010. doi:10.1117/1.2114748. PMID 16292970.
- ^ Chen K, Xie J, Chen X (2009). "RGD-human serum albumin conjugates as efficient tumor targeting probes". Mol Imaging. 8 (2): 65–73. doi:10.2310/7290.2009.00011. PMC 6366843. PMID 19397852. Archived from the original on 2014-03-26.
- ^ Kovar JL, Johnson MA, Volcheck WM, Chen J, Simpson MA (October 2006). "Hyaluronidase expression induces prostate tumor metastasis in an orthotopic mouse model". Am. J. Pathol. 169 (4): 1415–26. doi:10.2353/ajpath.2006.060324. PMC 1698854. PMID 17003496.
- ^ Adams KE, Ke S, Kwon S, et al. (2007). "Comparison of visible and near-infrared wavelength-excitable fluorescent dyes for molecular imaging of cancer". J Biomed Opt. 12 (2): 024017. doi:10.1117/1.2717137. PMID 17477732. S2CID 39806507.
- ^ Zaheer A, Lenkinski RE, Mahmood A, Jones AG, Cantley LC, Frangioni JV (December 2001). "In vivo near-infrared fluorescence imaging of osteoblastic activity". Nat. Biotechnol. 19 (12): 1148–54. doi:10.1038/nbt1201-1148. PMID 11731784. S2CID 485155.
- ^ Humblet V, Lapidus R, Williams LR, et al. (2005). "High-affinity near-infrared fluorescent small-molecule contrast agents for in vivo imaging of prostate-specific membrane antigen". Mol Imaging. 4 (4): 448–62. doi:10.2310/7290.2005.05163. PMID 16285907.
- ^ Ohnishi S, Lomnes SJ, Laurence RG, Gogbashian A, Mariani G, Frangioni JV (2005). "Organic alternatives to quantum dots for intraoperative near-infrared fluorescent sentinel lymph node mapping". Mol Imaging. 4 (3): 172–81. doi:10.1162/15353500200505127. PMID 16194449.
- ^ Kovar JL, Volcheck W, Sevick-Muraca E, Simpson MA, Olive DM (January 2009). "Characterization and performance of a near-infrared 2-deoxyglucose optical imaging agent for mouse cancer models". Anal. Biochem. 384 (2): 254–62. doi:10.1016/j.ab.2008.09.050. PMC 2720560. PMID 18938129. 2011년 7월 13일, Wayback Machine에서 PDF로 아카이브 완료