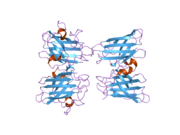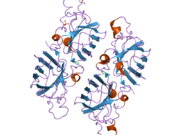SOD1
SOD1과산화 분해효소 [Cu-Zn] 또는 과산화 분해효소 1 또는 SOD1로도 알려진 과산화 분해효소[Cu-Zn]는 인간에서 21번 염색체에 위치한 SOD1 유전자에 의해 암호화되는 효소다. SOD1은 3개의 인간 과산화 분해효소 중 하나이다.[5][6] 그것은 사멸과 가족성 근위축성 측경화증과 관련이 있다.[6]
구조
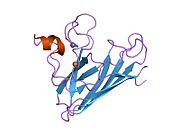
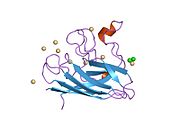
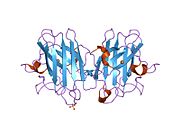
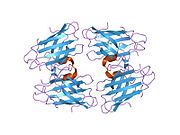
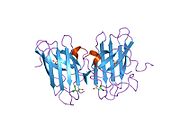
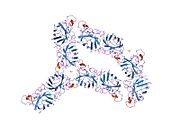
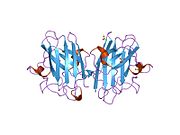
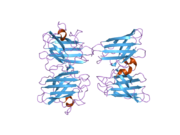
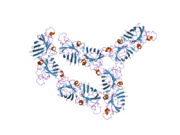
SOD1은 32 kDa 호모디머로 β-바렐을 형성하며 각 서브 유닛에 분자 내 이황화 결합과 이핵 Cu/Zn 사이트를 포함하고 있다. 이 Cu/Zn 사이트는 구리와 아연 이온을 보유하고 있으며 과산화수소와 이산화수소에 대한 과산화수소의 불균형을 촉진하는 역할을 한다.[7][8] 이 단백질의 성숙 과정은 복잡하고 완전히 이해되지 않으며, 구리와 아연 이온의 선택적 결합, Cys-57과 Cys-146 사이의 서브유닛 내 이황화 결합 형성, 두 서브유닛의 조광화 등이 포함된다. Sod1용 구리 샤페론(CCS)은 구리 삽입과 이황화 산화를 촉진한다. SOD1은 시토솔에서 합성되어 그곳에서 성숙할 수 있지만, 미토콘드리아를 대상으로 한 SOD1의 분율은 반드시 중간 공간에 삽입되어야 한다. 거기서, 그것은 철분은 아니지만 그것의 성숙에 필요한 이황화 결합을 형성한다.[8] 성숙한 단백질은 매우 안정적이지만 금속이 없고 이황화물이 감소된 형태일 때 불안정하다.[9][7][8][9] 이러한 현상은 금속 이온의 손실로 인해 SOD1 집적이 증가하고 질병 모델에서는 불용성 SOD1에 대해 낮은 금속화가 관찰되므로 시험관내에서도 나타난다. 더욱이 표면 노출 감소된 시스테인은 이황화 교차링킹에 참여할 수 있고, 따라서 집계에 참여할 수 있다.[7]
함수
SOD1은 구리와 아연 이온을 결합하며, 체내의 유리 과산화질소를 파괴하는 세 개의 과산화질소 분해물 중 하나이다. 부호화된 이소자임은 수용성 세포질 및 미토콘드리아 간 우주 단백질로, 자연적으로 발생하지만 유해하고 과산화질소가 분자 산소와 과산화수소로 변환하는 호모디머 역할을 한다.[8][10] 과산화수소는 카탈라아제라고 불리는 또 다른 효소에 의해 분해될 수 있다.
SOD1은 과산화 음이온이 생성되는 외부 미토콘드리아 막(OMM) 또는 음이온 간 공간에 국부화하도록 가정되었다. 정확한 국산화 메커니즘은 아직 알려지지 않았지만, OMM에 대한 통합은 BCL-2와의 연관성에 기인한다. 와일드타입 SOD1은 신경 배양에서 항갑상선 특성을 입증한 반면 돌연변이 SOD1은 척수 미토콘드리아에서는 사멸을 촉진하는 것이 관찰되었지만, 간 미토콘드리아에서는 그렇지 않다. 두 모델은 BCL-2 단백질 또는 미토콘드리아 자체와 상호 작용하여 SOD1 억제제를 제안한다.[6]
임상적 유의성
산화 응력에서의 역할
특히 심장마비(허혈성 심장병이라고도 함)의 일부로 심근에서 허혈성 재융해 손상에 의한 산화 스트레스 중 SOD1이 반응성 산소종(ROS) 방출에 중추적인 역할을 한다. 주요 관상동맥 중 하나의 폐색에서 비롯되는 허혈성 심장질환은 현재도 서구사회에서 질병과 사망의 주요 원인이다.[11][12] 허혈성 레퍼시퓨전 동안, ROS 방출은 세포에 직접적인 영향을 미치고 세포 사멸에 실질적으로 기여한다. SOD1은 ROS의 유해한 영향을 제한할 수 있는 용량이 있는 것으로 알려져 있다. 이와 같이 SOD1은 심장 보호 효과를 위해 중요하다.[13] 또한 SOD1은 심장의 허혈성 전제 조건화 중과 같은 허혈성 재융해 손상에 대한 심장내복제술에 관여했다.[14] ROS가 크게 터지면 세포 손상으로 이어진다고 알려져 있지만, 치명적이지 않은 짧은 허혈증 에피소드 중에 발생하는 미토콘드리아에서 ROS를 적당히 방출하는 것은 허혈성 전제조건의 신호 전달 경로에 있어 세포 손상 감소로 이어지는 중요한 촉발 역할을 할 수 있다. 심지어 이 ROS의 출시 동안 SOD1은 세포사멸과 세포사멸을 조절함으로써 여기서 중요한 역할을 한다는 것을 관찰했다.
한 연구에서, 유전자의 삭제는 두 가족의 케라토콘 사례에서 보고되었다.[15] SOD1이 부족한 생쥐는 노화 관련 근육량 손실(사르코피아), 백내장 조기발육, 황반변성, 흉선비자극, 간세포암, 수명을 단축시켰다.[16] 연구 결과에 따르면 SOD1 레벨 증가가 장기 치과용 아말감 충전재 여성의 만성 중금속 독성을 위한 바이오마커일 수 있다.[17]
근위축성 측경화증(루게릭병)
이 유전자의 돌연변이(150개 이상 확인)는 가족성 근위축성 측경화증과 연관되어 있다.[18][19][20] 그러나, 몇몇 증거들은 세포 스트레스 조건 하에서 야생형 SOD1이 산발적인 ALS 환자들의 90%를 차지하는 상당한 부분에 관련되어 있다는 것을 보여준다.[21] 가장 빈번한 돌연변이는 A4V(미국)와 H46R(일본)이다. 아이슬란드에서는 SOD1-G93S만이 발견되었다. 가장 많이 연구된 ALS 마우스 모델은 G93A이다. 이 유전자에 대한 희귀한 대본 변형이 보고되었다.[10]
사실상 모든 알려진 ALS 유발 SOD1 돌연변이는 지배적인 방식으로 작용한다; SOD1 유전자의 단일 돌연변이 복제만으로도 병을 일으키기에 충분하다. SOD1 돌연변이가 질병을 일으키는 정확한 분자 메커니즘(또는 메커니즘)은 알려져 있지 않다. 많은 질병 관련 SOD1 돌연변이(G93A 및 A4V 포함)가 효소 활성을 유지하고 Sod1 녹아웃 생쥐는 ALS를 발병하지 않기 때문에([20]그들은 연령에 의존하는 강한 원위 운동 신경증을 보이긴 하지만) 일종의 독성 이득으로 보인다.
ALS는 근육 위축을 유발하는 운동 뉴런의 선택적 상실이 특징인 신경퇴행성 질환이다. DNA 산화 제품 8-OHDG는 산화 DNA 손상의 잘 확립된 표식이다. 8-OHDG는 ALS에 걸린 사람의 척추 운동 신경세포의 미토콘드리아에 축적된다.[22] 돌연변이 SOD1 유전자를 가진 유전자이전 ALS 생쥐에서 8-OHDG는 척추 운동 신경세포의 미토콘드리아 DNA에도 축적된다.[23] 이러한 연구 결과는 SOD1의 변화로 인한 운동 뉴런의 미토콘드리아 DNA의 산화적 손상이 ALS의 식이학에서 중요한 요인이 될 수 있음을 시사한다.
A4V 돌연변이
A4V(Alanine at codon 4 to valine)는 미국 인구에서 가장 흔한 ALS 유발 돌연변이로, SOD1-ALS 환자의 약 50%가 A4V 돌연변이를 지니고 있다.[24][25][26] 미국 가족성 ALS 사례의 약 10%는 SOD1의 이질성 A4V 돌연변이에 의해 발생한다. 이 돌연변이는 아메리카 대륙 밖에서 발견되는 경우는 거의 없다.
최근 A4V 돌연변이가 540세대(약 1만2000년) 전에 발생한 것으로 추정됐다. 돌연변이를 둘러싸고 있는 하플로타형은 A4V 돌연변이가 베링해협을 통해 아메리카 대륙에 도달한 아메리카 원주민의 아시아 조상들에서 발생했음을 시사한다.[27]
A4V 돌연변이는 WT와 같은 돌연변이에 속한다. A4V 돌연변이를 가진 환자들은 가변적인 발병 연령을 보이지만 균일하게 매우 빠른 질병 과정을 보이며, 발병 후 평균 생존 기간은 1.4년이다(다른 우세한 SOD1 돌연변이와 대조적으로 3~5년, H46R과 같은 경우에는 상당히 더 길다). 이 생존은 비 뮤턴트 SOD1이 연결된 ALS보다 상당히 짧다.
H46R 돌연변이
H46R(Codon 46의 히스티딘이 아르기닌으로 변경됨)은 일본 인구의 가장 흔한 ALS 유발 돌연변이로, 일본 SOD1-ALS 환자의 약 40%가 이 돌연변이를 가지고 있다. H46R은 SOD1의 활성 부위에서 구리 결합의 심대한 손실을 유발하며, 따라서 H46R은 효소적으로 비활성화된다. 이 돌연변이의 질병 코스는 매우 길며, 일반적으로 발병부터 사망까지의 시간은 15년 이상이다.[28] 이 돌연변이를 가진 마우스 모델은 G93A와 G37R ALS 생쥐에서 볼 수 있는 고전적인 미토콘드리아 퇴행 병리학을 나타내지 않으며 G93A 생쥐와 달리 주요 미토콘드리아 항산화 효소인 SOD2의 결핍은 그들의 질병 과정에 아무런 영향을 주지 않는다.[28]
G93A 돌연변이
G93A(글리신 93이 알라닌으로 바뀐 것)는 비교적 희귀한 돌연변이지만, 생쥐에서 모형화한 최초의 돌연변이였기 때문에 매우 강도 높게 연구되어 왔다. G93A는 효소 활동을 그대로 두는 사이비 WT 돌연변이다.[26] Jackson Laboratory에서 G93A 마우스를 사용할 수 있기 때문에, 이 모델에서는 잠재적인 약물 표적과 독성 메커니즘에 대한 많은 연구가 수행되었다. 적어도 한 민간연구소(ALS치료개발원)가 이 마우스 모델에서만 대규모 약물검진을 실시하고 있다. 발견이 G93A에 특정한 것인지 SOD1 변이를 유발하는 모든 ALS에 적용되는지는 현재 알려져 있지 않다. G93A 마우스의 특정 병리학적 특성은 특히 미토콘드리아 퇴치와 관련된 과도한 압박 아티팩트에 기인한다고 주장되어 왔다(잭슨 랩에서 일반적으로 사용되는 G93A 마우스는 인간 SOD1 유전자의 20개 이상을 가지고 있다).[29] 적어도 한 연구에서는 병리학의 특정 특징이 G93A에 대해 특이하며 모든 ALS를 유발하는 돌연변이에 대해 추론할 수 없다는 것을 발견했다.[28] 추가 연구는 G93A와 H46R 모델의 병원체 발생이 분명히 구별된다는 것을 보여주었다; 한 모델에서 매우 유익/치유적인 일부 약물과 유전자 개입은 반대이거나 다른 모델에서는 아무런 영향을 미치지 않는다.[30][31][32]
다운증후군
다운증후군(DS)은 21번 염색체의 곱셈에 의해 발생한다. 산화 응력은 DS 관련 병리학에서 중요한 기본 요소로 간주된다. 산화적 스트레스는 21번 염색체에 위치한 SOD1 유전자의 곱셈과 발현 증가 때문인 것으로 보인다. SOD1의 발현이 증가하면 과산화수소의 생산량이 증가해 세포손상이 증가할 가능성이 있다.
침으로 측정된 DS를 가진 사람의 DNA에서 8-OHDG의 수치는 대조군보다 유의하게 높은 것으로 조사되었으며,[33] 대조군에 비해 DS를 가진 사람의 백혈구에서도 8-OHDG 수치가 증가했다.[34] 이러한 결과는 산화 DNA 손상이 DS의 임상적 특징 중 일부를 초래할 수 있음을 시사한다.
상호작용
SOD1은 CCS[35] 및 Bcl-2와 상호작용하는 것으로 나타났다.[36][37][38][39]
참조
- ^ a b c GRCh38: 앙상블 릴리스 89: ENSG00000142168 - 앙상블, 2017년 5월
- ^ a b c GRCm38: 앙상블 릴리스 89: ENSMUSG00000022982 - 앙상블, 2017년 5월
- ^ "Human PubMed Reference:". National Center for Biotechnology Information, U.S. National Library of Medicine.
- ^ "Mouse PubMed Reference:". National Center for Biotechnology Information, U.S. National Library of Medicine.
- ^ Milani P, Gagliardi S, Cova E, Cereda C (2011). "SOD1 Transcriptional and Posttranscriptional Regulation and Its Potential Implications in ALS". Neurology Research International. 2011: 1–9. doi:10.1155/2011/458427. PMC 3096450. PMID 21603028.
- ^ a b c Rosen DR, Siddique T, Patterson D, Figlewicz DA, Sapp P, Hentati A, Donaldson D, Goto J, O'Regan JP, Deng HX (March 1993). "Mutations in Cu/Zn superoxide dismutase gene are associated with familial amyotrophic lateral sclerosis". Nature. 362 (6415): 59–62. Bibcode:1993Natur.362...59R. doi:10.1038/362059a0. PMID 8446170. S2CID 265436.
- ^ a b c Estácio SG, Leal SS, Cristóvão JS, Faísca PF, Gomes CM (February 2015). "Calcium binding to gatekeeper residues flanking aggregation-prone segments underlies non-fibrillar amyloid traits in superoxide dismutase 1 (SOD1)". Biochimica et Biophysica Acta (BBA) - Proteins and Proteomics. 1854 (2): 118–26. doi:10.1016/j.bbapap.2014.11.005. PMID 25463043.
- ^ a b c d Sea K, Sohn SH, Durazo A, Sheng Y, Shaw BF, Cao X, Taylor AB, Whitson LJ, Holloway SP, Hart PJ, Cabelli DE, Gralla EB, Valentine JS (January 2015). "Insights into the role of the unusual disulfide bond in copper-zinc superoxide dismutase". The Journal of Biological Chemistry. 290 (4): 2405–18. doi:10.1074/jbc.M114.588798. PMC 4303690. PMID 25433341.
- ^ a b Khare SD, Caplow M, Dokholyan NV (October 2004). "The rate and equilibrium constants for a multistep reaction sequence for the aggregation of superoxide dismutase in amyotrophic lateral sclerosis". Proceedings of the National Academy of Sciences of the United States of America. 101 (42): 15094–9. Bibcode:2004PNAS..10115094K. doi:10.1073/pnas.0406650101. PMC 524068. PMID 15475574.
- ^ a b "Entrez Gene: SOD1 superoxide dismutase 1, soluble (amyotrophic lateral sclerosis 1 (adult))".
- ^ Murray CJ, Lopez AD (May 1997). "Alternative projections of mortality and disability by cause 1990-2020: Global Burden of Disease Study". Lancet. 349 (9064): 1498–504. doi:10.1016/S0140-6736(96)07492-2. PMID 9167458. S2CID 10556268.
- ^ Braunwald E, Kloner RA (November 1985). "Myocardial reperfusion: a double-edged sword?". The Journal of Clinical Investigation. 76 (5): 1713–9. doi:10.1172/JCI112160. PMC 424191. PMID 4056048.
- ^ Maslov LN, Naryzhnaia NV, Podoksenov IuK, Prokudina ES, Gorbunov AS, Zhang I, Peĭ ZhM (January 2015). "[Reactive oxygen species are triggers and mediators of an increase in cardiac tolerance to impact of ischemia-reperfusion]". Rossiĭskii Fiziologicheskiĭ Zhurnal Imeni I.M. Sechenova / Rossiĭskaia Akademiia Nauk. 101 (1): 3–24. PMID 25868322.
- ^ Liem DA, Honda HM, Zhang J, Woo D, Ping P (December 2007). "Past and present course of cardioprotection against ischemia-reperfusion injury". Journal of Applied Physiology. 103 (6): 2129–36. doi:10.1152/japplphysiol.00383.2007. PMID 17673563.
- ^ Udar N, Atilano SR, Brown DJ, Holguin B, Small K, Nesburn AB, Kenney MC (August 2006). "SOD1: a candidate gene for keratoconus". Investigative Ophthalmology & Visual Science. 47 (8): 3345–51. doi:10.1167/iovs.05-1500. PMID 16877401.
- ^ Muller FL, Lustgarten MS, Jang Y, Richardson A, Van Remmen H (August 2007). "Trends in oxidative aging theories". Free Radical Biology & Medicine. 43 (4): 477–503. doi:10.1016/j.freeradbiomed.2007.03.034. PMID 17640558.
- ^ Cabaña-Muñoz ME, Parmigiani-Izquierdo JM, Bravo-González LA, Kyung HM, Merino JJ (June 2015). "Increased Zn/Glutathione Levels and Higher Superoxide Dismutase-1 Activity as Biomarkers of Oxidative Stress in Women with Long-Term Dental Amalgam Fillings: Correlation between Mercury/Aluminium Levels (in Hair) and Antioxidant Systems in Plasma". PLOS ONE. 10 (6): e0126339. Bibcode:2015PLoSO..1026339C. doi:10.1371/journal.pone.0126339. PMC 4468144. PMID 26076368.
- ^ Conwit RA (December 2006). "Preventing familial ALS: a clinical trial may be feasible but is an efficacy trial warranted?". Journal of the Neurological Sciences. 251 (1–2): 1–2. doi:10.1016/j.jns.2006.07.009. PMID 17070848. S2CID 33105812.
- ^ Al-Chalabi A, Leigh PN (August 2000). "Recent advances in amyotrophic lateral sclerosis". Current Opinion in Neurology. 13 (4): 397–405. doi:10.1097/00019052-200008000-00006. PMID 10970056. S2CID 21577500.
- ^ a b Redler RL, Dokholyan NV (2012-01-01). "The complex molecular biology of amyotrophic lateral sclerosis (ALS)". Molecular Biology of Neurodegenerative Diseases. Progress in Molecular Biology and Translational Science. Vol. 107. pp. 215–62. doi:10.1016/B978-0-12-385883-2.00002-3. ISBN 9780123858832. PMC 3605887. PMID 22482452.
- ^ Gagliardi S, Cova E, Davin A, Guareschi S, Abel K, Alvisi E, Laforenza U, Ghidoni R, Cashman JR, Ceroni M, Cereda C (August 2010). "SOD1 mRNA expression in sporadic amyotrophic lateral sclerosis". Neurobiology of Disease. 39 (2): 198–203. doi:10.1016/j.nbd.2010.04.008. PMID 20399857. S2CID 207065284.
- ^ Kikuchi H, Furuta A, Nishioka K, Suzuki SO, Nakabeppu Y, Iwaki T (April 2002). "Impairment of mitochondrial DNA repair enzymes against accumulation of 8-oxo-guanine in the spinal motor neurons of amyotrophic lateral sclerosis". Acta Neuropathol. 103 (4): 408–14. doi:10.1007/s00401-001-0480-x. PMID 11904761. S2CID 2102463.
- ^ Warita H, Hayashi T, Murakami T, Manabe Y, Abe K (April 2001). "Oxidative damage to mitochondrial DNA in spinal motoneurons of transgenic ALS mice". Brain Res. Mol. Brain Res. 89 (1–2): 147–52. doi:10.1016/S0169-328X(01)00029-8. PMID 11311985.
- ^ Rosen DR, Bowling AC, Patterson D, Usdin TB, Sapp P, Mezey E, McKenna-Yasek D, O'Regan J, Rahmani Z, Ferrante RJ (June 1994). "A frequent ala 4 to val superoxide dismutase-1 mutation is associated with a rapidly progressive familial amyotrophic lateral sclerosis". Human Molecular Genetics. 3 (6): 981–7. doi:10.1093/hmg/3.6.981. PMID 7951249.
- ^ Cudkowicz ME, McKenna-Yasek D, Sapp PE, Chin W, Geller B, Hayden DL, Schoenfeld DA, Hosler BA, Horvitz HR, Brown RH (February 1997). "Epidemiology of mutations in superoxide dismutase in amyotrophic lateral sclerosis". Annals of Neurology. 41 (2): 210–21. doi:10.1002/ana.410410212. PMID 9029070. S2CID 25595595.
- ^ a b Valentine JS, Hart PJ (April 2003). "Misfolded CuZnSOD and amyotrophic lateral sclerosis". Proceedings of the National Academy of Sciences of the United States of America. 100 (7): 3617–22. Bibcode:2003PNAS..100.3617V. doi:10.1073/pnas.0730423100. PMC 152971. PMID 12655070.
- ^ Broom WJ, Johnson DV, Auwarter KE, Iafrate AJ, Russ C, Al-Chalabi A, Sapp PC, McKenna-Yasek D, Andersen PM, Brown RH (January 2008). "SOD1A4V-mediated ALS: absence of a closely linked modifier gene and origination in Asia". Neuroscience Letters. 430 (3): 241–5. doi:10.1016/j.neulet.2007.11.004. PMID 18055113. S2CID 46282375.
- ^ a b c Muller FL, Liu Y, Jernigan A, Borchelt D, Richardson A, Van Remmen H (September 2008). "MnSOD deficiency has a differential effect on disease progression in two different ALS mutant mouse models". Muscle & Nerve. 38 (3): 1173–83. doi:10.1002/mus.21049. PMID 18720509. S2CID 23971601.
- ^ Bergemalm D, Jonsson PA, Graffmo KS, Andersen PM, Brännström T, Rehnmark A, Marklund SL (April 2006). "Overloading of stable and exclusion of unstable human superoxide dismutase-1 variants in mitochondria of murine amyotrophic lateral sclerosis models". The Journal of Neuroscience. 26 (16): 4147–54. doi:10.1523/JNEUROSCI.5461-05.2006. PMC 6673995. PMID 16624935.
- ^ Pan L, Yoshii Y, Otomo A, Ogawa H, Iwasaki Y, Shang HF, Hadano S (2012). "Different human copper-zinc superoxide dismutase mutants, SOD1G93A and SOD1H46R, exert distinct harmful effects on gross phenotype in mice". PLOS ONE. 7 (3): e33409. Bibcode:2012PLoSO...733409P. doi:10.1371/journal.pone.0033409. PMC 3306410. PMID 22438926.
- ^ Bhattacharya A, Bokov A, Muller FL, Jernigan AL, Maslin K, Diaz V, Richardson A, Van Remmen H (August 2012). "Dietary restriction but not rapamycin extends disease onset and survival of the H46R/H48Q mouse model of ALS". Neurobiology of Aging. 33 (8): 1829–32. doi:10.1016/j.neurobiolaging.2011.06.002. PMID 21763036. S2CID 11227242.
- ^ Vargas MR, Johnson DA, Johnson JA (September 2011). "Decreased glutathione accelerates neurological deficit and mitochondrial pathology in familial ALS-linked hSOD1(G93A) mice model". Neurobiology of Disease. 43 (3): 543–51. doi:10.1016/j.nbd.2011.04.025. PMC 3139005. PMID 21600285.
- ^ Komatsu T, Duckyoung Y, Ito A, Kurosawa K, Maehata Y, Kubodera T, Ikeda M, Lee MC (September 2013). "Increased oxidative stress biomarkers in the saliva of Down syndrome patients". Arch. Oral Biol. 58 (9): 1246–50. doi:10.1016/j.archoralbio.2013.03.017. PMID 23714170.
- ^ Pallardó FV, Degan P, d'Ischia M, Kelly FJ, Zatterale A, Calzone R, Castello G, Fernandez-Delgado R, Dunster C, Lloret A, Manini P, Pisanti MA, Vuttariello E, Pagano G (August 2006). "Multiple evidence for an early age pro-oxidant state in Down Syndrome patients". Biogerontology. 7 (4): 211–20. doi:10.1007/s10522-006-9002-5. PMID 16612664. S2CID 13657691.
- ^ Casareno RL, Waggoner D, Gitlin JD (September 1998). "The copper chaperone CCS directly interacts with copper/zinc superoxide dismutase". The Journal of Biological Chemistry. 273 (37): 23625–8. doi:10.1074/jbc.273.37.23625. PMID 9726962.
- ^ Pasinelli P, Belford ME, Lennon N, Bacskai BJ, Hyman BT, Trotti D, Brown RH (July 2004). "Amyotrophic lateral sclerosis-associated SOD1 mutant proteins bind and aggregate with Bcl-2 in spinal cord mitochondria". Neuron. 43 (1): 19–30. doi:10.1016/j.neuron.2004.06.021. PMID 15233914. S2CID 18141051.
- ^ Cova E, Ghiroldi A, Guareschi S, Mazzini G, Gagliardi S, Davin A, Bianchi M, Ceroni M, Cereda C (October 2010). "G93A SOD1 alters cell cycle in a cellular model of Amyotrophic Lateral Sclerosis". Cellular Signalling. 22 (10): 1477–84. doi:10.1016/j.cellsig.2010.05.016. PMID 20561900.
- ^ Cereda C, Cova E, Di Poto C, Galli A, Mazzini G, Corato M, Ceroni M (November 2006). "Effect of nitric oxide on lymphocytes from sporadic amyotrophic lateral sclerosis patients: toxic or protective role?". Neurological Sciences. 27 (5): 312–6. doi:10.1007/s10072-006-0702-z. PMID 17122939. S2CID 25059353.
- ^ Cova E, Cereda C, Galli A, Curti D, Finotti C, Di Poto C, Corato M, Mazzini G, Ceroni M (May 2006). "Modified expression of Bcl-2 and SOD1 proteins in lymphocytes from sporadic ALS patients". Neuroscience Letters. 399 (3): 186–90. doi:10.1016/j.neulet.2006.01.057. PMID 16495003. S2CID 26076370.
추가 읽기
- de Belleroche J, Orrell R, King A (November 1995). "Familial amyotrophic lateral sclerosis/motor neurone disease (FALS): a review of current developments". Journal of Medical Genetics. 32 (11): 841–7. doi:10.1136/jmg.32.11.841. PMC 1051731. PMID 8592323.
- Ceroni M, Curti D, Alimonti D (2002). "Amyotrophic lateral sclerosis and SOD1 gene: an overview". Functional Neurology. 16 (4 Suppl): 171–80. PMID 11996514.
- Zelko IN, Mariani TJ, Folz RJ (August 2002). "Superoxide dismutase multigene family: a comparison of the CuZn-SOD (SOD1), Mn-SOD (SOD2), and EC-SOD (SOD3) gene structures, evolution, and expression". Free Radical Biology & Medicine. 33 (3): 337–49. doi:10.1016/S0891-5849(02)00905-X. PMID 12126755.
- Hadano S (June 2002). "[Causative genes for familial amyotrophic lateral sclerosis]". Seikagaku. The Journal of Japanese Biochemical Society. 74 (6): 483–9. PMID 12138710.
- Noor R, Mittal S, Iqbal J (September 2002). "Superoxide dismutase--applications and relevance to human diseases". Medical Science Monitor. 8 (9): RA210–5. PMID 12218958.
- Potter SZ, Valentine JS (April 2003). "The perplexing role of copper-zinc superoxide dismutase in amyotrophic lateral sclerosis (Lou Gehrig's disease)". Journal of Biological Inorganic Chemistry. 8 (4): 373–80. doi:10.1007/s00775-003-0447-6. PMID 12644909. S2CID 22820101.
- Rotilio G, Aquilano K, Ciriolo MR (2004). "Interplay of Cu,Zn superoxide dismutase and nitric oxide synthase in neurodegenerative processes". IUBMB Life. 55 (10–11): 629–34. doi:10.1080/15216540310001628717. PMID 14711010. S2CID 19518719.
- Jafari-Schluep HF, Khoris J, Mayeux-Portas V, Hand C, Rouleau G, Camu W (January 2004). "[Superoxyde dismutase 1 gene abnormalities in familial amyotrophic lateral sclerosis: phenotype/genotype correlations. The French experience and review of the literature]". Revue Neurologique. 160 (1): 44–50. doi:10.1016/S0035-3787(04)70846-2. PMID 14978393.
- Faraci FM, Didion SP (August 2004). "Vascular protection: superoxide dismutase isoforms in the vessel wall". Arteriosclerosis, Thrombosis, and Vascular Biology. 24 (8): 1367–73. doi:10.1161/01.ATV.0000133604.20182.cf. PMID 15166009.
- Gagliardi S, Ogliari P, Davin A, Corato M, Cova E, Abel K, Cashman JR, Ceroni M, Cereda C (August 2011). "Flavin-containing monooxygenase mRNA levels are up-regulated in als brain areas in SOD1-mutant mice". Neurotoxicity Research. 20 (2): 150–8. doi:10.1007/s12640-010-9230-y. PMID 21082301. S2CID 21856030.
- Battistini S, Ricci C, Lotti EM, Benigni M, Gagliardi S, Zucco R, Bondavalli M, Marcello N, Ceroni M, Cereda C (June 2010). "Severe familial ALS with a novel exon 4 mutation (L106F) in the SOD1 gene". Journal of the Neurological Sciences. 293 (1–2): 112–5. doi:10.1016/j.jns.2010.03.009. PMID 20385392. S2CID 24895265.