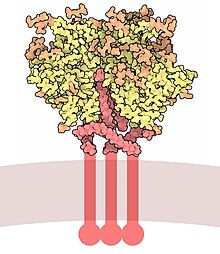
봉투 당단백질 GP120
Envelope glycoprotein GP120| 봉투 당단백질 gp120 | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| 식별자 | |||||||||
| 기호 | GP120 | ||||||||
| Pfam | PF00516 | ||||||||
| 인터프로 | IPR000777 | ||||||||
| SCOP2 | 1gc1 / SCOPe / SUPFAM | ||||||||
| |||||||||
봉투 당단백질 GP120(또는 GP120)은 HIV 봉투 표면에 노출된 당단백질이다.이것은 1988년 하버드 공중보건대학의 Tun-Hou Lee 교수와 Myron "Max" Essex 교수에 의해 발견되었다.[1]그 이름의 120은 120 kDa의 분자량에서 유래한다. Gp120은 특정 세포 표면 수용체에 부착하는 데 중요한 역할을 하기 때문에 바이러스의 세포 진입에 필수적이다.이러한 수용체들은 DC-SIGN,[2] 헤파란 황산염 프로테오글리칸과[3] CD4 수용체,[4] 특히 도우미 T세포와의 특정한 상호작용이다.CD4에 바인딩하면 gp120과 gp41에서 연쇄적으로 일치하는 변화가 시작되어 바이러스 막과 숙주 세포막을 융합하게 된다.CD4에 대한 결합은 반 데르 발스 상호작용과 수소 결합이 있지만 주로 정전이다.[5]
Gp120은 약 2.5 kb 길이, 약 850 아미노산 코드로 HIV 환경 유전자에 의해 코딩된다.[6]주요 환경 산물은 세포 프로테아제 푸린에 의해 말소체성 망막의 gp120(약 480개)과 gp41(약 345개)으로 분해되는 단백질 gp160이다.[7]코어 gp120의 결정 구조는 외부 영역, 종단부에 관한 내부 영역 및 브리징 시트를 가진 조직을 보여준다.Gp120은 transmbrane glycoprotein, gp41과 함께 비동결 결합을 통해 바이러스 막, 즉 봉투에 고정되어 있다.3개의 gp120과 gp41s가 이단자들로 이루어진 트리머에 결합되어 봉투 스파이크를 형성하는데,[8] 이것은 숙주세포에 부착하고 들어가는 것을 매개한다.
변동성
gp120은 CD4+ 세포에 들어가는 HIV-1의 능력에 중요한 역할을 하기 때문에, 그것의 진화는 특히 흥미롭다.중성화 항체가 gp120의 가변 지역에 위치한 현장에 많이 결합되기 때문에 이들 지역의 돌연변이가 강하게 선택될 것이다.[9]HIV-1 그룹 M에서는 근면의 다양성이 매년 1~2%씩 증가하는 것으로 나타났으며, 가변 단위는 아미노산 염기서열 길이의 급격한 변화로 눈에 띈다.gp120 가변성의 증가는 바이러스 복제 수준을 크게 상승시켜 다양한 HIV-1 변종들에 의해 감염된 개인들의 바이러스 적합성의 증가를 나타낸다.[10]추가 연구에서는 잠재적인 N 연계 글리코실레이션 사이트(PNGS)의 변동성 또한 바이러스 적합성을 증가시킨다는 것을 보여주었다.PNGS는 긴 사슬 탄수화물을 gp120의 높은 변동성 영역에 결합하는 것을 허용하기 때문에, 저자들은 환경에서의 PNGS의 수가 항체 중화 민감도를 어느 정도 제공함으로써 바이러스의 적합성에 영향을 미칠 수 있다는 가설을 세운다.gp120에서 확장되는 대형 탄수화물 체인의 존재는 가능한 항체 결합 부위를 모호하게 할 수 있다.[11]
PNGS를 추가하고 제거하는 잠재력의 경계는 각각의 새로운 감염에 따른 바이러스 개체 증가에 의해 순진하게 탐구된다.[12]전송호스트가 gp120에 대한 중화항체반응을 개발한 반면 새로 감염된호주는 바이러스에 대한 면역인식이 부족하다.시퀀스 데이터는 면역학적으로 무감각한 호스트의 초기 바이러스 변종에는 글리코실레이션 부위가 거의 없으며 더 짧은 노출 변수 루프가 있음을 보여준다.이것은 숙주 세포 수용체를 묶는 바이러스 능력을 촉진할 수 있다.[13]숙주 면역 시스템이 gp120에 대한 항체를 개발함에 따라 면역 압력은 특히 노출된 변수 루프인 gp120에서 글리코실화 증가를 선택하는 것처럼 보인다.[14]따라서 높은 글리칸 밀도가 항체를 회피하는 바이러스 능력을 촉진하고 따라서 더 높은 바이러스 적합성을 촉진하기 때문에 gp120에 더 많은 PNGS를 부여하는 환경에서의 삽입은 바이러스에 의해 더 용인될 수 있다.[15]이론적으로 PNGS 밀도가 얼마나 변할 수 있는지를 고려할 때, gp120 접힘 억제 때문에 PNGS 번호에 대한 상한선이 있을 수 있지만, PNGS 수가 현저히 감소하면 항체를 중화시켜 바이러스가 너무 쉽게 검출된다.[12]따라서 낮은 글리칸 밀도와 높은 글리칸 밀도 사이의 안정화 선택 균형이 확립될 가능성이 높다.부피가 큰 글리칸의 수가 적으면 바이러스 복제 효율이 향상되고 노출된 루프의 수가 많을수록 호스트 면역자들의 위장 탈출을 돕는다.[citation needed]
gp120과 중화항체의 관계는 레드퀸 진화역학의 한 예다.바이러스성 봉투 단백질이 숙주 면역 중화 항체의 지속적인 진화 적응에 상대적인 체력을 유지하기 위해서는 지속적인 진화 적응이 필요하며, 그 반대의 경우, 공진 시스템을 형성한다.[15]
백신대상
CD4 수용체 결합은 HIV 감염의 가장 분명한 단계인 만큼, gp120은 HIV 백신 연구의 첫 번째 대상 중 하나였다.그러나 gp120을 대상으로 한 HIV 백신 개발 노력은 gp120의 화학적·구조적 특성 때문에 항체가 결합하기 어려워졌고, gp120도 gp41과의 결합이 느슨해 바이러스 표면에서 쉽게 떨어져 T세포에 포획될 수 있다.gp120에서 CD4까지의 측정 가능한 부착에 관여하는 gp120 글리콥틴의 보존 지역이 확인되었고, 불변 영역의 표적이 광범위하게 중화 항체 IgG1-b12로 달성되었다.[16][17]
사이언스지에 발표된 NIH 연구는 CD4bs 지역 gp120에서 HIV-1 변종의 90%를 중화시키는 3개의 항체가 격리되어 치료 및 백신 전략을 제공할 가능성이 있다고 보고한다.[1] 그러나 gp120의 CDBS 영역을 묶는 대부분의 항체는 HIV를 중화시키지 않으며,[18] IgG1-b12와 같은 드문 항체는 Fab 암의[19] 비대칭이나 그 위치 등의 특이한 성질을 가지고 있다.[20]강력한 중화 항바이러스 성질을 가진 항체를 유도하는 gp120 기반 백신을 설계할 수 없는 한, 획기적인 감염으로 gp120의 CD4 결합 부지를 대상으로 한 높은 수준의 비중화 항체가 고음질 생산으로 이어지는 것은 에이즈로의 질병 진행속도와 관련이 있다는 우려가 있다.[21]
경쟁
단백질 gp120은 HIV를 표적 세포에 처음 결합하는 동안 필요하다.결과적으로, gp120 또는 그 목표물에 바인딩되는 모든 것은 gp120이 세포에 바인딩되는 것을 물리적으로 차단할 수 있다.공동 수용자 CCR5를 결합하는 그러한 대리인 마라비록만이 현재 면허가 있고 임상적으로 사용되고 있다.면역 체계의 중추 분자를 방해하면 항-CD4 단클론 항체 OKT4와 같은 독성 부작용을 일으킬 수 있기 때문에 gp120의 주요 세포 상호작용 파트너인 CD4를 대상으로 하는 어떤 에이전트도 현재 허가되지 않았다.gp120 자체를 대상으로 하는 것은 높은 수준의 변동성과 차폐로 인해 매우 어려운 것으로 입증되었다.포스탐사비르(Poshemsavir, BMS-663068)는 소분자 억제제 BMS-626529의 메틸 인산염 프로드러스트로 바이러스 봉투 gp120에 결합하고 숙주 CD4 수용체에 바이러스 부착을 방해하여 바이러스 유입을 막는다.[22]
에이즈 치매
HIV바이러스 단백질 gp120furin과 조직 플라스미노겐 활성 인자의 inhibiting한 수준으로, mBDNF에 pBDNF 전환할 책임이 효소인 신경 세포의 세포를 유발한다.[23]의 gp120은 죽음 수용체 파스의 upregulation 막을 뉴런 cells,[24]gp120 induc의 세포에 영향을 미친다 caspases처럼mitochondrial-death 단백질 유발합니다.신경세포의 산화스트레스,[25] STAT1을 활성화하고 신경세포에서 인터루킨 IL-6과 IL-8 분비를 유도하는 것도 알려져 있다.[26]
참고 항목
참조
- ^ "Licenses Sold for Research With New Protein". The New York Times. 1989-02-08. Retrieved 16 April 2018.
- ^ Curtis BM, Scharnowske S, Watson AJ (September 1992). "Sequence and expression of a membrane-associated C-type lectin that exhibits CD4-independent binding of human immunodeficiency virus envelope glycoprotein gp120". Proc. Natl. Acad. Sci. U.S.A. 89 (17): 8356–60. Bibcode:1992PNAS...89.8356C. doi:10.1073/pnas.89.17.8356. PMC 49917. PMID 1518869.
- ^ de Witte L, Bobardt M, Chatterji U, Degeest G, David G, Geijtenbeek TB, Gallay P (December 2007). "Syndecan-3 is a dendritic cell-specific attachment receptor for HIV-1". Proc. Natl. Acad. Sci. U.S.A. 104 (49): 19464–9. Bibcode:2007PNAS..10419464D. doi:10.1073/pnas.0703747104. PMC 2148312. PMID 18040049.
- ^ Dalgleish AG, Beverley PC, Clapham PR, Crawford DH, Greaves MF, Weiss RA (1984). "The CD4 (T4) antigen is an essential component of the receptor for the AIDS retrovirus". Nature. 312 (5996): 763–7. Bibcode:1984Natur.312..763D. doi:10.1038/312763a0. PMID 6096719. S2CID 4349809.
- ^ Korkut, A; Hendrickson, WA (2012). "Structural Plasticity and Conformational Transitions of HIV Envelope Glycoprotein gp120". PLOS ONE. 7 (12): e52170. Bibcode:2012PLoSO...752170K. doi:10.1371/journal.pone.0052170. PMC 3531394. PMID 23300605.
- ^ Kuiken, C, Leitner, T, Foley, B, et al.(2008).로스 알라모스 국립 연구소 "HIV 시퀀스 컴펜디엄"
- ^ Hallenberger S, Bosch V, Angliker H, Shaw E, Klenk HD, Garten W (November 1992). "Inhibition of furin-mediated cleavage activation of HIV-1 glycoprotein gp160". Nature. 360 (6402): 358–61. Bibcode:1992Natur.360..358H. doi:10.1038/360358a0. PMID 1360148. S2CID 4306605.
- ^ Zhu P, Winkler H, Chertova E, Taylor KA, Roux KH (November 2008). "Cryoelectron tomography of HIV-1 envelope spikes: further evidence for tripod-like legs". PLOS Pathog. 4 (11): e1000203. doi:10.1371/journal.ppat.1000203. PMC 2577619. PMID 19008954.
- ^ Wyatt R, Kwong PD, Desjardins E, Sweet RW, Robinson J, Hendrickson WA, Sodroski JG (1998). "The antigenic structure of the HIV gp120 envelope gycoprotein". Nature. 393 (6686): 705–711. Bibcode:1998Natur.393..705W. doi:10.1038/31514. PMID 9641684. S2CID 4384110.
- ^ Novitsky V, Lagakos S, Herzig M, Bonney C, Kebaabetswe L, Rossenkhan R, Nkwe D, Margolin L, Musonda R, Moyo S, Woldegabriel E, van Widenfelt E, Makhema J, Essex M (January 2009). "Evolution of proviral gp120 over the first year of HIV-1 subtype C infection". Virology. 383 (1): 47–59. doi:10.1016/j.virol.2008.09.017. PMC 2642736. PMID 18973914.
- ^ Wood N, Bhattacharya T, Keele BF, Giorgi E, Liu M, Gaschen B, Daniels M, Ferrari G, Haynes BF, McMichael A, Shaw GM, Hahn BH, Korber B, Seoighe C (May 2009). "HIV evolution in early infection: selection pressures, patterns of insertion and deletion, and the impact of APOBEC". PLOS Pathog. 5 (5): e1000414. doi:10.1371/journal.ppat.1000414. PMC 2671846. PMID 19424423.
- ^ a b Korber, Bette; Kuiken, Carla; Haigwood, Nancy; Foley, Brian; Blay, Wendy; Gaschen, Brian; Zhang, Ming (2004-12-01). "Tracking global patterns of N-linked glycosylation site variation in highly variable viral glycoproteins: HIV, SIV, and HCV envelopes and influenza hemagglutinin". Glycobiology. 14 (12): 1229–1246. doi:10.1093/glycob/cwh106. ISSN 0959-6658. PMID 15175256.
- ^ Liu Y, Curlin ME, Diem K, Zhao H, Ghosh AK, Zhu H, Woodward AS, Maenza J, Stevens CE, Stekler J, Collier AC, Genowati I, Deng WZioni R, Corey L, Zhu T, Mullins JI (May 2008). "Env length and N-linked glycosylation following transmission of human immunodeficiency virus Type 1 subtype B viruses". Virology. 374 (2): 229–33. doi:10.1016/j.virol.2008.01.029. PMC 2441482. PMID 18314154.
- ^ Pantophlet R, Burton DR (2006). "GP120: target for neutralizing HIV-1 antibodies". Annu. Rev. Immunol. 24: 739–69. doi:10.1146/annurev.immunol.24.021605.090557. PMID 16551265.
- ^ a b Frost SD, Wrin T, Smith DM, Kosakovsky Pond SL, Liu Y, Paxinos E, Chappey C, Galovich J, Beauchaine J, Petropoulos CJ, Little SJ, Richman DD (December 2005). "Neutralizing antibody responses drive the evolution of human immunodeficiency virus type 1 envelope during recent HIV infection". Proc. Natl. Acad. Sci. U.S.A. 102 (51): 18514–9. Bibcode:2005PNAS..10218514F. doi:10.1073/pnas.0504658102. PMC 1310509. PMID 16339909.
- ^ Barbas CF, Björling E, Chiodi F, Dunlop N, Cababa D, Jones TM, Zebedee SL, Persson MA, Nara PL, Norrby E (October 1992). "Recombinant human Fab fragments neutralize human type 1 immunodeficiency virus in vitro". Proc. Natl. Acad. Sci. U.S.A. 89 (19): 9339–43. Bibcode:1992PNAS...89.9339B. doi:10.1073/pnas.89.19.9339. PMC 50122. PMID 1384050.
- ^ Zhou T, Xu L, Dey B, Hessell AJ, Van Ryk D, Xiang SH, Yang X, Zhang MY, Zwick MB, Arthos J, Burton DR, Dimitrov DS, Sodroski J, Wyatt R, Nabel GJ, Kwong PD (2007). "Structural definition of a conserved neutralization epitope on HIV-1 gp120". Nature. 445 (7129): 732–737. Bibcode:2007Natur.445..732Z. doi:10.1038/nature05580. PMC 2584968. PMID 17301785.
- ^ Pantophlet, Ralph; Ollmann Saphire, Erica; Poignard, Pascal; Parren, Paul W. H. I.; Wilson, Ian A.; Burton, Dennis R. (2003-01-01). "Fine mapping of the interaction of neutralizing and nonneutralizing monoclonal antibodies with the CD4 binding site of human immunodeficiency virus type 1 gp120". Journal of Virology. 77 (1): 642–658. doi:10.1128/jvi.77.1.642-658.2003. ISSN 0022-538X. PMC 140633. PMID 12477867.
- ^ Ashish, null; Solanki, Ashish K.; Boone, Christopher D.; Krueger, Joanna K. (2010-01-01). "Global structure of HIV-1 neutralizing antibody IgG1 b12 is asymmetric". Biochemical and Biophysical Research Communications. 391 (1): 947–951. doi:10.1016/j.bbrc.2009.11.170. ISSN 1090-2104. PMID 19995532.
- ^ Solanki, Ashish K.; Rathore, Yogendra S.; Badmalia, Maulik D.; Dhoke, Reema R.; Nath, Samir K.; Nihalani, Deepak; Ashish (2014-12-12). "Global Shape and Ligand Binding Efficiency of the HIV-1-neutralizing Antibodies Differ from Those of Antibodies That Cannot Neutralize HIV-1". The Journal of Biological Chemistry. 289 (50): 34780–34800. doi:10.1074/jbc.M114.563486. ISSN 0021-9258. PMC 4263879. PMID 25331945.
- ^ Chien, Peter C.; Cohen, Sandra; Kleeberger, Cynthia; Giorgi, Janis; Phair, John; Zolla-Pazner, Susan; Hioe, Catarina E. (2002-07-15). "High levels of antibodies to the CD4 binding domain of human immunodeficiency virus type 1 glycoprotein 120 are associated with faster disease progression". The Journal of Infectious Diseases. 186 (2): 205–213. doi:10.1086/341297. ISSN 0022-1899. PMID 12134256.
- ^ aidsinfo.nih.gov/drugs/508/bms-663068/0/professional
- ^ Bachis A, Avdoshina V, Zecca L, Parsadanian M, Mocchetti I (2012). "Human Immunodeficiency Virus Type 1 Alters Brain-Derived Neurotrophic Factor Processing in Neurons". The Journal of Neuroscience. 32 (28): 9477–9484. doi:10.1523/JNEUROSCI.0865-12.2012. PMC 3408006. PMID 22787033.
- ^ Thomas S, Mayer L, Sperber K (2009). "Mitochondria influence Fas expression in gp120-induced apoptosis of neuronal cells". Int. J. Neurosci. 119 (2): 157–65. doi:10.1080/00207450802335537. PMID 19125371. S2CID 25456692.
{{cite journal}}: CS1 maint : 복수이름 : 작성자 목록(링크) - ^ Price TO, Ercal N, Nakaoke R, Banks WA (May 2005). "HIV-1 viral proteins gp120 and Tat induce oxidative stress in brain endothelial cells". Brain Res. 1045 (1–2): 57–63. doi:10.1016/j.brainres.2005.03.031. PMID 15910762. S2CID 7362454.
- ^ Yang B, Akhter S, Chaudhuri A, Kanmogne GD (March 2009). "HIV-1 gp120 induces cytokine expression, leukocyte adhesion, and transmigration across the blood–brain barrier: modulatory effects of STAT1 signaling". Microvasc. Res. 77 (2): 212–9. doi:10.1016/j.mvr.2008.11.003. PMC 3715090. PMID 19103208.
읽고 추가
- 인간면역결핍바이러스 당단백 120
- Vashistha H, Husain M, Kumar D, Singhal PC (2009). "Tubular cell HIV-1 gp120 expression induces caspase 8 activation and apoptosis". Ren Fail. 31 (4): 303–12. doi:10.1080/08860220902780101. PMID 19462280. S2CID 205593494.
외부 링크
- https://web.archive.org/web/20060219135317/http:///www.aidsmap.com/en/docs/4406022B-85D7-4A9B-B700-91336CBB6B18.asp
- http://www.mcld.co.uk/hiv/?q=gp120
- http://www.ebi.ac.uk/interpro/IEntry?ac=IPR000777
- Vashistha, H.; Husain, M.; Kumar, D.; Singhal, P. C. (2009). "Tubular Cell HIV-1 gp120 Expression Induces Caspase 8 Activation and Apoptosis". Renal Failure. 31 (4): 303–312. doi:10.1080/08860220902780101. PMID 19462280. S2CID 205593494.