크리스탈
Crystal결정성 또는 결정성 고체는 구성 요소(원자, 분자 또는 이온 등)가 고차 현미경 구조로 배열되어 모든 방향으로 [1][2]뻗어나가는 결정 격자를 형성하는 고체 재료이다.또한 거시적인 단일 결정은 일반적으로 특정하고 특징적인 방향을 가진 평평한 면으로 구성된 기하학적 형태로 식별할 수 있습니다.결정과 결정 형성에 대한 과학적 연구는 결정학으로 알려져 있다.결정 성장 메커니즘을 통한 결정 형성 과정을 결정화 또는 응고라고 합니다.
크리스탈이라는 단어는 고대 그리스어 "크루스타로스"에서 유래한 것으로, "얼음"과 [3]"암석 결정"을 모두 의미하며, "냉동, 서리"[4][5]라는 뜻의 "크루오스"에서 유래했다.
큰 결정의 예로는 눈송이, 다이아몬드, 식탁용 소금 등이 있다.대부분의 무기 고체는 결정이 아니라 다결정, 즉 많은 미세한 결정들이 하나의 고체로 융합됩니다.다결정체의 예로는 대부분의 금속, 암석, 세라믹, 그리고 얼음이 있다.고체의 세 번째 범주는 비정질 고체로, 원자는 주기적인 구조가 전혀 없다.비정질 고체의 예로는 유리, 왁스, 그리고 많은 플라스틱이 있다.
이름에도 불구하고 납 결정, 결정 유리 및 관련 제품은 결정이 아니라 유리 유형, 즉 비정질 고체입니다.
크리스탈은 종종 크리스털 치료와 같은 의사 과학 실천에 사용되며, 보석과 함께 때로는 위카인의 믿음과 관련된 종교 [6][7][8]운동에서의 주문 작업과 관련이 있습니다.
결정구조(현미경)
"결정"의 과학적 정의는 결정 구조라고 불리는 그 안에 있는 원자들의 미세한 배열에 기초합니다.결정체는 원자들이 주기적인 배열을 이루는 고체이다.(쿼시크리스탈은 예외입니다.아래를 참조해 주세요.
모든 고체가 결정인 것은 아니다.예를 들어, 액체 상태의 물이 얼기 시작하면, 상변화는 작은 얼음 결정들이 융합될 때까지 성장하면서 다결정 구조를 형성하면서 시작된다.얼음의 마지막 블록에서, 각각의 작은 결정들은 원자의 주기적인 배열이 있는 진정한 결정이지만, 주기적인 패턴이 입자 경계에서 깨지기 때문에 전체 다결정에는 원자의 주기적인 배열이 없습니다.대부분의 거시적인 무기 고형물은 거의 모든 금속, 도자기, 얼음, 암석 등을 포함한 다결정이다.유리와 같이 결정성 또는 다결정성이 아닌 고체를 비정질 고체라고 하며, 유리질, 유리질 또는 비결정성이라고도 합니다.이것들은 미시적으로도 주기적인 순서가 없습니다.결정성 고체와 비정질 고형물 사이에는 뚜렷한 차이가 있습니다. 가장 주목할 만한 것은 유리를 형성하는 과정이 융합의 잠열을 방출하는 것이 아니라 결정을 형성하는 것입니다.
결정구조(결정중 원자의 배열)는 단위셀, 특정 공간배열로 하나 이상의 원자를 포함하는 작은 가상상자로 특징지어진다.단위 셀은 3차원 공간에 쌓여 결정을 형성합니다.
결정의 대칭성은 단위 셀이 틈새 없이 완벽하게 쌓여야 하는 요건에 의해 제한됩니다.결정학적 공간 그룹이라고 불리는 [9]219개의 가능한 결정 대칭이 있습니다(230개는 일반적으로 인용되지만, 이것은 키랄 등가물을 별개의 실체로 취급합니다).이것들은 입방정계(오른쪽의 할로겐산염과 같은 입방정계나 직사각형 상자를 형성할 수 있는 곳)나 육각정계(일반 물 얼음과 같은 6각정계)와 같은 7개의 결정계로 분류된다.
수정면 및 모양
크리스탈은 일반적으로 날카로운 각도의 평평한 면으로 구성된 모양에 의해 인식된다.이러한 형상 특성은 결정에는 필요하지 않습니다.결정은 거시적 형태가 아닌 미시적 원자 배열에 의해 과학적으로 정의됩니다.그러나 특징적인 거시적 형상은 종종 존재하며 쉽게 볼 수 있습니다.
Euheedal 크리스탈은 명백하고 잘 형성된 평평한 면을 가진 크리스탈입니다.일반적으로 결정체가 다결정 고체에서 하나의 입자이기 때문에, 사면체 결정체는 그렇지 않습니다.
사면체 결정의 평평한 면(페이스라고도 함)은 결정의 기초 원자 배열에 상대적인 특정한 방식으로 방향을 잡습니다: 그것들은 상대적으로 낮은 밀러 [10]지수의 평면입니다.이는 일부 표면 방향이 다른 표면 방향보다 안정적이기 때문에 발생합니다(낮은 표면 에너지).결정이 성장함에 따라, 새로운 원자는 표면의 거칠고 덜 안정된 부분에는 쉽게 부착되지만, 평평하고 안정적인 표면에는 덜 쉽게 부착됩니다.따라서, 평평한 표면은 전체 결정 표면이 이러한 평면 표면으로 구성될 때까지 더 크고 매끄럽게 자라는 경향이 있습니다.(오른쪽 그림을 참조).
결정학 과학에서 가장 오래된 기술 중 하나는 결정면의 3차원 방향을 측정하고, 그것들을 기초적인 결정 대칭을 추론하기 위해 사용하는 것으로 구성됩니다.
결정의 결정학적 형태는 결정의 대칭 중 하나에 의해 연관된 결정의 가능한 면들의 집합입니다.예를 들어, 갈레나의 결정은 종종 입방체의 형태를 취하며, 입방체의 여섯 면은 등각 결정계의 대칭 중 하나를 보여주는 결정학적 형태에 속합니다.갈레나는 또한 때때로 8면체로 결정되며, 8면체의 8면은 등각계의 다른 대칭을 반영하는 또 다른 결정학적 형태에 속합니다.결정학적 형태는 그 면 중 하나의 밀러 지수를 괄호 안에 배치함으로써 기술된다.예를 들어 팔면체 형태는 {11}이라고 쓰고, 그 형태의 다른 면은 결정의 대칭에 의해 암시된다.
양식은 닫힐 수 있습니다. 즉, 양식이 공간 볼륨을 완전히 둘러싸거나 열 수 없으므로 열 수 없습니다.정육면체와 정팔면체는 닫힌 형태의 예이다.등각계의 모든 형태는 닫혀 있고, 단사정계와 삼사정계의 모든 형태는 열려 있습니다.결정의 면은 모두 같은 닫힌 형태일 수도 있고 여러 열린 [11]형태 또는 닫힌 형태의 조합일 수도 있습니다.
결정의 습성은 눈에 보이는 외형이다.이는 결정 구조(가능한 면의 방향을 제한함), 특정 결정 화학 및 결합(일부 면의 유형이 다른 면보다 유리할 수 있음), 결정이 형성된 조건에 의해 결정됩니다.
자연발생

암석
부피와 무게로 볼 때, 지구에서 가장 많은 양의 결정체들은 단단한 암반의 일부입니다.바위에서 발견되는 결정의 크기는 일반적으로 밀리미터의 몇 분의 1에서 몇 센티미터에 이르지만, 예외적으로 큰 결정들이 가끔 발견되기도 한다.1999년 현재[update], 세계에서 가장 큰 자연 발생 결정체는 마다가스카르 말라키알리나에서 온 길이 18m, 지름 3.5m의 베릴 결정이며 무게는 380,000kg(840,000파운드)[12]이다.
어떤 결정들은 마그마와 변성 작용에 의해 형성되어 많은 양의 결정암 덩어리에서 비롯되었다.화성암의 대부분은 녹은 마그마로 형성되며 결정화의 정도는 주로 그들이 응고된 조건에 따라 달라집니다.화강암과 같은 암석들은 매우 천천히, 그리고 엄청난 압력으로 완전히 결정화 되었다; 그러나 많은 종류의 용암이 표면에 쏟아지고 매우 빠르게 냉각되었다. 그리고 이 후자 그룹에서는 소량의 비정질이나 유리질 물질이 흔하다.대리석, 운모암, 석영암과 같은 다른 결정질 암석들은 재결정화된다.이것은 그들이 처음에는 석회암, 셰일, 사암과 같은 파편암이었고 녹은 상태나 완전히 용해된 적은 없었지만, 변성 작용의 고온과 압력 조건이 그들의 원래 구조를 지우고 고체 상태에서 [13]재결정화를 유도함으로써 그들에게 작용했다는 것을 의미한다.
다른 암석 결정들은 액체, 보통 물로부터의 침전으로부터 형성되어 드러스 또는 석영정맥을 형성한다.할로겐산염, 석고 및 일부 석고와 같은 증발물은 대부분 건조한 기후에서의 증발 때문에 수용액에서 퇴적되었습니다.
얼음
눈, 해빙, 빙하 형태의 수성 얼음은 지구와 다른 [14]행성에서 흔히 볼 수 있는 결정/다결정 구조입니다.눈송이 하나가 하나의 결정 또는 [15]결정의 집합인 반면, 얼음 입방체는 [16]다결정이다.
유기 결정
많은 생물들은 결정을 만들 수 있는데, 예를 들어 대부분의 연체동물의 경우 석회암과 아라고나이트, 척추동물의 경우 히드록실라파타이트가 그것이다.
다형성과 동소성
같은 원자의 그룹은 종종 여러 가지 다른 방법으로 굳어질 수 있다.다형성은 고체가 하나 이상의 결정 형태로 존재할 수 있는 능력이다.예를 들어, 물 얼음은 일반적으로 육각형 형태의 얼음h I에서 발견되지만 입방체 얼음c I, 마름모꼴 얼음 II 및 많은 다른 형태로도 존재할 수 있습니다.다른 다형은 보통 다른 위상이라고 불립니다.
또한 동일한 원자가 비결정상을 형성할 수 있습니다.예를 들어, 물은 비정질 얼음을 형성할 수 있는 반면, SiO는2 융합된 실리카와 석영(결정)을 형성할 수 있다.마찬가지로, 만약 어떤 물질이 결정을 형성할 수 있다면, 그것은 또한 다결정체를 형성할 수 있다.
순수한 화학 원소의 경우 다형성을 동소성이라고 합니다.예를 들어, 다이아몬드와 흑연은 탄소의 두 가지 결정 형태인 반면, 비정질 탄소는 비결정 형태이다.다형류는 같은 원자를 가지고 있음에도 불구하고 성질이 크게 다를 수 있다.예를 들어, 다이아몬드는 알려진 가장 단단한 물질 중 하나이고, 흑연은 매우 부드러워서 윤활제로 사용된다.
폴리아모르피즘은 동일한 원자가 하나 이상의 비정질 고체 형태로 존재할 수 있는 유사한 현상이다.
결정화
결정화는 유체 또는 유체에 용해된 물질로부터 결정 구조를 형성하는 과정이다.(더 드물게 가스로부터 직접 결정이 퇴적될 수 있습니다. 박막 퇴적 및 에피택시를 참조하십시오.)
결정화는 복잡하고 광범위하게 연구된 분야입니다. 조건에 따라 단일 유체가 여러 가지 가능한 형태로 응고될 수 있기 때문입니다.다양한 상, 화학량계, 불순물, 결함 및 습관으로 단일 결정을 형성할 수 있습니다.또는 입자의 크기, 배열, 방향 및 위상에 대해 다양한 가능성을 가진 다결정체를 형성할 수 있습니다.고체의 최종 형태는 유체의 화학성분, 주변 압력, 온도 및 이러한 모든 매개변수가 변화하는 속도와 같은 유체가 응고되는 조건에 따라 결정됩니다.
큰 단결정(부울이라고 함)을 만들기 위한 특정 산업 기술로는 Czochralski 공정과 Bridgman 기술이 있습니다.수열합성, 승화 또는 단순한 용제 기반의 결정화 등 물질의 물리적 특성에 따라 덜 이국적인 결정화 방법을 사용할 수 있다.
지질학적 과정에 의해 큰 단결정체가 생성될 수 있다.예를 들어 멕시코 [17]나이카의 크리스탈 동굴에서 10m가 넘는 셀레나이트 결정이 발견됩니다.지질 결정 형성에 대한 자세한 내용은 위의 항목을 참조하십시오.
결정체는 생물학적 과정을 통해서도 형성될 수 있다.반대로, 일부 생물들은 부동 단백질과 같이 결정화가 일어나는 것을 막기 위한 특별한 기술을 가지고 있다.
결함, 불순물, 트윈닝
이상적인 결정체는 모든 원자를 완벽하고 정확하게 반복되는 [18]패턴으로 가지고 있다.그러나 실제로는 대부분의 결정성 재료는 결정학적 결함, 즉 결정의 패턴이 중단되는 부분을 가지고 있습니다.이러한 결점의 유형과 구조는 재료의 특성에 지대한 영향을 미칠 수 있습니다.
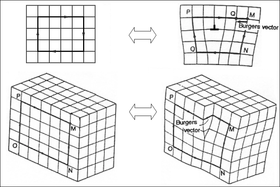
결정학적 결함의 몇 가지 예로는 공실 결함(원자가 들어맞아야 할 빈 공간), 간극 결함(원자가 맞지 않는 곳에 압착된 추가 원자) 및 전위(오른쪽 그림 참조)가 있습니다.전위는 물질의 기계적 강도를 결정하는 데 도움이 되기 때문에 재료 과학에서 특히 중요합니다.
결정학적 결함의 또 다른 흔한 유형은 불순물인데, 이는 "잘못된" 유형의 원자가 결정 안에 존재한다는 것을 의미합니다.예를 들어, 다이아몬드의 완벽한 결정체에는 탄소 원자만 포함되어 있지만, 실제 결정체에는 몇 개의 붕소 원자도 포함되어 있을 수 있습니다.이 붕소 불순물들은 다이아몬드의 색을 약간 파란색으로 바꾼다.마찬가지로, 루비와 사파이어의 유일한 차이점은 코런덤 결정 안에 존재하는 불순물의 종류이다.
반도체에서, 도판트라고 불리는 특별한 종류의 불순물은 결정의 전기적 특성을 급격하게 변화시킨다.트랜지스터와 같은 반도체 소자는 주로 다른 반도체 도판트를 특정 패턴으로 다른 장소에 배치함으로써 가능하다.
트윈닝은 결정학적 결함과 입자 경계 사이의 현상이다.입자의 경계와 같이, 쌍둥이 경계는 양쪽에 다른 결정 방향을 가지고 있습니다.그러나 입자의 경계와 달리 방향은 랜덤이 아니라 특정 거울상 방식으로 관련되어 있습니다.
모사이시티는 결정면 방향의 확산이다.모자이크 결정은 서로 다소 어긋난 작은 결정 단위로 구성됩니다.
화학 결합
일반적으로 고체는 금속결합, 이온결합, 공유결합, 판데르발스결합 등 다양한 형태의 화학결합에 의해 결합될 수 있다.이것들 중 반드시 결정성이나 비결정성일 필요는 없다.다만, 다음과 같은 일반적인 동향이 있습니다.
금속은 비정질 금속이나 단결정 금속과 같은 예외는 있지만 거의 항상 다결정입니다.후자는 인공적으로 성장한다.(현미경적으로 작은 금속 조각은 자연적으로 하나의 결정으로 형성될 수 있지만, 일반적으로 큰 조각은 형성되지 않는다.)이온 화합물 재료는 보통 결정성 또는 다결정성입니다.실제로 큰 소금 결정은 용해된 유체의 응고 또는 용액에서 결정화함으로써 생성될 수 있습니다.공유 결합 고체(공유 결합형 네트워크 고체라고도 함)도 매우 일반적이며, 다이아몬드 및 석영 등이 대표적인 예입니다.약한 반데르발스 힘은 또한 흑연의 층간 결합뿐만 아니라 결정성 분자 고체와 같은 특정 결정을 함께 유지하는 데 도움을 줍니다.고분자 물질은 일반적으로 결정 영역을 형성하지만, 분자의 길이는 일반적으로 완전한 결정화를 방해하며, 때로는 완전히 비정질인 폴리머도 있습니다.
준결정

준결정체는 순서는 있지만 엄밀하게 주기적이지는 않은 원자 배열로 구성되어 있다.X선 회절에서 이산 패턴을 표시하는 것과 같은 일반 결정과 많은 공통 속성을 가지고 있으며, 매끄럽고 평평한 면으로 모양을 형성하는 능력도 가지고 있습니다.
준결정체는 일반적인 주기 결정으로는 불가능한 5배 대칭을 보여주는 능력으로 가장 유명하다.
국제결정학연합(International Union of Crystalography)은 "결정(crystal)"이라는 용어를 일반 주기 결정과 준결정(quisicrystals)"[19]을 모두 포함하도록 재정의했다.
1982년에 처음 발견된 준결정체는 실제로 매우 드물다.2004년에 [20]알려진 약 400,000개의 주기적 결정과 비교하여 준결정체를 형성하는 고체는 100개 정도만 알려져 있다.2011년 노벨 화학상은 준결정체의 [21]발견으로 댄 셰히트만에게 수여되었다.
이방성의 특수 특성
크리스탈은 보통 유리와 다결정에는 없는 특정한 전기적, 광학적, 기계적 특성을 가질 수 있습니다.이러한 특성은 결정의 이방성, 즉 원자 배열에서의 회전 대칭의 결여와 관련이 있습니다.이러한 특성 중 하나는 압전 효과로, 결정 전체에 걸쳐 전압이 수축하거나 늘어나게 할 수 있습니다.또 다른 하나는 이중 굴절인데, 이것은 결정을 통해 볼 때 이중 이미지가 나타난다.또한 전기전도율, 전기유전율, 영률을 포함한 결정의 다양한 특성은 결정의 다른 방향으로 다를 수 있습니다.예를 들어 흑연결정은 시트 더미로 구성되며 각각의 시트는 기계적으로 매우 강하지만 시트는 서로 느슨하게 결합되어 있습니다.따라서 재료의 기계적 강도는 응력 방향에 따라 상당히 다릅니다.
모든 크리스탈이 이 모든 성질을 가진 것은 아닙니다.반대로, 이러한 성질은 결정에만 국한된 것은 아닙니다.예를 들어, 작업이나 스트레스에 의해 이방성이 된 안경이나 다결정에서 나타날 수 있습니다.
결정학
결정학은 결정의 결정 구조(즉, 원자 배열)를 측정하는 과학이다.널리 사용되는 결정학 기법 중 하나는 X선 회절이다.다수의 알려진 결정 구조가 결정학 데이터베이스에 저장됩니다.
이미지 갤러리
지구 궤도에서 자란 인슐린 결정들
호어 프로스트:얼음 결정의 일종(약 5cm 거리에서 촬영한 사진).
갈륨은 큰 결정을 쉽게 형성하는 금속이다.
「 」를 참조해 주세요.
레퍼런스
- ^ Stephen Lower. "Chem1 online textbook—States of matter". Retrieved 2016-09-19.
- ^ Ashcroft and Mermin (1976). Solid state physics.
{{cite book}}: CS1 maint: 작성자 파라미터 사용(링크) - ^ 페르세우스 디지털 라이브러리의 그리스 영어 어휘집, 헨리 조지 리델, 로버트 스콧
- ^ 페르세우스 디지털 라이브러리의 그리스 영어 어휘집, 헨리 조지 리델, 로버트 스콧
- ^ "The American Heritage Dictionary of the English Language". Kreus. 2000.
{{cite journal}}:Cite 저널 요구 사항journal=(도움말)CS1 유지 보수: 기타 (링크) - ^ 리갈, 브라이언(2009).유사과학: 비판적 백과사전.그린우드 51페이지ISBN 978-0-313-35507-3
- ^ Patti Wigington (31 August 2016). "Using Crystals and Gemstones in Magic". About.com. Retrieved 14 November 2016.
- ^ "The Magic of Crystals and Gemstones". WitchesLore. 14 December 2011. Retrieved 14 November 2016.
- ^ Welberry, T. R, ed. (2021), International Tables for Crystallography, vol. A, Chester, England: International Union of Crystallography, doi:10.1107/97809553602060000001, ISBN 978-1-119-95235-0, S2CID 146060934
- ^ 금속 산화물의 표면 과학, 빅터 E.에 의해.헨리치, P. A. 콕스, 28페이지, 구글 북스 링크
- ^ Sinkankas, John (1964). Mineralogy for amateurs. Princeton, N.J.: Van Nostrand. pp. 134–138. ISBN 0442276249.
- ^ G. 크레시와 I.F.머서, (1999) 크리스탈, 런던, 자연사 박물관, 58페이지
- ^ 앞의 문장 중 하나 이상에는 현재 퍼블릭 도메인에 있는 출판물의 텍스트가 포함되어 있습니다.
- ^ 후루카와 요시노리(얼음), 마티 레페란타(바다 얼음), D.P. 도발(글레이시어), 기타 Vijay P. 기사.싱, 프라탑 싱, 우메쉬 K.Haritashya, ed., 눈, 얼음 및 빙하 백과사전(Dordrecht, NE: Springer Science & Business Media, 2011).ISBN 904812641X, 9789048126415
- ^ Libbrecht, Kenneth; Wing, Rachel (2015-09-01). The Snowflake: Winter's Frozen Artistry. Voyageur Press. ISBN 9781627887335.
- ^ Hjorth-Hansen, E. (2017-10-19). Snow Engineering 2000: Recent Advances and Developments. Routledge. ISBN 9781351416238.
- ^ "Cave of Crystal Giants — National Geographic Magazine". nationalgeographic.com.
- ^ Britain), Science Research Council (Great (1972). Report of the Council. H.M. Stationery Office.
- ^ International Union of Crystallography (1992). "Report of the Executive Committee for 1991". Acta Crystallogr. A. 48 (6): 922–946. doi:10.1107/S0108767392008328. PMC 1826680.
- ^ Steurer W. (2004). "Twenty years of structure research on quasicrystals. Part I. Pentagonal, octagonal, decagonal and dodecagonal quasicrystals". Z. Kristallogr. 219 (7–2004): 391–446. Bibcode:2004ZK....219..391S. doi:10.1524/zkri.219.7.391.35643.
- ^ "The Nobel Prize in Chemistry 2011". Nobelprize.org. Retrieved 2011-12-29.
추가 정보
- Howard, J. Michael; Darcy Howard (Illustrator) (1998). "Introduction to Crystallography and Mineral Crystal Systems". Bob's Rock Shop. Archived from the original on 2006-08-26. Retrieved 2008-04-20.
- Krassmann, Thomas (2005–2008). "The Giant Crystal Project". Krassmann. Archived from the original on 2008-04-26. Retrieved 2008-04-20.
- "Teaching Pamphlets". Commission on Crystallographic Teaching. 2007. Archived from the original on 2008-04-17. Retrieved 2008-04-20.
- "Crystal Lattice Structures:Index by Space Group". 2004. Retrieved 2016-12-03.
- "Crystallography". Spanish National Research Council, Department of Crystallography. 2010. Retrieved 2010-01-08.