다원형성
Polyamorphism
다형성(polyamorphism)은 물질이 몇 가지 다른 무형의 변형에서 존재할 수 있는 능력이다. 그것은 결정 물질의 다형성과 유사하다. 많은 무정형 물질은 서로 다른 무정형 특성(예: 폴리머)을 가지고 존재할 수 있다. 그러나 폴리아모르퍼시즘은 그들 사이의 명확하고 불연속적인 (일차적인) 위상 전환이 있는 두 개의 뚜렷한 비정형 상태를 필요로 한다. 그러한 전환이 두 개의 안정적인 액체 상태 사이에 발생할 때, 다형질 전환은 액체-액체 위상 전환이라고도 할 수 있다.[3]
개요
비정형 물질은 장거리 주기적 원자 순서를 나타내지 않지만 원자간 길이 척도에서는 여전히 유의하고 다양한 국소 구조가 존재한다(액체와 안경 구조 참조). 다른 국소 구조는 밀도와 같은 다른 물리적 성질을 가진 동일한 화학적 구성의 비정형 단계를 생성할 수 있다. 몇 가지 경우에 동일한 물질의 서로 다른 두 밀도 무정형 상태 사이에서 날카로운 전환이 관찰되었다. 무정형 얼음은 중요한 예시 중 하나이다(아래 예시 참조).[4] 이러한 전환들 중 몇 가지(물 포함)는 두 번째 임계 지점에서 끝날 것으로 예상된다.
액체-액체 전환
폴리아모르퍼시즘은 모든 무정형 상태, 즉 안경, 기타 무정형 고체, 과냉각 액체, 일반 액체 또는 유체에 적용될 수 있다. 그러나 액체-액체 전환은 액체 상태(상단 다이어그램의 빨간색 선, 오른쪽 상단)에서만 발생하는 전환이다. 이 글에서 액체-액체 전환은 동일한 화학 물질의 두 액체 사이의 전환으로 정의된다. 다른 곳에서는 액체-액체 전환이라는 용어는 다른 화학적 성분의 액체 혼합물 사이의 더 일반적인 전환을 언급할 수도 있다.
대부분의 안경과 비정형 고형물과 달리 안정된 액체 상태는 열역학적으로 안정된 평형상태다. 따라서 안정적인 액체(또는 유체) 상태의 새로운 액체-액체 또는 유체-유체 전환은 비균형 상태의 비균형적, 비에너지적 특성에 의해 논쟁이 복잡해지는 비정형 고형질의 전환보다 더 쉽게 분석된다.
라포포트 이론
액체-액체 전환은 일부 액체 금속의 고압 용해 곡선 최대치를 설명하기 위해 1967년 라포포트가 원래 고려했다.[5] 라포포트의 이론은 폴리아모르픽 시스템에서 최대 용해 곡선의 존재를 요구한다.
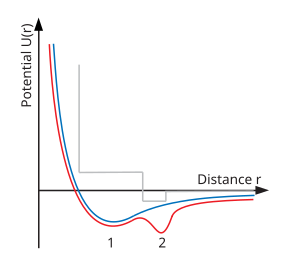
이중 웰 포텐셜
다원형성에 대한 한 가지 물리적 설명은 이중 웰 원자 쌍 전위의 존재에 관한 것이다(오른쪽 아래 도표 참조). 일반적인 액체-가스 임계점은 원자간 쌍 전위가 최소치를 포함할 때 나타나는 것으로 잘 알려져 있다. 낮은 에너지(온도)에서는 이 최소의 응축 상태에 갇힌 입자가 액체 상태로 응축된다. 그러나 높은 온도에서 이 입자들은 우물을 빠져나갈 수 있고 액체와 가스 사이의 날카로운 정의는 사라진다. 분자 모델링은 두 번째 유정을 추가하면 두 번째 임계점을 가진 서로 다른 액체(또는 유체) 간에 추가적인 전환이 발생한다는 것을 보여주었다.[2]
폴리아모르퍼리즘의 예
폴리아모르퍼시즘은 실리콘, 액체 인, 트리페닐 인산염, 만니톨, 그리고 일부 다른 분자 네트워크 형성 물질에서 실험적으로 관찰되거나 이론적으로 제안되어 왔다.[6]
물과 구조 유사점
다형성증의 가장 유명한 경우는 비정형 얼음이다. 기존의 육각형 얼음 결정을 액체 질소 온도(77K)에서 약 1.6 GPA로 가압하면 고밀도 아모르퍼스 얼음으로 전환된다. 압력을 해제하면 이 위상은 안정적이며 77K와 1bar에서 1.17g/cm의3 밀도를 가진다. 그 결과 주변 압력에서 127 K로 온난화되면 이 단계가 저밀도 아모르퍼스 얼음(1bar에서 0.94 g/cm3)으로 변한다.[7] 그러나 고밀도 아모르퍼스 얼음을 저압이 아니라 1.6 GPA 압축을 유지한 상태에서 165K까지 데운 다음 77K로 다시 식히면 1bar에서 1.25g/cm의3 밀도가 훨씬 높은 또 다른 아모르퍼스 얼음이 생성된다. 모든 비정형 형태는 진동 격자 스펙트럼과 분자간 거리를 매우 다르게 가진다.[8][9] 액체 실리콘에서는 고압으로 냉각할 때 이와 유사한 갑작스러운 액체-아모르퍼스 위상 전환이 예측된다.[10] 이 관찰은 분자역학 컴퓨터 시뮬레이션에 기초하며, 사면체 무형 탄소, 실리콘, 게르마늄이 구조적으로 물과 유사한 것으로 알려져 있기 때문에 직관적으로 예상할 수 있다.[11]
산화액 및 안경
이트리아 알루미나 녹이는 또 다른 시스템은 폴리아모르페르시즘을 나타낸다고 한다. 과냉각 액체의 액체-액체 위상 전환에 대한 관찰이 보고되었다.[12] 비록 이것은 문헌상으로는 논쟁의 여지가 있다.[13] 다형성증은 또한 이트리아 알루미나 안경에서도 보고되었다. 이트리아-알루미나는 약 1900 °C에서 약 400 °C/s의 속도로 응고된 용해로, 두 번째 공존 단계가 포함된 안경을 형성할 수 있다. 이는 특정 Y/Al 비율(약 20–40 mol% YO23)에서 발생한다. 두 단계는 평균 구성은 같지만 밀도, 분자 구조, 경도는 다르다.[14] 그러나 2단계는 유리인지 결정체인지에 대해서도 논의되고 있다.[15] 이산화규소나 이산화 게르마늄을 냉각할 때 밀도의 지속적인 변화가 관찰되었다. 연속적인 밀도 변화는 첫 번째 순서 전환을 구성하지 않지만, 그것들은 근본적인 갑작스러운 변화를 나타낼 수 있다.
유기물
또한 210K~226K 사이의 온도에서 액체 트리페닐 인산염, 120K~140K 사이의 온도에서 n-부탄올과 같은 유기 화합물에서도 폴리아모르피즘이 관찰되었다.[20][21]
다형성 역시 제약과학에서 중요한 영역이다. 약물의 비정형 형태는 전형적으로 수성 용해성이 훨씬 더 우수하지만(아날로그 결정 형태와 비교), 비정형 약물의 실제 국소 구조는 비정형 단계를 형성하는 데 사용되는 방법에 따라 달라질 수 있다. 만니톨은 폴리아모르페르시즘을 특징으로 하는 최초의 의약품이다.[22] 정규 무정기 외에도 상온과 압력에서 제2 무정기를 준비할 수 있다. 이 새로운 위상은 에너지, 밀도, 유리 전환 온도가 상당히 낮다. 만니톨은 의약품 제형에 널리 사용되기 때문에, 만니톨 폴리아모르피즘은 타블렛의 재산과 행동을 기술할 수 있는 강력한 도구를 제공한다. [23]
참고 항목
참조
- ^ Mishima, O.; Mishima, Osamu (1998). "The relationship between liquid, supercooled and glassy water". Nature. 396 (6709): 329. Bibcode:1998Natur.396..329M. doi:10.1038/24540. S2CID 4328846.
- ^ a b Franzese, G.; Malescio, G; Skibinsky, A; Buldyrev, SV; et al. (2001). "Generic mechanism for generating a liquid–liquid phase transition". Nature. 409 (6821): 692–5. arXiv:cond-mat/0102029. Bibcode:2001Natur.409..692F. doi:10.1038/35055514. PMID 11217853. S2CID 4419993.
- ^ Hancock, BC; Shalaev, EY; Shamblin, SL (2002). "Polyamorphism: a pharmaceutical science perspective". The Journal of Pharmacy and Pharmacology. 54 (8): 1151–2. doi:10.1211/002235702320266343. PMID 12195833. S2CID 20047984.
- ^ Mishima, O.; Calvert, L. D.; Whalley, E. (1985). "An apparently 1st-order transition between two amorphous phases of ice induced by pressure". Nature. 314 (6006): 76. Bibcode:1985Natur.314...76M. doi:10.1038/314076a0. S2CID 4241205.
- ^ Rapoport, E. (1967). "Model for melting curve maxima at high pressure". J. Chem. Phys. 46 (2891): 2891–2895. Bibcode:1967JChPh..46.2891R. doi:10.1063/1.1841150.
- ^ "Anomalous properties of water". Retrieved 30 August 2015.
- ^ Schober, H; Koza, M.; Tölle, A.; Fujara, F.; et al. (1997). "Amorphous polymorphism in ice investigated by inelastic neutron scattering". Physica B: Condensed Matter. 241–243: 897–902. Bibcode:1997PhyB..241..897S. doi:10.1016/S0921-4526(97)00749-7.
- ^ Loerting, Thomas; Salzmann, Christoph; Kohl, Ingrid; Mayer, Erwin; et al. (2001). "A second distinct structural "state" of high-density amorphous ice at 77 K and 1 bar". Physical Chemistry Chemical Physics. 3 (24): 5355. Bibcode:2001PCCP....3.5355L. doi:10.1039/b108676f. S2CID 59485355.
- ^ K. J. Rao (2002). Structural chemistry of glasses. Elsevier. p. 120. ISBN 978-0-08-043958-7.
- ^ Morishita, T. (2004). "High Density Amorphous Form and Polyamorphic Transformations of Silicon". Phys. Rev. Lett. 93 (55503): 55503. Bibcode:2004PhRvL..93e5503M. doi:10.1103/PhysRevLett.93.055503. PMID 15323706.
- ^ Benmore, C. J.; Hart, R.; Mei, Q.; Price, D.; et al. (2004). "Intermediate range chemical ordering in amorphous and liquid water, Si, and Ge". Phys. Rev. B. 72 (132201): 132201. Bibcode:2005PhRvB..72m2201B. doi:10.1103/PhysRevB.72.132201.
- ^ Greaves, G; Wilding, MC; Fearn, S; Langstaff, D; Kargl, F; Cox, S; Van, QV; Majérus, O; et al. (2008). "Detection of First-Order Liquid/Liquid Phase Transitions in Yttrium Oxide-Aluminum Oxide Melts" (PDF). Science. 322 (5901): 566–70. Bibcode:2008Sci...322..566G. doi:10.1126/science.1160766. PMID 18948535. S2CID 10368768.
- ^ Barnes, AC; Skinner, LB; Salmon, PS; Bytchkov, A; et al. (2009). "Liquid/Liquid Phase Transitions in Yttria-Alumina" (PDF). Physical Review Letters. 103 (22): 225702. Bibcode:2009PhRvL.103v5702B. doi:10.1103/PhysRevLett.103.225702. PMID 20366109.
- ^ Aasland, S.; McMillan, P. F. (1994). "Density-driven liquid–liquid phase separation in the system AI2O3–Y2O3". Nature. 369 (6482): 633. Bibcode:1994Natur.369..633A. doi:10.1038/369633a0. S2CID 4325330.
- ^ Skinner, LB; Barnes, AC; Salmon, PS; Crichton, WA (2008). "Phase separation, crystallization and polyamorphism in the Y2O3-Al2O3 system". J. Phys.: Condens. Matter. 20 (20): 205103. Bibcode:2008JPCM...20t5103S. doi:10.1088/0953-8984/20/20/205103. PMID 21694284.
- ^ Kurita, R. (2004-10-29). "Critical-Like Phenomena Associated with Liquid-Liquid Transition in a Molecular Liquid". Science. 306 (5697): 845–848. Bibcode:2004Sci...306..845K. doi:10.1126/science.1103073. ISSN 0036-8075. PMID 15514150. S2CID 29634533.
- ^ Ha, Alice; Cohen, Itai; Zhao, Xiaolin; Lee, Michelle; et al. (1996). "Supercooled Liquids and Polyamorphism†". The Journal of Physical Chemistry. 100: 1–4. doi:10.1021/jp9530820.
- ^ Poole, P. H. (1997). "Polymorphic Phase Transitions in Liquids and Glasses". Science. 275 (5298): 322–323. doi:10.1126/science.275.5298.322. S2CID 95734427.
- ^ Paolo M. Ossi (2006). Disordered materials: an introduction. Springer. p. 65. ISBN 978-3-540-29609-6.
- ^ Kurita, Rei; Tanaka, Hajime (2005-07-13). "On the abundance and general nature of the liquid–liquid phase transition in molecular systems". Journal of Physics: Condensed Matter. 17 (27): L293–L302. doi:10.1088/0953-8984/17/27/L01. ISSN 0953-8984.
- ^ Syme, Christopher D.; Mosses, Joanna; González-Jiménez, Mario; Shebanova, Olga; Walton, Finlay; Wynne, Klaas (2017). "Frustration of crystallisation by a liquid–crystal phase". Scientific Reports. 7 (1): 42439. Bibcode:2017NatSR...742439S. doi:10.1038/srep42439. ISSN 2045-2322. PMC 5314399. PMID 28209972.
- ^ Zhu, Men; Wang, Jun-Qiang; Perepezko, John H.; Yu, Lian (2015). "Possible existence of two amorphous phases of d-mannitol related by a first-order transition". The Journal of Chemical Physics. 142 (24): 244504. Bibcode:2015JChPh.142x4504Z. doi:10.1063/1.4922543. ISSN 0021-9606. PMID 26133438.
- ^ Zhu, Men; Yu, Lian (2017). "Polyamorphism of D-mannitol". The Journal of Chemical Physics. 146 (24): 244503. Bibcode:2017JChPh.146x4503Z. doi:10.1063/1.4989961. ISSN 0021-9606. PMID 28668061.