결정 구조
Crystal structure결정학에서 결정구조는 결정물질에서 [1]원자, 이온 또는 분자의 질서 있는 배치를 기술하는 것이다.질서 있는 구조는 구성 입자의 본질에서 발생하며 물질 내 3차원 공간의 주요 방향을 따라 반복되는 대칭 패턴을 형성합니다.
이 반복 패턴을 구성하는 물질 중 가장 작은 입자 그룹이 구조의 단위 셀입니다.단위 셀은 전체 결정의 대칭과 구조를 완전히 반영하며, 단위 셀의 주축을 따라 반복적인 변환을 통해 구축됩니다.변환 벡터는 Bravais 격자의 노드를 정의합니다.
단위 셀의 주축 또는 모서리의 길이와 그 사이의 각도는 격자 상수이며, 격자 매개변수 또는 셀 매개변수라고도 합니다.결정의 대칭 특성은 공간 [1]그룹의 개념으로 설명됩니다.3차원 공간에서의 입자의 가능한 모든 대칭 배열은 230개의 공간 그룹에 의해 설명될 수 있다.
결정 구조와 대칭은 균열, 전자 밴드 구조 및 광학 투명도와 같은 많은 물리적 특성을 결정하는 데 중요한 역할을 합니다.
단위 세포
결정 구조의 단위 세포의 계약을 기하학적 측면에서 설명된다.그 단위 격자 가장 작은 반복 단위는 결정 구조의 전체 균형 있다는 것으로 정의된다.[2]단위 세포의 기하학은parallelepiped 현재 격자 변수들은 세포(a, b, c)edges의 길이와 그들 사이의 각도(α, β, γ)로 채택을 제공하는 정의된다.입자들의 단위 격자 안에 있는 위치가 분수의 좌표는 세포 가장자리를 따라, 대한 참조 지점에서 측정했을 때(자이, 의, zi)으로 설명됩니다.그것은 단지 입자의 작은 비대칭 부분 집합의 좌표를 보고할 필요가 있다.그래서, 그것은 모든 입자 물리적으로 경계가 격자 변수에 의해 내부에 위치하야 한다는 것 가장 작은 공간을 차지한 입자들의 이 그룹 선택할 수 있다.단위 세포의 모든 다른 입자는 단위 격자의 균형이 특징인 대칭 작전에 의해 유발된다.단위 세포의 대칭의 수술 과정은 컬렉션은 공식적으로 결정 구조의 공간 군으로 표출된다.[3]
밀러 지수
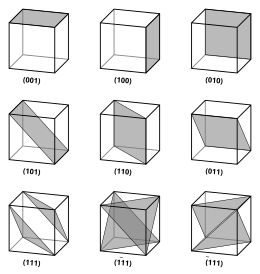
결정 격자의 벡터 및 평면은 3값 밀러 지수 표기법에 의해 기술된다.이 구문에서는 인덱스 ",[4] m 및 n을 방향 파라미터로 사용합니다.
정의상 구문(θmn)은 3개의1 점 a/θ2, a/m3, a/n 또는 이들 중 몇 개를 가로채는 평면을 의미한다.즉, 밀러 지수는 단위 셀이 있는 평면의 절편 반전에 비례합니다(격자 벡터에 기초).지수 중 하나 이상이 0이면 평면이 해당 축과 교차하지 않음을 의미합니다(즉, 절편이 "무한대"에 있음).좌표축을 포함한 평면은 밀러지수가 결정되기 전에 해당 축을 포함하지 않도록 변환된다.평면의 밀러 지수는 공통 요인이 없는 정수입니다.음의 지수는 (123)와 같이 수평 막대로 표시됩니다.입방체 셀의 직교 좌표계에서 평면의 밀러 지수는 평면에 수직인 벡터의 데카르트 성분이다.
하나 이상의 격자점(격자 평면)과 교차하는 (θmn) 평면만을 고려할 때, 인접한 격자 평면 사이의 거리 d는 다음 공식에 의해 평면에 직교하는 (가장 짧은) 역 격자 벡터와 관련된다.
평면 및 방향
결정학적 방향은 결정의 노드(아톰, 이온 또는 분자)를 연결하는 기하학적 선입니다.마찬가지로 결정학적 평면은 노드를 연결하는 기하학적 평면입니다.일부 방향 및 평면에는 노드의 밀도가 더 높습니다.이러한 고밀도 평면은 다음과 [1]같이 결정의 거동에 영향을 미칩니다.
- 광학 특성:굴절률은 밀도(또는 주기적 밀도 변동)와 직접 관련이 있습니다.
- 흡착 및 반응성:물리적 흡착과 화학반응은 표면 원자나 분자 근처에서 일어난다.따라서 이러한 현상은 노드의 밀도에 민감합니다.
- 표면 장력:물질의 응축은 원자, 이온 또는 분자가 다른 유사한 종에 둘러싸여 있으면 더 안정적이라는 것을 의미합니다.따라서 계면의 표면 장력은 표면의 밀도에 따라 달라집니다.
- 미세 구조 결함: 모공과 결정체는 고밀도 평면에 따라 직립 경계를 갖는 경향이 있습니다.
- 절단:이 문제는 일반적으로 고밀도 평면에 우선적으로 평행하게 발생합니다.
- 소성 변형:전위 활공은 고밀도 평면에 우선적으로 평행하게 발생합니다.전위(Burgers 벡터)에 의해 전달되는 섭동은 조밀한 방향을 따른다.1개의 노드를 보다 밀도 높은 방향으로 이동하려면 결정 격자의 왜곡이 적어야 합니다.
어떤 방향과 평면은 결정계의 대칭에 의해 정의된다.단사각형, 마름모꼴, 사각형 및 삼각/육각형 시스템에서는 다른 두 축보다 높은 회전 대칭을 가진 하나의 고유한 축이 있습니다.기본면은 이러한 결정계에서 주축에 수직인 평면이다.삼사정계, 직교정계 및 입방정계의 경우 축 지정은 임의이며 주축은 없습니다.
입방체 구조
단순 입방정 결정의 특수한 경우 격자 벡터는 직교하고 길이가 같다(일반적으로 a로 표시됨). 역격자에서도 이와 유사하다.따라서 이 일반적인 경우, 밀러 지수(θmn)와 [θmn]은 모두 데카르트 좌표의 정규/방향을 나타냅니다.격자 상수 a를 갖는 입방정 결정의 경우 인접한 (θmn) 격자 평면 사이의 간격 d는 (위에서) 다음과 같다.
입방정 결정의 대칭성 때문에 정수의 위치와 부호를 변경할 수 있으며 동일한 방향과 평면을 가질 수 있습니다.
- 【100】등의 각도 괄호내의 좌표는, 대칭 연산에 의해서 등가하는 방향의 패밀리를 나타내고 있습니다(예를 들면, [100], [010], [001] 등).
- {100}과(와) 같은 곱슬 괄호 또는 괄호 안의 좌표는 대칭 연산으로 인해 동등한 평면 법선 계열을 나타냅니다. 이는 각도 괄호가 방향 계열을 나타내는 것과 같습니다.
면심입방체(fcc) 및 체심입방체(bcc) 격자의 경우 원시격자 벡터는 직교하지 않는다.그러나 이러한 경우 밀러 지수는 일반적으로 입방체 슈퍼셀의 격자 벡터에 대해 정의되며, 따라서 다시 단순히 데카르트 방향이다.
평면간 간격
인접한 (hkµ) 격자 평면 사이의 간격 d는 다음과 같이 [5][6]구한다.
- 큐빅:
- 사각형:
- 육각형:
- 마름모꼴/트리거널:
- 정형외과:
- 단사정계:
- 트리클리닉:
대칭에 의한 분류
결정의 결정적인 특성은 그 고유의 대칭성이다.결정 격자에 대해 특정 대칭 연산을 수행해도 변경되지 않습니다.모든 결정들은 세 방향으로 대칭을 이루지만, 어떤 결정들은 다른 대칭 요소들도 가지고 있다.예를 들어 특정 축을 중심으로 180° 회전하면 원래 구성과 동일한 원자 구성이 될 수 있습니다. 이 축을 중심으로 두 배의 회전 대칭을 가집니다.회전대칭 외에 결정에는 거울평면의 형태로 대칭이 있을 수 있으며, 변환과 회전 또는 거울대칭의 조합인 이른바 복합대칭이 있을 수 있습니다.결정의 완전한 분류는 결정의 모든 고유 대칭이 [7]식별될 때 달성된다.
격자계
격자 시스템은 결정 구조의 격자를 설명하는 데 사용되는 축 체계에 따른 그룹화입니다.각 격자 시스템은 특정 기하학적 배열의 3개의 축 세트로 구성됩니다.모든 결정체는 일곱 개의 격자 체계 중 하나로 떨어집니다.그것들은 7개의 결정계와 비슷하지만 완전히 같지는 않다.
| 크리스탈 패밀리 | 격자계 | 점군 (Schönflys 표기법) | 브라바 격자 14개 | |||
|---|---|---|---|---|---|---|
| 프리미티브(P) | 베이스 중심(S) | 신체중심(I) | 얼굴 중심(F) | |||
| 삼사정어(a) | Ci. | 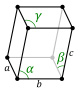 aP | ||||
| 단사정계(m) | C2h. |  mP |  씨 | |||
| 정형외과(o) | D2h. |  oP |  os | 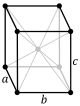 oI |  oF | |
| 사각형(t) | D4h. |  tP |  tI | |||
| 육각형(h) | 마름모꼴 | D3d. |  hR | |||
| 육각형 | D6h. |  hP | ||||
| 큐빅(c) | 오h |  cP |  cI |  cF | ||
가장 단순하고 대칭인 입방체 또는 등각계는 입방체의 대칭을 가지고 있다. 즉, 입방체는 서로에 대해 109.5°(사면체 각도)를 향하는 네 개의 세 개의 회전 축을 나타낸다.이 세 겹의 축은 입방체의 대각선을 따라 놓여 있습니다.다른 여섯 개의 격자 시스템은 육각형, 사각형, 마름모꼴(종종 삼각 결정계와 혼동됨), 직교형, 단사정형 및 삼사정형입니다.
브라바 격자
공간 격자로도 불리는 브라바이스 격자는 격자 [4]점의 기하학적 배치와 그에 따른 결정의 대칭을 묘사합니다.3차원의 공간은 14개의 브라바 격자로 구분되어 번역 대칭을 묘사합니다.준결정체를 포함하지 않고 오늘날 인식되는 모든 결정성 물질은 이러한 배열 중 하나에 들어맞습니다.격자 체계로 분류된 14개의 3차원 격자는 위에 나와 있다.
결정 구조는 각각의 격자점 주위에 위치한 같은 그룹의 원자, 즉 기초로 구성되어 있습니다.따라서 이 원자의 그룹은 브라비스 격자의 배열에 따라 3차원에서 무한히 반복된다.단위 셀의 특징적인 회전과 거울 대칭은 결정학적 점군에 의해 설명된다.
수정계
결정계는 점군 자체와 대응하는 공간군이 격자계에 할당되는 점군의 집합이다.3차원으로 존재하는 32개의 점군 중 대부분은 하나의 격자계에만 할당되며, 이 경우 결정계와 격자계는 모두 같은 이름을 가집니다.그러나 두 격자 시스템 모두 3중 회전 대칭을 보이기 때문에 5개의 점 그룹이 두 격자 시스템인 마름모꼴과 육각형에 할당됩니다.이러한 점 그룹은 삼각 결정 시스템에 할당됩니다.
| 크리스탈 패밀리 | 수정계 | 점군 / Crystal 클래스 | 쇤파리 | 점 대칭 | 주문 | 추상 그룹 |
|---|---|---|---|---|---|---|
| 삼사정형의 | 페디얼 | C1. | 에난티 형상의 북극의 | 1 | 1 (\ | |
| 피나코이드의 | Ci(S2) | 중심대칭의 | 2 | 순환의 | ||
| 단사정형의 | 나비형 | C2. | 에난티 형상의 북극의 | 2 | 순환의 | |
| 돔의 | Cs(C1h) | 북극의 | 2 | 순환의 | ||
| 프리즘의 | C2h. | 중심대칭의 | 4 | 클라인 4 | ||
| 직교 혈전성 | 마름모꼴 헤노이달 | D2(V) | 에난티 형상의 | 4 | 클라인 4 | |
| 마름모꼴의 | C2v. | 북극의 | 4 | 클라인 4 | ||
| 마름모꼴의 니켈라미달 | D2h(Vh) | 중심대칭의 | 8 | |||
| 사각형 | 정방정형의 | C4. | 에난티 형상의 북극의 | 4 | 순환의 | |
| 정방정형 헤노이달 | S4. | 비대칭의 | 4 | 순환의 | ||
| 사각형-반추체 | C4h. | 중심대칭의 | 8 | |||
| 사각형-삼면체 | D4. | 에난티 형상의 | 8 | 이면체 | ||
| 디테트라곤-수직의 | C4v. | 북극의 | 8 | 이면체 | ||
| 정방정면체의 | D2d(Vd) | 비대칭의 | 8 | 이면체 | ||
| 디테트라곤 반추체 | D4h. | 중심대칭의 | 16 | |||
| 육각형의 | 삼각형의 | 삼각형의 | C3. | 에난티 형상의 북극의 | 3 | 순환의 |
| 마름모꼴의 | C3i(S6) | 중심대칭의 | 6 | 순환의 | ||
| 삼각 외상면체 | D3. | 에난티 형상의 | 6 | 이면체 | ||
| ditrigonal-pyramidal | C3v | 북극의 | 6 | 이면체 | ||
| ditrigonal-scalenohedral | D3d | 중심대칭의 | 12 | 이면체 | ||
| 육방 | hexagonal-pyramidal | C6 | 에난티 형상의 북극의 | 6 | 순환의 | |
| trigonal-dipyramidal | C3h. | 비대칭의 | 6 | 순환의 | ||
| 육각 편추형의 | C6h. | 중심대칭의 | 12 | |||
| 육방정면체의 | D6. | 에난티 형상의 | 12 | 이면체 | ||
| 십육각형의 | C6v. | 북극의 | 12 | 이면체 | ||
| 디트리곤-비동기 | D3h. | 비대칭의 | 12 | 이면체 | ||
| 십육각형 반추체 | D6h. | 중심대칭의 | 24 | |||
| 입방체의 | 사변형의 | T | 에난티 형상의 | 12 | 번갈아 | |
| 2배체 | Th. | 중심대칭의 | 24 | |||
| 회전의 | O | 에난티 형상의 | 24 | 대칭의 | ||
| 육면체의 | Td. | 비대칭의 | 24 | 대칭의 | ||
| 육팔면체의 | 오h | 중심대칭의 | 48 | |||
총 7개의 결정계가 있다: 삼사정계, 단사정계, 직교정계, 사방정계, 삼각정계, 육방정계, 입방정계.
점 그룹
결정학적 점군 또는 결정 클래스는 적어도 한 점을 움직이지 않고 결정 구조의 외관을 변경하지 않는 대칭 연산을 포함하는 수학적 그룹이다.이러한 대칭 연산에는 다음이 포함됩니다.
- 반사 - 반사 평면에 걸쳐 구조를 반사합니다.
- 회전 - 회전 축을 중심으로 원의 지정된 부분을 구조물을 회전시킵니다.
- 반전 - 대칭 중심 또는 반전 점을 기준으로 각 점의 좌표 부호를 변경합니다.
- 부적절한 회전 - 축을 중심으로 회전한 후 반전으로 구성됩니다.
회전축(적절하고 부적절한), 반사 평면 및 대칭의 중심을 총칭하여 대칭 요소라고 합니다.가능한 크리스탈 클래스는 32개입니다.각각은 일곱 개의 결정계 중 하나로 분류될 수 있다.
스페이스 그룹
결정구조의 공간군은 점군의 연산과 더불어 병진대칭 연산을 포함한다.여기에는 다음이 포함됩니다.
- 벡터를 따라 점을 이동하는 순수 번역
- 나사 축 [8]- 축에 평행하게 변환하면서 축을 중심으로 점을 회전시킵니다.
- 평면에 [8]평행하게 변환하면서 평면을 통해 점을 반사하는 활공 평면입니다.
230개의 뚜렷한 우주 그룹이 있다.
원자배위
서로 상대적인 원자의 배열, 그 배위수(또는 가장 가까운 이웃의 수), 원자간 거리, 결합의 종류 등을 고려함으로써 [9]구조를 시각화하는 대체적인 방법을 형성할 수 있다.
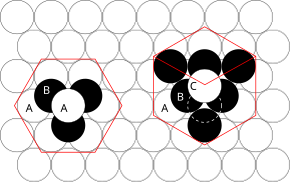
밀착 포장
관련된 원리는 동일한 크기의 구를 함께 채우고 밀착된 원자 평면을 3차원으로 쌓는 가장 효율적인 방법을 고려함으로써 이해할 수 있다.예를 들어 평면 A가 평면 B 아래에 있는 경우 추가 원자를 레이어 B 위에 배치하는 방법은 두 가지가 있습니다.평면 A 바로 위에 추가 레이어를 배치하면 다음과 같은 시리즈가 발생합니다.
- ...ABABAB...
결정 구조에서의 이러한 원자의 배열을 육각형 밀착(hcp)이라고 합니다.
단, 3개의 평면이 모두 서로 엇갈리고 4번째 층이 평면A 바로 위에 배치될 때까지 시퀀스가 반복되지 않으면 다음 시퀀스가 발생합니다.
- ABCABCABCBC...
이러한 유형의 구조 배치를 입방체 밀착 패킹(ccp)이라고 합니다.
원자의 ccp 배열 단위 셀은 면중심 입방체(FCC) 단위 셀입니다.촘촘히 채워진 레이어가 FCC 장치 셀의 {11}면에 평행하기 때문에 이는 즉시 명백하지 않습니다.촘촘한 층에는 4가지 방향이 있습니다.
원자 패킹 계수
결정 구조의 중요한 특징 중 하나는 원자 패킹 계수이다.이것은 모든 원자가 동일한 구이며, 각 구가 다음 구와 맞닿을 정도로 충분히 큰 반지름을 가지고 있다고 가정함으로써 계산됩니다.원자 패킹 계수는 구체의 총 부피를 계산하고 셀 부피로 나누어 계산할 수 있는 이러한 구에 의해 채워진 공간의 비율입니다. FCC 예는 다음과 같습니다.
74%의 패킹 효율은 한 크기의 구로만 구성된 단위 셀에서 가능한 최대 밀도입니다.금속 원소의 결정 형태는 대부분 hcp, fc 또는 BCC(체심 입방정)입니다.hcp 구조 및 FCC 구조에서의 원자의 배위수는 12이며, 그 원자 패킹 계수(APF)는 상기의 수치인 0.740입니다.이는 BCC 구조의 APF(0.680)와 단순 입방체 구조의 APF(0.524)와 비교할 수 있다.
결함 및 불순물
실제 결정은 위에서 설명한 이상적인 배열에서 결함 또는 불규칙성을 특징으로 하며, 이러한 결함이 실제 물질의 전기적 및 기계적 특성을 결정적으로 결정합니다.한 원자가 결정 구조 내의 주요 원자 성분 중 하나를 대체하면, 물질의 전기적 및 열적 성질에 변화가 뒤따를 [10]수 있다.불순물은 특정 물질에서 전자 스핀 불순물로 나타날 수도 있다.자성 불순물에 대한 연구는 비열과 같은 특정 성질의 상당한 변화가 작은 농도의 불순물에 의해 영향을 받을 수 있다는 것을 보여준다. 예를 들어 반도체 강자성 합금의 불순물은 1960년대 [11][12]후반에 처음 예측된 것과 같이 다른 성질을 초래할 수 있다.결정 격자의 전위는 완벽한 결정 [13]구조에 필요한 것보다 낮은 응력으로 전단할 수 있습니다.
입자 경계
입자 경계는 서로 다른 방향의 결정이 [4]만나는 계면입니다.입자 경계는 단상 계면이며, 경계의 양쪽에 있는 결정이 방향을 제외하고 동일하다."결정체 경계"라는 용어는 드물지만 가끔 사용됩니다.입자 경계 영역에는 원래 격자 부위에서 교란된 원자, 전위 및 낮은 에너지 입자 경계로 이동한 불순물이 포함됩니다.
입경계를 기하학적으로 두 부분으로 절단된 단결정 계면으로 취급하고, 그 중 하나는 회전하며, 입경계를 정의하기 위해 필요한 5가지 변수가 있음을 알 수 있다.처음 두 숫자는 회전 축을 지정하는 단위 벡터에서 가져옵니다.세 번째 숫자는 곡립의 회전 각도를 나타냅니다.마지막 두 숫자는 그레인 경계의 평면(또는 이 [9]평면에 정규인 단위 벡터)을 지정합니다.
입자 경계는 물질을 통한 전위의 움직임을 방해하므로 홀-페치 관계에서 설명한 바와 같이 결정체 크기를 줄이는 것이 강도를 향상시키는 일반적인 방법입니다.입자 경계는 결정 구조의 결함이기 때문에 재료의 전기 및 열 전도율을 감소시키는 경향이 있습니다.대부분의 입자 경계에서 높은 계면 에너지와 상대적으로 약한 결합은 종종 부식의 시작과 고체로부터의 새로운 상 침전을 위한 장소로 선호된다.그것들은 또한 [9]크리프의 많은 메커니즘에 중요하다.
입자의 경계는 일반적으로 몇 나노미터밖에 넓지 않다.일반적인 재료에서 결정석은 입자 경계가 재료의 작은 부분을 차지할 정도로 충분히 큽니다.그러나 매우 작은 크기의 입자가 달성 가능합니다.나노 결정 고형물에서 입자 경계는 확산 및 가소성과 같은 특성에 큰 영향을 미치면서 물질의 중요한 부피 분율이 됩니다.소결정체 한계에서는 입자 경계 부피율이 100%에 가까워지면 결정성이 없어져 비정질 [9]고체가 된다.
인터스티셜 결함
단위 셀의 공극은 간질 부위 또는 구멍이라고도 합니다.단위 [14]셀에서 원자(구)가 채워지는 사이에 존재하는 빈 공간입니다.
그 구멍들은 동그라미를 짜려고 하면 쉽게 보인다.아무리 가까이 다가가도, 어떻게 배열해도 그 사이에 빈 공간이 생기게 됩니다.단위 세포에서도 마찬가지입니다. 원자들이 어떻게 배열되든 간에 원자 사이에 간극 부위가 존재할 것입니다.이러한 장소나 구멍은 다른 원자로 채워질 수 있다.동그라미가 빽빽하게 그려진 사진은 2D 표현일 뿐입니다.결정 격자에서 원자(구)는 3D 배열로 채워집니다.그 결과 격자 내 원자의 배열에 따라 다른 형태의 간극 부위가 생긴다.
입방체의 8개 모서리에 원자 더미가 배치된 단순한 입방체 단위 셀은 중심에 단일 입방체 구멍 또는 보이드를 형성합니다.
면 중심의 입방체 및 육각형의 촘촘한 촘촘한 촘촘한 촘촘한 단위 셀은 두 개의 서로 다른 모양의 구멍을 형성할 수 있습니다.육각형 패킹 일러스트의 세 개의 녹색 구를 보면 삼각형 모양의 구멍이 뚫려 있습니다.만약 원자가 이 삼각형 구멍 위에 배치된다면 그것은 사면체 간극 구멍을 형성한다.위의 층에 있는 세 개의 원자가 회전하고 삼각형 구멍이 이 위에 있으면, 그것은 팔면체 간극 [14]구멍을 형성합니다.촘촘한 구조에서는 단위 셀당 4개의 원자가 있으며,[15] 단위 셀당 4개의 8면체 공간(1:1 비율)과 8개의 사면체 공간(1:2 비율)이 있습니다.사면체 보이드는 크기가 더 작고 격자를 구성하는 원자의 0.225배의 반지름을 가진 원자에 맞을 수 있다.8면체 보이드는 [15]격자를 구성하는 원자의 0.441배의 반지름을 가진 원자를 맞출 수 있다.이 빈 공간을 채우는 원자는 이 이상적인 반지름비보다 클 수 있으며, 이는 주변 원자를 밀어내면서 왜곡된 격자를 초래할 수 있지만,[15] 이 비율보다 작을 수는 없다.
본 발명의 체심 입방체 단위셀은 단위셀의 각 면 중앙에 위치한 6개의 팔면체공극과 동일 셀의 각 가장자리 중간점에 위치한 12개의 추가 팔면체공극을 가지며, 총 6개의 순 팔면체공극이 된다.또한 각 팔면체 보이드 주위에 정사각형 간격으로 배치된 24개의 사면체 보이드가 있어 총 12개의 정사면체 보이드가 있다.이러한 사면체 공극은 국소 최대값이 아니며 기술적으로도 공극이 아니지만, 종종 다중 원자 단위 세포에 나타납니다.
구조예측
화학적 조성만을 바탕으로 안정적인 결정 구조를 예측하는 것이 어렵다는 것은 오랫동안 완전한 계산 재료 설계 과정에서 걸림돌이 되어 왔다.보다 강력한 알고리즘과 고성능 컴퓨팅을 통해 진화 알고리즘, 랜덤 샘플링 또는 메타다이나믹스와 같은 접근방식을 사용하여 중간 복잡도의 구조를 예측할 수 있습니다.
단순한 이온성 고체(예: NaCl 또는 식탁용 소금)의 결정 구조는 1929년 라이너스 폴링에 의해 처음 정해진 폴링의 법칙에 의해 오랫동안 합리화되었고, 많은 사람들은 "화학 [16]결합의 아버지"라고 불렀다.폴링은 또한 금속의 원자간 힘의 특성을 고려했고 전이 금속의 5개의 d-오비탈 중 약 절반이 결합에 관여하며 나머지 비결합 d-오비탈은 자기 특성에 책임이 있다고 결론지었다.따라서 그는 물질의 많은 물리적 특성뿐만 아니라 결합 길이와 결합 형성의 d-오비탈의 수를 상관시킬 수 있었다.그는 이어서 금속 궤도,[17] 다양한 전자 구조들 사이에서 원자가 결합의 억제되지 않는 공명을 가능하게 하기 위해 필요한 추가 궤도인 금속 오비탈을 도입했다.
공명가 결합이론에서 금속 또는 금속간 화합물의 대체 결정 구조 중 하나를 선택하는 인자는 원자간 위치 간의 결합 공명 에너지를 중심으로 회전한다.일부 공명 모드는 더 큰 기여를 하고(다른 모드보다 기계적으로 더 안정적), 특히 포지션 수에 대한 채권 수의 단순한 비율은 예외적일 것이 분명하다.결과적으로 특별한 안정성은 가장 단순한 비율 또는 "채권 번호"와 관련된다.1/2, 1/3, 2/3, 1/4, 3/4, 등따라서 구조 선택과 축비 값(상대 결합 길이를 결정하는 것)은 원자가 단순한 분수 결합 [18][19]수를 가진 안정적인 결합을 형성하기 위한 노력의 결과이다.
흄로터리는 베타상 합금의 전자농도와 결정구조 간의 직접적인 상관관계를 가정한 후 금속상태에서 전이원소의 값 체계를 확립하기 위해 주기율표의 군수 함수로서 융점, 압축성 및 결합길이의 추세를 분석하였다.따라서 이 처리는 그룹 [20]번호의 함수로서 결합 강도가 증가하는 것을 강조했다.방향력의 작용은 결합 하이브리드와 금속 구조 사이의 관계에 관한 한 기사에서 강조되었다.결과적으로 발생하는 전자구조와 결정구조 간의 상관관계는 단일 파라미터, 즉 하이브리드화된 금속궤도당 d-전자의 무게로 요약된다."d-weight"는 FCC, hcp 및 BCC 구조에 대해 각각 0.5, 0.7 및 0.9로 계산됩니다.따라서 d-전자와 결정 구조 사이의 관계는 [21]명백해진다.
결정구조 예측/시뮬레이션에서는 시스템이 모든 방향에서 무한히 큰 것으로 생각되기 때문에 주기성이 일반적으로 적용된다.한 삼사 정계의 구조물에서 어떤 추가적인 대칭 속성으로 추정되부터 제도는 경우는 단위 세포에서 입자와 시스템 기간 벡터에 대한 최근에 역학적 방정식[22](각도를 포함한 격자 변수)에, 뉴턴의 제2법칙을 적용하여 추가적인 대칭 속성을 표시될지도 모른다. 후보선수외부 스트레스에 노출됩니다.
다형성
다형성은 물질의 여러 결정 형태의 발생이다.그것은 폴리머, 광물, 그리고 금속을 포함한 많은 결정 물질에서 발견됩니다.깁스의 위상균형 규칙에 따르면, 이러한 독특한 결정상은 압력과 온도와 같은 집중 변수에 의존합니다.다형성은 원소 고체를 가리키는 동소성과 관련이 있다.물질의 완전한 형태학은 다형성 및 결정적 습관, 비정질적 비율 또는 결정학적 결함과 같은 다른 변수에 의해 설명된다.다형류는 다른 안정성을 가지며, 특정 온도에서 [23]준안정형(또는 열역학적으로 불안정한 형태)에서 안정형으로 자발적이고 불가역적으로 변할 수 있다.또한 녹는점, 용해도 및 X선 회절 패턴도 다릅니다.
이것의 좋은 예는 이산화규소의 석영 형태, 즉 SiO입니다2.규산염의 대부분은 Si 원자가 4개의 옥시겐에 의해 사면체 배위를 나타낸다.하나의 결정 형태를 제외한 모든 형태는 서로 다른 배열의 공유 정점에 의해 서로 연결된 사면체 {SiO4} 단위를 포함합니다.광물마다 사면체는 네트워크와 중합 정도가 다르다.예를 들어, 그것들은 고리, 이중 사슬, 시트 및 3차원 프레임워크를 포함한 더 큰 유한 클러스터에서 쌍으로 결합되어 개별적으로 발생합니다.광물들은 이러한 구조에 따라 분류된다.열역학적으로 안정된 7개의 결정형 또는 결정석영 다형질 각각에서4 {SiO} 사면체의 각 가장자리 4개 중 2개만이 서로 공유되어 실리카: SiO의2 순화학식을 얻을 수 있다.
또 다른 예로는 원소 주석(Sn)이 있는데, 이는 주변 온도 근처에서 가단성이 있지만 냉각되면 부서지기 쉽습니다.두 가지 주요 동위원소인 α-와 β-주석의 존재로 인한 기계적 특성 변화.정상 압력과 온도에서 만나는 두 가지 동소 원소인 α-tin과 β-tin은 각각 회색 주석과 흰색 주석으로 더 일반적으로 알려져 있습니다.161°C 이상의 온도와 여러 GPa [24]이상의 압력에서 두 개의 동소체, δ와 δ가 추가로 존재한다.백색주석은 금속으로 상온 이상에서 안정된 결정체이다.13.2°C 이하에서는 다이아몬드, 실리콘 또는 게르마늄과 유사한 다이아몬드 큐빅 결정 구조를 가진 회색 형태의 주석입니다.회색 주석에는 금속 특성이 전혀 없고 칙칙한 회색 분말 재료이며 몇 가지 특수한 반도체 용도 외에는 [25]거의 사용되지 않습니다.주석의 α-β 변환 온도는 명목상 13.2 °C이지만 불순물(예: Al, Zn 등)은 0 °C 이하로 전이 온도를 크게 낮추므로 Sb 또는 Bi를 첨가하면 변환이 [26]전혀 발생하지 않을 수 있다.
물리 속성
32개의 결정 클래스 중 20개는 압전이며, 이들 클래스(점군) 중 하나에 속하는 결정이 압전성을 나타낸다.모든 압전 클래스는 반전 대칭이 없습니다.어떤 물질이든 전계를 가하면 유전체 편광 현상이 발생하지만, 전계가 없어도 이렇게 자연 전하 분리가 되는 물질을 극성 물질이라고 한다.물질이 극성인지 아닌지는 결정구조만으로 결정된다.32개의 점 그룹 중 10개만 극성입니다.모든 극성 결정은 열전성이기 때문에 열 극성 결정 등급은 열전 등급으로 불리기도 합니다.
강유전체 거동을 보이는 소수의 결정구조, 특히 페로브스카이트 구조가 있다.이것은 강자성과 유사하며, 생산 중에 전장이 없을 경우 강유전체 결정이 편광 현상을 보이지 않습니다.충분한 크기의 전계를 적용하면 결정이 영구적으로 편광됩니다.이 편광은 강자석이 반전되는 것과 같은 방식으로 충분히 큰 반전하에 의해 반전될 수 있다.그러나, 그것들은 강유전체라고 불리지만, 그 효과는 결정 구조 때문이다(철 금속의 존재가 아니라).
「 」를 참조해 주세요.
- 브릴루인 구역 – 결정의 상호 공간 격자에 있는 원시 셀
- 수정 공학
- 결정 성장 – 결정화 프로세스의 주요 단계
- 결정 데이터베이스
- 분수 좌표
- 프랑크-카스페르 단계
- 헤르만-마우귄 표기법 – 점군, 평면군 및 공간군에서 대칭을 나타내는 표기법
- 레이저 가열식 받침대 성장
- 액정 – 기존 액체와 결정의 특성을 모두 가진 물질 상태
- 패터슨 함수
- 주기율표(결정구조)
- 원시 세포
- 종자 결정 – 큰 결정의 성장을 시작하는 데 사용되는 단일 결정의 작은 조각
- 위그너-세이츠 셀– Voronoi 분해가 적용된 결정 격자의 원시 셀
레퍼런스
- ^ a b c Hook, J.R.; Hall, H.E. (2010). Solid State Physics. Manchester Physics Series (2nd ed.). John Wiley & Sons. ISBN 9780471928041.
- ^ West, Anthony R. (1999). Basic Solid State Chemistry (2nd ed.). Wiley. p. 1. ISBN 978-0-471-98756-7.
- ^ 국제 결정학 표 (2006)볼륨 A, 공간-그룹 대칭.
- ^ a b c 물리학 백과사전 (제2판), R.G. Lerner, G.L. Trigg, VHC 출판사, 1991년, ISBN(Verlagsgesellschaft) 3-527-26954-1, ISBN(VHC Inc.) 0-89573-75-3.
- ^ "4. Direct and reciprocal lattices". CSIC Dept de Cristalografia y Biologia Estructural. 6 Apr 2017. Retrieved 18 May 2017.
- ^ Edington, J. W. (1975). Electron Diffraction in the Electron Microscope. doi:10.1007/978-1-349-02595-4. ISBN 978-0-333-18292-5.
- ^ Ashcroft, N.; Mermin, D. (1976). "Chapter 7". Solid State Physics. Brooks/Cole (Thomson Learning, Inc.). ISBN 978-0030493461.
- ^ a b Donald E. Sands (1994). "§4-2 Screw axes and §4-3 Glide planes". Introduction to Crystallography (Reprint of WA Benjamin corrected 1975 ed.). Courier-Dover. pp. 70–71. ISBN 978-0486678399.
- ^ a b c d Parker, C.B., ed. (1994). McGraw Hill Encyclopaedia of Physics (2nd ed.). ISBN 978-0070514003.
- ^ Kallay, Nikola (2000). Interfacial Dynamics. CRC Press. ISBN 978-0824700065.
- ^ Hogan, C. M. (1969). "Density of States of an Insulating Ferromagnetic Alloy". Physical Review. 188 (2): 870–874. Bibcode:1969PhRv..188..870H. doi:10.1103/PhysRev.188.870.
- ^ Zhang, X. Y.; Suhl, H (1985). "Spin-wave-related period doublings and chaos under transverse pumping". Physical Review A. 32 (4): 2530–2533. Bibcode:1985PhRvA..32.2530Z. doi:10.1103/PhysRevA.32.2530. PMID 9896377.
- ^ Courtney, Thomas (2000). Mechanical Behavior of Materials. Long Grove, IL: Waveland Press. p. 85. ISBN 978-1-57766-425-3.
- ^ a b "What do we mean by Voids in Solid State?". Archived from the original on 2016-06-18.
- ^ a b c "Study of Interstitial Voids". Archived from the original on 2020-08-04.
- ^ L. Pauling (1929). "The principles determining the structure of complex ionic crystals". J. Am. Chem. Soc. 51 (4): 1010–1026. doi:10.1021/ja01379a006.
- ^ Pauling, Linus (1938). "The Nature of the Interatomic Forces in Metals". Physical Review. 54 (11): 899–904. Bibcode:1938PhRv...54..899P. doi:10.1103/PhysRev.54.899.
- ^ Pauling, Linus (1947). "Atomic Radii and Interatomic Distances in Metals". Journal of the American Chemical Society. 69 (3): 542–553. doi:10.1021/ja01195a024.
- ^ Pauling, L. (1949). "A Resonating-Valence-Bond Theory of Metals and Intermetallic Compounds". Proceedings of the Royal Society A. 196 (1046): 343–362. Bibcode:1949RSPSA.196..343P. doi:10.1098/rspa.1949.0032.
- ^ Hume-rothery, W.; Irving, H. M.; Williams, R. J. P. (1951). "The Valencies of the Transition Elements in the Metallic State". Proceedings of the Royal Society A. 208 (1095): 431. Bibcode:1951RSPSA.208..431H. doi:10.1098/rspa.1951.0172. S2CID 95981632.
- ^ Altmann, S. L.; Coulson, C. A.; Hume-Rothery, W. (1957). "On the Relation between Bond Hybrids and the Metallic Structures". Proceedings of the Royal Society A. 240 (1221): 145. Bibcode:1957RSPSA.240..145A. doi:10.1098/rspa.1957.0073. S2CID 94113118.
- ^ Liu, Gang (2015). "Dynamical equations for the period vectors in a periodic system under constant external stress". Can. J. Phys. 93 (9): 974–978. arXiv:cond-mat/0209372. Bibcode:2015CaJPh..93..974L. doi:10.1139/cjp-2014-0518. S2CID 54966950.
- ^ Anatase to Rutile Transition ART, J. Mat. Sci에 있습니다.
- ^ Molodets, A. M.; Nabatov, S. S. (2000). "Thermodynamic Potentials, Diagram of State, and Phase Transitions of Tin on Shock Compression". High Temperature. 38 (5): 715–721. doi:10.1007/BF02755923. S2CID 120417927.
- ^ Holleman, Arnold F.; Wiberg, Egon; Wiberg, Nils (1985). "Tin". Lehrbuch der Anorganischen Chemie (in German) (91–100 ed.). Walter de Gruyter. pp. 793–800. ISBN 978-3-11-007511-3.
- ^ Schwartz, Mel (2002). "Tin and Alloys, Properties". Encyclopedia of Materials, Parts and Finishes (2nd ed.). CRC Press. ISBN 978-1-56676-661-6.
외부 링크
![]() Wikimedia Commons의 Crystal 구조 관련 미디어
Wikimedia Commons의 Crystal 구조 관련 미디어