RHEB
RHEB| RHEB | |||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||||||||||||||
| |||||||||||||||||||||||||
| 식별자 | |||||||||||||||||||||||||
| 별칭 | RHEB, RHEB2, 뇌가 농축된 Ras 호몰로고, Ras 호몰로고, mTORC1 바인딩 | ||||||||||||||||||||||||
| 외부 ID | OMIM: 601293 MGI: 97912 호몰로진: 123916 GeneCard: RHEB | ||||||||||||||||||||||||
| |||||||||||||||||||||||||
| |||||||||||||||||||||||||
| |||||||||||||||||||||||||
| |||||||||||||||||||||||||
| 직교체 | |||||||||||||||||||||||||
| 종 | 인간 | 마우스 | |||||||||||||||||||||||
| 엔트레스 | |||||||||||||||||||||||||
| 앙상블 | |||||||||||||||||||||||||
| 유니프로트 | |||||||||||||||||||||||||
| RefSeq(mRNA) | |||||||||||||||||||||||||
| RefSeq(단백질) | |||||||||||||||||||||||||
| 위치(UCSC) | Chr 7: 151.47 – 151.52Mb | Cr 5: 25.01 – 25.05Mb | |||||||||||||||||||||||
| PubMed 검색 | [3] | [4] | |||||||||||||||||||||||
| 위키다타 | |||||||||||||||||||||||||
| |||||||||||||||||||||||||
RHEB는 뇌에서 농축된 Ras homologogue (RHEB)로도 알려져 있으며, 인간과 다른 포유류에서 보편적으로 표현되는 GTP 결합 단백질이다.단백질은 주로 mTOR 경로와 세포주기의 조절에 관여한다.[5]
RHEB는 최근에 발견된 라스 슈퍼 패밀리의 일원이다.Ras의 친척으로서, RHEB의 과다압박은 여러 인간암에서 볼 수 있다.[6]이러한 이유로, mTOR 경로를 제어하기 위해 RHEB를 억제하는 방법은 여러 질병, 특히 결핵성 경화증에서 억제할 수 없는 종양 세포 성장을 위한 가능한 치료법으로 연구된다.[7]
구조
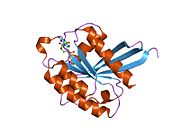
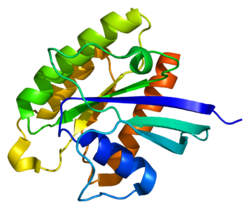
Rheb는 184개의 아미노산으로 구성된 21 kDa 단백질 단량체다.[5]N-terminus에 의한 최초의 169개의 아미노산은 GTPase 영역을 구성하고, 나머지 아미노산은 CAAX 모티브로 C-terminus에서 끝나는 고변량 영역의 일부다(C – cysteine, A – aliphatic ac미노산, X – C-terminus acid).[8]
단백질은 지질에 부착된 세포 기억 단백질로 RAS 관련 GTP 바인딩 부위가 5회 반복된다.[5]또한 GTP-bound(활성화)와 GDP-bound(비활성화) 양식 사이에서 폐쇄할 때 순응적 변화를 겪는 "switch" 영역 I과 II도 존재한다.[8]
RHEB는 인간의 RHEB 유전자에 의해 표현된다.[9]10번 염색체에 2번, 22번 염색체에 1번 등 3개의 유사 유전자가 지도화되었다.[5]
함수
mTORC1 활성화
RHEB는 인슐린/TOR/S6K 신호 경로에서의 역할로 인해 성장과 세포 주기 진행의 조절에 필수적이다.[10]라파마이신 1단지의 기계론적 대상(MTORC1)은 세린/트레오닌 키나아제로, 활성화가 세포의 성장과 증식을 이끄는 세포 내의 인산화 폭포로 이어진다.[11]RHEB는 리소돔에서 국소화하여 mTORC1과 래그7 단백질을 리소돔과 래글레이터-래그 복합체에 국소화하여, RHEB가 단백질을 활성화할 수 있게 한다.[12]RHEB는 GTP 바인딩된 형태에서 mTORC1의 활성제 역할을 하므로 GTP 바인딩된 RHEB는 세포 내 성장과 증식을 활성화한다.
mTORC1 독립 함수
RHEB는 mTORC1으로부터 독립된 다른 단백질에 대하여 조절기 역할을 할 수 있다. 예를 들어, RHEB는 de novo pyrimidine nucleotide 합성에 필요한 효소인 카바모일-인산염 합성효소 2, 아스파테 트랜스 카르바밀라아제 및 디히드로토아제(CAD)[13]를 결합하여 핵합성을 위한 활성제다.세포 내에서 뉴클레오티드 풀이 증가하면 세포 증식을 증가시킬 수 있다.mTORC1은 CAD의 조절기이기도 하기 때문에 RHEB와 mTORC1 모두 세포 내의 뉴클레오티드 수준 제어에 관여한다.[13] 5' 아데노신-모노포산염 활성 단백질키나아제(AMPK)도 RHEB의 이펙터인 것으로 밝혀졌다.[14]AMPK는 단백질 키나아제로 자가포진을 유도하는 인산화 캐스케이드를 시작한다.랫드 연구에서 RHEB는 AMPK를 활성화한다.[14] RHEB는 또한 mTOR 경로상 업스트림 이펙터와 상호작용하는 것으로 밝혀졌다.PLD1(Phospholipase D1)은 mTOR 경로의 업스트림이며 mTORC1의 포지티브 이펙터 역할을 한다.[15]
기타 함수
RHEB는 신경 가소성과 관련이 있을 수 있다.이 기능은 새롭고 일반적으로 Ras 단백질과는 관련이 없다.생쥐 배아의 전뇌에서 RHEB의 결핍은 성숙한 과두정체의 감소로 인한 골수화 감소와 관련이 있다.[8]
RHEB 녹아웃 생쥐 연구에서는, 심장 발육이 매우 손상되었다는 것을 헤마토실린-에오신 얼룩을 통해 보여주었다.심장 근세포는 크기가 충분히 커지지 않아 RHEB mTOR 기능이 필요함을 나타낸다.이것은 RHEB와 mTOR 경로의 활성화가 생쥐 배아의 적절한 심장 발달을 위한 필요조건임을 시사했다.[16]
라스 슈퍼 패밀리와의 차이점
RHEB는 Ras 슈퍼패밀리의 다른 단백질과 비교하여 다르게 기능한다.[8]라스 슈퍼 패밀리의 단백질과 비슷하게, 단백질은 GDP에 바인딩된 형태와 GTP에 바인딩된 형태 사이에 GTPase 활성과 셔틀을 가지고 있으며, 이 활동을 위해서는 단백질의 farnesylation이 필요하다.그러나 Ras 슈퍼 패밀리의 경우와 달리 형태 간 폐쇄 시 순응적 변화는 스위치 I에만 영향을 미치는 반면 스위치 II는 2차 구조의 차이로 인해 상대적으로 안정적 상태를 유지한다.RAS 스위치 II는 폐쇄 사이에 긴 α-헬리컬 구조를 형성하는 반면, RHEB 스위치 II는 새로운 기능을 허용하는 좀 더 비정형적인 순응을 채택한다.[17]그러한 순응은 RHEB의 스위치 II 영역의 촉매 Asp65가 활성 현장에서 차단되어 RAS에 비해 GTP 가수분해의 내인성 감소율을 유발한다.[11]
규정
RHEB의 GTP 가수분해 활성은 본질적으로 느리고 GTP 결합 형태는 더 일반적이기 때문에 RHEB는 세포 내에서 활동하지 않는 것보다 활동적일 가능성이 더 높다.[11]그것의 활동은 TSC 콤플렉스를 형성하는 종양 억제 단백질에 의해 세포 내에서 강하게 조절된다.구체적으로, 복합체의 TSC2 서브 유닛인 결핵은 RHEB와 상호 작용하여 단백질을 조절한다.Tubulin은 RHEB가 GTP를 가수 분해하도록 자극하여 비활성화시킨다.[18]
결핵성 경화증
결핵성 경화증은 TSC 콤플렉스를 형성하는 종양 억제 단백질을 표현하는데 필요한 유전자가 변이되거나 없어져 TSC 콤플렉스가 제 기능을 하지 못하는 자가 우성 질환이다.[19]이것은 RHEB를 포함한 세포 내의 많은 신호 전달 단백질과 이펙터의 규제를 해제할 수 있다.RHEB의 조절되지 않은 활동은 통제할 수 없는 세포 성장과 세포 분열을 유발할 수 있으며, 이는 궁극적으로 종양의 형성을 초래할 수 있다.[8]
상호작용
RHEB는 다음과 상호 작용하는 것으로 나타났다.
- Ataxia telangectasia 돌연변이(ATM)[20]
- Ataxia telangectasia 및 Rad3 관련(ATR)[20]
- 5' AMP 작동 단백질 키나아제(AMPK)[14]
- RAF 양성자-종양자 세린/스레오닌-단백질 키나아제(C-Rraf)[20][21][22]
- 라파마이신 1단지(mTORC1)[20][23][24][25]의 포유류 대상
- PLD1(인산화효소 D1)[15]
- mTOR(RPTOR)[20]의 규제 관련 단백질
- 결핵성 경화증 복합체(TSC)[18][20][26][27][28][29] 및
- 카바모일-인산합성효소 2, 아스파레이트 트랜스카르바모일효소, 디히드로오타아제(CAD)[13]
참조
- ^ a b c GRCh38: 앙상블 릴리스 89: ENSG00000106615 - 앙상블, 2017년 5월
- ^ a b c GRCm38: 앙상블 릴리스 89: ENSMUSG000028945 - 앙상블, 2017년 5월
- ^ "Human PubMed Reference:". National Center for Biotechnology Information, U.S. National Library of Medicine.
- ^ "Mouse PubMed Reference:". National Center for Biotechnology Information, U.S. National Library of Medicine.
- ^ a b c d "RHEB Ras homolog enriched in brain [Homo sapiens (human)]". Gene - NCBI. National Center for Biotechnology Information, United States National Institutes of Health.
- ^ Lu ZH, Shvartsman MB, Lee AY, Shao JM, Murray MM, Kladney RD, Fan D, Krajewski S, Chiang GG, Mills GB, Arbeit JM (Apr 2010). "Mammalian target of rapamycin activator RHEB is frequently overexpressed in human carcinomas and is critical and sufficient for skin epithelial carcinogenesis". Cancer Research. 70 (8): 3287–98. doi:10.1158/0008-5472.CAN-09-3467. PMC 2855737. PMID 20388784.
- ^ Sugiura H, Yasuda S, Katsurabayashi S, Kawano H, Endo K, Takasaki K, Iwasaki K, Ichikawa M, Kobayashi T, Hino O, Yamagata K (2015-01-01). "Rheb activation disrupts spine synapse formation through accumulation of syntenin in tuberous sclerosis complex". Nature Communications. 6: 6842. Bibcode:2015NatCo...6.6842S. doi:10.1038/ncomms7842. PMID 25880340.
- ^ a b c d e Heard JJ, Fong V, Bathaie SZ, Tamanoi F (Sep 2014). "Recent progress in the study of the Rheb family GTPases". Cellular Signalling. 26 (9): 1950–7. doi:10.1016/j.cellsig.2014.05.011. PMC 4134338. PMID 24863881.
- ^ Mizuki N, Kimura M, Ohno S, Miyata S, Sato M, Ando H, Ishihara M, Goto K, Watanabe S, Yamazaki M, Ono A, Taguchi S, Okumura K, Nogami M, Taguchi T, Ando A, Inoko H (May 1996). "Isolation of cDNA and genomic clones of a human Ras-related GTP-binding protein gene and its chromosomal localization to the long arm of chromosome 7, 7q36". Genomics. 34 (1): 114–8. doi:10.1006/geno.1996.0248. PMID 8661031.
- ^ Patel PH, Thapar N, Guo L, Martinez M, Maris J, Gau CL, Lengyel JA, Tamanoi F (Sep 2003). "Drosophila Rheb GTPase is required for cell cycle progression and cell growth". Journal of Cell Science. 116 (Pt 17): 3601–10. doi:10.1242/jcs.00661. PMID 12893813.
- ^ a b c Mazhab-Jafari MT, Marshall CB, Ishiyama N, Ho J, Di Palma V, Stambolic V, Ikura M (Sep 2012). "An autoinhibited noncanonical mechanism of GTP hydrolysis by Rheb maintains mTORC1 homeostasis". Structure. 20 (9): 1528–39. doi:10.1016/j.str.2012.06.013. PMID 22819219.
- ^ Groenewoud MJ, Zwartkruis FJ (Aug 2013). "Rheb and Rags come together at the lysosome to activate mTORC1". Biochemical Society Transactions. 41 (4): 951–5. doi:10.1042/BST20130037. PMID 23863162.
- ^ a b c Sato T, Akasu H, Shimono W, Matsu C, Fujiwara Y, Shibagaki Y, Heard JJ, Tamanoi F, Hattori S (Jan 2015). "Rheb protein binds CAD (carbamoyl-phosphate synthetase 2, aspartate transcarbamoylase, and dihydroorotase) protein in a GTP- and effector domain-dependent manner and influences its cellular localization and carbamoyl-phosphate synthetase (CPSase) activity". The Journal of Biological Chemistry. 290 (2): 1096–105. doi:10.1074/jbc.M114.592402. PMC 4294477. PMID 25422319.
- ^ a b c Lacher MD, Pincheira R, Zhu Z, Camoretti-Mercado B, Matli M, Warren RS, Castro AF (Dec 2010). "Rheb activates AMPK and reduces p27Kip1 levels in Tsc2-null cells via mTORC1-independent mechanisms: implications for cell proliferation and tumorigenesis". Oncogene. 29 (50): 6543–56. doi:10.1038/onc.2010.393. PMID 20818424. S2CID 205531885.
- ^ a b Sun Y, Fang Y, Yoon MS, Zhang C, Roccio M, Zwartkruis FJ, Armstrong M, Brown HA, Chen J (Jun 2008). "Phospholipase D1 is an effector of Rheb in the mTOR pathway". Proceedings of the National Academy of Sciences of the United States of America. 105 (24): 8286–91. Bibcode:2008PNAS..105.8286S. doi:10.1073/pnas.0712268105. PMC 2448829. PMID 18550814.
- ^ Tamai T, Yamaguchi O, Hikoso S, Takeda T, Taneike M, Oka T, Oyabu J, Murakawa T, Nakayama H, Uno Y, Horie K, Nishida K, Sonenberg N, Shah AM, Takeda J, Komuro I, Otsu K (Apr 2013). "Rheb (Ras homologue enriched in brain)-dependent mammalian target of rapamycin complex 1 (mTORC1) activation becomes indispensable for cardiac hypertrophic growth after early postnatal period". The Journal of Biological Chemistry. 288 (14): 10176–87. doi:10.1074/jbc.M112.423640. PMC 3617260. PMID 23426372.
- ^ Aspuria PJ, Tamanoi F (Oct 2004). "The Rheb family of GTP-binding proteins". Cellular Signalling. 16 (10): 1105–12. doi:10.1016/j.cellsig.2004.03.019. PMID 15240005.
- ^ a b Castro AF, Rebhun JF, Clark GJ, Quilliam LA (Aug 2003). "Rheb binds tuberous sclerosis complex 2 (TSC2) and promotes S6 kinase activation in a rapamycin- and farnesylation-dependent manner". The Journal of Biological Chemistry. 278 (35): 32493–6. doi:10.1074/jbc.C300226200. PMID 12842888.
- ^ Cheadle JP, Reeve MP, Sampson JR, Kwiatkowski DJ (Aug 2000). "Molecular genetic advances in tuberous sclerosis". Human Genetics. 107 (2): 97–114. doi:10.1007/s004390000348. PMID 11030407. S2CID 10960505.
- ^ a b c d e f Long X, Lin Y, Ortiz-Vega S, Yonezawa K, Avruch J (Apr 2005). "Rheb binds and regulates the mTOR kinase". Current Biology. 15 (8): 702–13. doi:10.1016/j.cub.2005.02.053. PMID 15854902. S2CID 3078706.
- ^ Karbowniczek M, Cash T, Cheung M, Robertson GP, Astrinidis A, Henske EP (Jul 2004). "Regulation of B-Raf kinase activity by tuberin and Rheb is mammalian target of rapamycin (mTOR)-independent". The Journal of Biological Chemistry. 279 (29): 29930–7. doi:10.1074/jbc.M402591200. PMID 15150271.
- ^ Yee WM, Worley PF (Feb 1997). "Rheb interacts with Raf-1 kinase and may function to integrate growth factor- and protein kinase A-dependent signals". Molecular and Cellular Biology. 17 (2): 921–33. doi:10.1128/mcb.17.2.921. PMC 231818. PMID 9001246.
- ^ Long X, Ortiz-Vega S, Lin Y, Avruch J (Jun 2005). "Rheb binding to mammalian target of rapamycin (mTOR) is regulated by amino acid sufficiency". The Journal of Biological Chemistry. 280 (25): 23433–6. doi:10.1074/jbc.C500169200. PMID 15878852.
- ^ Smith EM, Finn SG, Tee AR, Browne GJ, Proud CG (May 2005). "The tuberous sclerosis protein TSC2 is not required for the regulation of the mammalian target of rapamycin by amino acids and certain cellular stresses". The Journal of Biological Chemistry. 280 (19): 18717–27. doi:10.1074/jbc.M414499200. PMID 15772076.
- ^ Bernardi R, Guernah I, Jin D, Grisendi S, Alimonti A, Teruya-Feldstein J, Cordon-Cardo C, Simon MC, Rafii S, Pandolfi PP (Aug 2006). "PML inhibits HIF-1alpha translation and neoangiogenesis through repression of mTOR". Nature. 442 (7104): 779–85. Bibcode:2006Natur.442..779B. doi:10.1038/nature05029. PMID 16915281. S2CID 4427427.
- ^ Inoki K, Li Y, Xu T, Guan KL (Aug 2003). "Rheb GTPase is a direct target of TSC2 GAP activity and regulates mTOR signaling". Genes & Development. 17 (15): 1829–34. doi:10.1101/gad.1110003. PMC 196227. PMID 12869586.
- ^ Garami A, Zwartkruis FJ, Nobukuni T, Joaquin M, Roccio M, Stocker H, Kozma SC, Hafen E, Bos JL, Thomas G (Jun 2003). "Insulin activation of Rheb, a mediator of mTOR/S6K/4E-BP signaling, is inhibited by TSC1 and 2" (PDF). Molecular Cell. 11 (6): 1457–66. doi:10.1016/s1097-2765(03)00220-x. PMID 12820960.
- ^ Zhang Y, Gao X, Saucedo LJ, Ru B, Edgar BA, Pan D (Jun 2003). "Rheb is a direct target of the tuberous sclerosis tumour suppressor proteins". Nature Cell Biology. 5 (6): 578–81. doi:10.1038/ncb999. PMID 12771962. S2CID 13451385.
- ^ Cao Y, Kamioka Y, Yokoi N, Kobayashi T, Hino O, Onodera M, Mochizuki N, Nakae J (Dec 2006). "Interaction of FoxO1 and TSC2 induces insulin resistance through activation of the mammalian target of rapamycin/p70 S6K pathway". The Journal of Biological Chemistry. 281 (52): 40242–51. doi:10.1074/jbc.M608116200. PMID 17077083.
추가 읽기
- Yamagata K, Sanders LK, Kaufmann WE, Yee W, Barnes CA, Nathans D, Worley PF (Jun 1994). "rheb, a growth factor- and synaptic activity-regulated gene, encodes a novel Ras-related protein". The Journal of Biological Chemistry. 269 (23): 16333–9. doi:10.1016/S0021-9258(17)34012-7. PMID 8206940.
- Gromov PS, Madsen P, Tomerup N, Celis JE (Dec 1995). "A novel approach for expression cloning of small GTPases: identification, tissue distribution and chromosome mapping of the human homolog of rheb". FEBS Letters. 377 (2): 221–6. doi:10.1016/0014-5793(95)01349-0. PMID 8543055. S2CID 23656670.
- Bonaldo MF, Lennon G, Soares MB (Sep 1996). "Normalization and subtraction: two approaches to facilitate gene discovery". Genome Research. 6 (9): 791–806. doi:10.1101/gr.6.9.791. PMID 8889548.
- Clark GJ, Kinch MS, Rogers-Graham K, Sebti SM, Hamilton AD, Der CJ (Apr 1997). "The Ras-related protein Rheb is farnesylated and antagonizes Ras signaling and transformation". The Journal of Biological Chemistry. 272 (16): 10608–15. doi:10.1074/jbc.272.16.10608. PMID 9099708.
- Inohara N, Ding L, Chen S, Núñez G (Apr 1997). "harakiri, a novel regulator of cell death, encodes a protein that activates apoptosis and interacts selectively with survival-promoting proteins Bcl-2 and Bcl-X(L)". The EMBO Journal. 16 (7): 1686–94. doi:10.1093/emboj/16.7.1686. PMC 1169772. PMID 9130713.
- Sanger Centre, The; Washington University Genome Sequencing Cente, The (Nov 1998). "Toward a complete human genome sequence". Genome Research. 8 (11): 1097–108. doi:10.1101/gr.8.11.1097. PMID 9847074.
- Kita K, Wu YP, Sugaya S, Moriya T, Nomura J, Takahashi S, Yamamori H, Nakajima N, Suzuki N (Aug 2000). "Search for UV-responsive genes in human cells by differential mRNA display: involvement of human ras-related GTP-binding protein, Rheb, in UV susceptibility". Biochemical and Biophysical Research Communications. 274 (3): 859–64. doi:10.1006/bbrc.2000.3220. PMID 10924367.
- Hanzal-Bayer M, Renault L, Roversi P, Wittinghofer A, Hillig RC (May 2002). "The complex of Arl2-GTP and PDE delta: from structure to function". The EMBO Journal. 21 (9): 2095–106. doi:10.1093/emboj/21.9.2095. PMC 125981. PMID 11980706.
- Tabancay AP, Gau CL, Machado IM, Uhlmann EJ, Gutmann DH, Guo L, Tamanoi F (Oct 2003). "Identification of dominant negative mutants of Rheb GTPase and their use to implicate the involvement of human Rheb in the activation of p70S6K". The Journal of Biological Chemistry. 278 (41): 39921–30. doi:10.1074/jbc.M306553200. PMID 12869548.
- Tee AR, Manning BD, Roux PP, Cantley LC, Blenis J (Aug 2003). "Tuberous sclerosis complex gene products, Tuberin and Hamartin, control mTOR signaling by acting as a GTPase-activating protein complex toward Rheb". Current Biology. 13 (15): 1259–68. doi:10.1016/S0960-9822(03)00506-2. PMID 12906785. S2CID 6519150.
외부 링크
- RHEB+단백질,+인간, 미국 국립 의학 도서관의 의학 과목 제목(MSH)
이 기사는 공공영역에 있는 미국 국립 의학 도서관의 텍스트를 통합하고 있다.