니발레놀
Nivalenol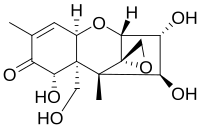 | |
| 이름 | |
|---|---|
| 기타 이름 (3α,4β,7α)-12,13-epoxy-3,4,7,15-tetrhydroxy-트리코텍-9-en-8-1[1] | |
| 식별자 | |
3D 모델(JSmol) | |
| 체비 | |
| 켐스파이더 | |
| ECHA InfoCard | 100.150.573 |
| 케그 | |
펍켐 CID | |
| 유니 | |
CompTox 대시보드 (EPA) | |
| |
| |
| 특성. | |
| C15H20O7 | |
| 어금질량 | 312.318 g·1998−1 |
| 외관 | 실체가 있는 |
| 밀도 | 1.6±0.1 g/cm3 |
| 녹는점 | 222–223 °C(432–433 °F, 495–496 K) |
| 비등점 | 585.1±50°C |
| 25°C에서 3.54*10^5mg/L | |
| 용해성 | 극성 유기 용매에 녹는 |
| 산도(pKa) | 11.78 |
| 위험 | |
| GHS 라벨 표시:[3][2] | |
   | |
| 위험 | |
| H225, H300, H302, H310, H312, H319, H330, H332 | |
| P210, P241, P260, P262, P264, P270, P271, P280, P284, P301+P310, P302+P350, P304+P340, P310, P320, P321, P322, P330, P361, P363, P403+P233, P405, P501 | |
| NFPA 704(화재 다이아몬드) | |
| 플래시 포인트 | 5°C(41°F; 278K)[2] |
| 525°C(977°F, 798K)[2] | |
임계값 한계값(TLV) | 20ppm(34mg/m3) 피부 |
| 치사량 또는 농도(LD, LC): | |
LD50(중간 선량) | 19.5mg/kg(구강, 구강), 38.9mg/kg(구강, 구강) |
| NIOSH(미국 건강 노출 제한): | |
PEL(허용) | 40ppm (70mg/m3) |
REL(권장) | 20ppm(34mg/m3) |
달리 명시된 경우를 제외하고, 표준 상태(25°C [77°F], 100 kPa)의 재료에 대한 데이터가 제공된다. | |
| Infobox 참조 자료 | |
니발레놀(NIV)은 트리코테신 그룹의 미코톡신이다.자연에서 그것은 주로 후사륨 종의 곰팡이에서 발견된다.후사륨종은 북반구 온대지방에서 곰팡이를 생성하는 미코톡신 중 가장 널리 퍼져 있는 종에 속하기 때문에 식량작물 생산산업에 상당한 위험이 있다.[4]
곰팡이는 다양한 농산물(실제 작물)과 그 이후의 가공품(맛, 맥주, 빵)에 풍부하다."후사륨 종은 농작물에 침입하여 자라며, 습하고 서늘한 조건에서 니발레놀을 생산할 수 있다."[4]
니발레놀에 걸린 뒤 관찰되는 증상은 '피드 거부, 구토, 위장염 및 피부 자극이나 괴사, 면역 기능 장애'[5]뿐 아니라 혈액독성까지 나타나 백혈구 수치가 낮다.[5]
역사
1946년부터 1963년까지 일본, 한국, 인도에서 후사륨 감염 곡물(스크래비 곡물병)의 섭취로 인한 중독 사례가 여러 건 보고되었다.치명적인 사례에 대한 보고는 없었고 메스꺼움, 구토, 설사, 복통과 같은 가벼운 증상만 있었다.이러한 사건에서 F.Graminaerum은 nivalenol 또는 deoxynivalenol 오염을 암시하는 격리될 수 있다.
같은 기간 인도와 중국에서 100건 이상의 발병이 2건 발생했다.이러한 발병은 또한 치명적이지 않았다.
1987년 인도에서 잘 기록되고 급성 발병은 약 5만 명의 사람들에게 영향을 미쳤다.빵 생산에 사용되는 비 피해 밀에서 니발레놀(24개 시료 중 2개에서 0.03–0.1mg/kg), 디옥시니발레놀(24개 시료 중 11개에서 0.34–8.4mg/kg), 아세틸데옥시니발레놀(24개 시료 중 4개에서 0.6–2.4mg/kg)이 검출된 여러 가지 후사륨 독소가 발견되었다.다시 치명적인 경우는 없었고 보고된 증상은 복통, 설사, 혈변, 구토였다.이러한 사례들은 니발레놀의 주요 부상 위험은 후사륨에 감염된 시리얼에서 발생하며 주로 통제되지 않은 밀이나 다른 곡물의 소화 경로를 통해 발생하며, 이 곡물은 추가 처리되거나 다른 경로를 통해 식품 사슬로 유입된다는 것을 보여준다.[6]
무기화 및 기타 니발레놀 중독 사례
니발레놀은 물론 디옥시니발레놀과 T-2 독소가 아프가니스탄뿐 아니라 라오스와 캄보디아에서도 생물전 요원으로 쓰였다.소련은 미코톡신을 제공했고 아프가니스탄에서 직접 사용했다는 주장이 제기되었다.이 세 가지 화합물은 모두 피해 현장의 식물에서 확인될 수 있는 반면 T-2 독소는 희생자의 소변과 혈액 샘플에서도 발견될 수 있었다.[7]
전쟁에 트리코테네를 가장 잘 문서화한 것은 황우 논란인데, 이는 목격자들이 설명한 것처럼 '황우'를 사용한 라오스, 아프가니스탄뿐만 아니라 동남아시아의 여러 공격을 묘사하고 있다.그 독소들은 황사나 물방울 구름으로 묘사되어 온 것처럼 전달되었다.1984년에 발행된 L. R. Ember의 기사는 동남아시아에서 트리코테센 미코톡신을 생물학 무기로 사용하는 것을 매우 상세하게 기술하고 있다.[8]그 안에서 생존자와 목격자, 전쟁 포로 및 소련의 정보 제공자에 대한 보고서는 소련의 기술자와 실험실의 존재에 대한 정보와 함께 발견될 수 있다.이로 인해 이 독소들이 동남아시아와 아프가니스탄에서 사용되었다는 결론에 도달했다.그러나 러시아 정부는 이 증거들에 대한 성명을 발표하기를 거부한다.나아가 공격 위치에서 채취한 샘플에는 이러한 독소가 함유되어 있는 반면, 공격을 받지 않은 사이트에는 독소의 징후가 나타나지 않는 것으로 나타났다.
모든 증인신고가 믿을 만한 증거자료인지는 여전히 의문이지만, 기록된 증상은 전형적인 트리코테센 중독증상이다.
항공기, 미사일, 휴대용 장치 또는 포병에서 나오는 에어로졸, 연기, 물방울 또는 먼지와 같은 트리코테센을 무기화하는 방법에는 여러 가지가 있었다.[9]
식품산업의 안전지침
2000년에 니발레놀에 대한 과학적인 의견이 식품 과학 위원회 (SCF)에 의해 발표되었다.일반 독성 및 혈액독성 및 면역독성 평가 후 하루 0–0.7µg/kg bw의 임시 허용 일일 섭취량(t-TDI)이 발행되었다.이 t-TDI는 2002년 SCF에 의해 재확인되었다.
2010년 일본 식품안전위원회(FSCJ)는 1일 0.4μg/kg bw의 t-TDI를 발표했다.
2001년과 2011년 사이에 유럽 식품안전청(EFSA)은 평가 대상 유럽 18개국에서 15774건의 니발레놀 발생에 대한 데이터를 수집했다.이로 인해 하루 1.2µg/kg bw의 TDI가 확립되었다.니발레놀은 유전독성이 아니라 혈액독성과 면역독성이 있는 것으로 밝혀졌다.[4]
구조 및 반응도
미코톡신 계열의 일부인 니발레놀은 이 독소 계열의 모든 구성원이 가지고 있는 공통된 구조를 가지고 있다.여기에는 C6와 C11에서 연결된 사이클로헥센과 테트라히드롭시란 링의 기본 구조가 포함된다.추가로 에틸 그룹은 C2와 C5에서 테트라히드롭레이란을 연결하고 케토 그룹은 C8의 사이클로헥센에 부착된다.대부분의 부분의 반응성을 담당하는 에폭시드 그룹은 테트라히드롭의 C12와 C13에 부착되어 있다.위치 C3, C4, C7, C15에 있는 나머지 그룹만 다른 미코톡신들에 따라 다르다.니발레놀의 경우, 나머지 4개 그룹은 각각 극성 특성으로 인해 친수성 화합물 또는 부분군이 존재하는 경우 반응성을 더하는 대체 하이드록실 그룹이다.산성 매체에서 케토 그룹은 극성과 반응성을 촉진하는 양성자와도 반응할 수 있다.그러나 전체적으로 에폭시드 그룹은 분자의 반응성에 결정적이다.[10]
사용 가능한 양식
니발레놀, 디옥시니발레놀, T2-toxin은 세 가지 구조적이고 유사한 합성 미코톡신이며 곰팡이(예: 후사륨)에서 자연적으로 나타난다.[10]
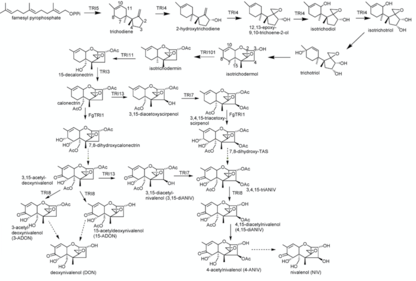
합성
니발레놀의 합성은 16단계 과정이다.트리코다이엔 싱크로나이즈 TRI1, TRI13, TRI7을 제어하는 반응이 촉매 작용하는 순서에 따라 11단계부터 14단계까지 차이가 날 수 있다.파네실 피로인산염은 니발레놀 합성을 위한 시작 화합물로 사용된다.트리코디엔에 대한 그것의 사이클화 반응은 테르펜 사이클라제 트리코디엔 신타아제 (Tri5)에 의해 촉매된다.이 반응은 시토크롬 P450 monooxygenase(TRI4에 의해 인코딩됨)에 의해 촉매되는 몇 가지 산화 반응이 뒤따른다.따라서 히드록실 그룹은 탄소 원자 C2, C3, C11로 대체되었고 C12와 C13에 산소가 1개 추가되어 에폭시드 그룹이 형성되었다.이것은 중간 동위원소 리치오트리올을 초래한다.
추가 반응에서 트리코트리오올은 동위원소리코트리올의 C11 히드록실 그룹을 C9로 전환하여 얻었으며, 유사한 이중 결합이 C9=C10에서 C10=C11로 전환되었다.트리코트리올은 이소메르의 동위원소리코데르몰에 대한 비전도성 사이클화 반응으로 반응한다.그 반응에서 사이클로펜탄의 C2에 있는 히드록실 그룹은 테트라히드롭히란 링을 형성하는 사이클로헥센의 C11에 결합한다.C9에서 이동된 OH 그룹은 반응하는 동안 손실된다.아세틸전달효소(TRI101에 의해 인코딩됨)는 동위원소리히데르민을 형성하는 동위원소오몰의 C3 OH 그룹의 아세틸화를 촉진한다.
동위원소리코더민은 C15에서 1개의 히드록실(Hydroxyl)을 C15에서 1개의 수소로 대체(TRI11에 의해 인코딩)하여 15-decalone citrin으로 변환되며 TRI3의 도움으로 아세틸화된다.동일한 대체와 이후의 아세틸화 반응은 다시 C4에서 TRI13과 TRI7의 통제 하에 발생한다. F.sportrichiodies의 TRI1은 C8의 네 번째 OH 그룹과 C7의 다섯 번째 OH 그룹의 추가에 촉매 작용을 더하여 수소가 제거되고 케토 그룹이 형성된다.
마지막 단계에서 TRI8에 의해 제어되는 에스테라제는 C3, C4 및 C15에서 탈산화를 촉진하여 최종 제품 니발레놀을 만든다.촉매 TRI1, TRI13, TRI7을 반대 순서로 사용할 때 부분적으로 대체 합성이 발생할 수 있다.그 후 C7과 TRI1에 의해 제어되는 C8의 히드록실 그룹의 추가는 반응제로서 칼로네텍트린을 가지고 일어나고 있다.이 반응에서 7,8-디하이드록시칼로네텍트린이 형성된다.C8에서 수소의 제거와 케토 그룹의 형성을 통해 3,15-아세틸-데옥시니발레놀에 자연적으로 반응한다.TRI13이 제어하는 C4에서 히드록실 그룹의 추가는 TRI7의 도움을 받아 발생하며 아세틸화된다.이는 위에서 설명한 것과 동일한 합성을 다시 한 번 나타내는 3,4,15-트리아세틸니발레놀(3,4,15-트리ANIV)을 산출한다.[9]
작용기전
니발레놀은 여러 가지 다른 생물학적 경로에 변화를 일으킨다.가장 잘 알려져 있고 아마도 중요한 것은 NF-162B 경로다.NF-κB는 거의 모든 인간 세포에서 발견될 수 있는 전사 인자로, 규제 요소에 대한 유전체 DNA의 특정 모티브에 결합하여 표적 유전자의 발현을 조절한다.체외 실험 결과, 니발레놀은 면역체계의 중요한 통제 분자인 사이토카인의 발현을 변화시킬 수 있다는 것이 밝혀졌다.니발레놀은 염증의 매개체인 IL-8의 분비를 유도했다.NF-κB 억제제로 치료할 때 IL-8 분비물이 낮아졌다.니발레놀의 영향을 받는 또 다른 중요한 요소는 MCP-1/CCL2인데, 이 사이토카인은 단핵 백혈구 세포의 이동성 조절에 역할을 한다.니발레놀은 CCL2 분비가 낮아져 단세포의 이동성이 저하되는 원인이 된다.이것은 니발레놀의 면역억제적 성질의 일부를 설명한다.다시 말하지만, 이 효과는 NF-164B 억제에 의해 감소된다. 이는 니발레놀과 NF-164B가 세포에 영향을 주기 위해 상호 작용한다는 것을 보여준다.[11][12]
디옥시니발레놀은 면역 관련 메신저 분자인 케모카인의 분비를 유도하지만 니발레놀은 이들의 분비를 억제하는 것으로 나타났다.[13][14]니발레놀은 또한 대식세포에서 염증 유전자의 발현을 조절하여 다른 세포 유형에 혼합 효과를 나타낸다.그것은 세포독성 수준에서도 그렇게 한다.[15]
nivalenol의 세포독성의 또 다른 메커니즘은 nivalenol이 자주 동반되는 mycotoxinalenol 파트너 deoxynalenol보다 더 독성이 강하며, DNA 손상과 사멸을 유발하여 그렇게 한다는 것을 보여주는 세포독성이다.[16]니발레놀은 또한 인간의 백혈구 증식에도 영향을 미치는 것으로 알려져 있다.니발레놀은 용량 의존적인 방식으로 인간 백혈구의 증식률을 변화시킬 수 있다는 것이 밝혀졌다.농도가 낮으면 백혈구 증식을 촉진하는 반면 농도가 높을수록 용량 의존적인 방식으로 증식을 감소시키는 것으로 알려져 있다.[17]
신진대사
생쥐의 니발레놀은 간을 통해서만 대사되는 것이 아니라 장에서 미생물 해독을 통해 적은 부분을 위해 대사되는 것이다.따라서 특히 분자의 가장 독성이 강한 부분으로서의 에폭시드 그룹은 퇴화된다.이것은 에폭시드 그룹의 산소를 제거하여 C12와 C13 사이에 이중 탄소-탄소 결합을 초래함으로써 일어난다.이 이중 결합은 비극적이며 매우 안정적이어서 디에폭시니발레놀이라고 불리는 반응성이 낮은 형태의 니발레놀로 이어진다.따라서 얻은 디에포화 니발레놀은 모든 디에포화화 트리코디엔과 마찬가지로 훨씬 덜 독성이 있으며, 더 이상 많은 독성 영향을 받지 않고 소변으로 분리될 수 있다(거의 독성이 없다).
실험한 생쥐와 돼지의 소변에서는 탈황화합물의 80%와 실제 니발레놀의 7%만이 삼초디엔의 대사율이 높은 것으로 나타났다.[5]그 결과 낮은 단백질과 요소에서 낮은 질소 농도가 관찰된 반면 콜레스테롤 농도는 정상보다 높은 것으로 관찰되었다.이는 간에서 혈류로의 콜레스테롤 분리를 담당하므로 니발레놀은 존재하며 후에 간에서 저하된다는 것을 암시한다.혈중 콜레스테롤의 양이 많으면 콩팥에 의해 여과된 콜레스테롤의 양이 많아지고 결국 요소 내 농도가 높아진다.[10][18]
아미드 농도 저하는 반응성 에폭시드 그룹의 분해 과정에서 발생하는 것으로 가정한다.따라서 에폭시드는 1차 아민이나 2차 아민에 히드록실 그룹을 추가하여 아미드 또는 아미드 그룹과 반응하는 경우가 많다.그 결과 에폭시드 집단은 분해되고 단백질이나 요소 합성을 위한 질소가 적게 존재한다.
역효과
니발레놀은 아직 치료법에서 사용법을 찾지 못했기 때문에 설명한 독성 효과 외에 부작용도 알지 못했다.다만 면역억제 효과가 있어 수사에 흥미가 있을 수 있다는 점에 주목할 필요가 있다.
동물에 미치는 영향과 효능
니발레놀은 특정 후사륨종의 미코톡스 제품이기 때문에 감염된 밀과 곡물에서 종종 발견된다.가공되지 않은 밀과 곡물 생산물이 가축의 사료로서 종종 사용되기 때문에, 이것들은 니발레놀 섭취의 더 높은 위험에 있다.
하루에 두 번 0.05mg의 니발레놀/kg의 체중을 투여받은 돼지의 독성 연구에서는 치사 효과가 나타나지 않았다.대부분의 니발레놀은 대변으로 분비되어 16시간 동안 먹이를 먹고도 장 위로 올라가 있는 니발레놀이 여전히 존재함에도 불구하고 혈류에는 도달하지 못했다.처음 3일 동안 대변이나 소변에서 발견된 니발레놀 대사물은 더 이상 발견되지 않았다.[19]하루 두 번 2.5 또는 5mg 니발레놀 kg bw에 일주일 동안 피폭된 후, 미생물학적 적응이 니발레놀 대사물(디-Epoxecded 니발레놀)이 대변과 소변에서 발견될 수 있었다.
쥐와 생쥐에서 니발레놀은 하루 0.7mg/kg bw의 최저 용량에서 이미 인지된 성장지연과 백혈병의 부작용과 함께 독성이 있는 것으로 나타났다.치사량은 니발레놀 투여/취득 경로에 따라 결정된다.일반적으로 니발레놀은 쥐의 경우 하루 38.9mg/kg bw, 쥐의 경우 하루 19.5mg/kg bw인 경구 투여 LD를50 섭취하므로 표준으로 사용할 수 있다.정맥, 복강 내 및 피하(SC)의50 LD는 하루에 7~7.5mg/kg bw이다.[20]
독성, 적응증 및 부작용
인간에게 있는 니발레놀의 독성은 아직 알려지지 않은 대부분의 부분에 대한 것이지만, 그것은 쥐, 쥐, 햄스터 세포에서 조사되었다.따라서 독성은 급성/소급성, 아만성, 만성 및 발암성, 유전독성, 발달 독성 연구 및 생식에 대한 연구, 면역독성/열독성 및 신경계에 미치는 영향 항목으로 구분되었다.
급성/소급 독성
니발레놀의 경구 LD는50 생쥐에서 38.9mg/kg bw인 반면, 피하 및 정맥 노출 경로는 LD50 값이 5–10mg/kg bw인 것으로 나타났다.이미 3일 이내에 가장 많은 사망자가 발생한 생쥐는 눈에 띄는 충혈과 장내 출혈을 통해 경구 피폭 후 발생했으며, 급성 독성에는 림프관도 포함된다.낮은 용량(ca. 3,5mg/kg bw)에서 24일이라는 기간에 걸쳐 투여된 니발레놀은 상당한 홍반증과 약간의 백혈구감소증을 보였다.[20]
아만성 독성
아만성 독성은 생쥐에게 4주 또는 12주 동안 하루 용량 0~3.5mg 니발레놀/kg bw를 먹여서 테스트했다.4주 후의 관찰은 체중의 감소와 음식 소비였다.체중의 감소는 흉선, 비장, 신장의 장기 무게의 통계적 감소로 설명될 수 있다.반면 암컷 쥐는 수컷 쥐에 비해 소비 시간이 적었다.12주 후에 독소 소비는 남성과 여성 모두의 상대적인 장기 체중을 감소시켰다.이로써 간만이 영향을 받았고 조직병리학적 변화는 관찰되지 않았다.[20]
만성 독성 및 발암성
암컷 생쥐는 1년 또는 2년 동안 다른 용량의 니발레놀(0, 0.7, 1.4 또는 3.5mg 니발레놀/kgbw)을 먹이로 하여 니발레놀의 만성 독성 및/또는 발암성 여부를 조사하였다.또한 이 연구 기간 동안 체중과 사료 소비량의 감소가 관찰되었다.간과 신장의 절대 중량은 2회 최고 복용량을 통해 감소되었다.1년간 니발레놀을 먹인 생쥐는 심각한 백혈구에 영향을 받은 반면 2년간 먹인 생쥐는 백혈구 수에서 차이가 없었다.또한 "간, 흉선, 비장, 신장, 위, 부신, 뇌하수체, 난소, 골수, 림프절, 뇌, 소창에서 페이어의 패치가 있든 없든 종양을 포함한 조직병리학적 변화는 발견되지 않았다"[20]고 밝혔다.가장 낮은 용량(0.7mg 니발레놀/kgbw)은 성장을 억제하고 백혈구를 유발했다." 관측 가능한 부작용 수준(NOAL)은 이러한 연구에서 도출될 수 없다.IARC(1993)는 실험동물에서 니발레놀 발암성의 증거가 불충분하다고 결론지었다.인간 데이터는 이용할 수 없었다.전반적인 결론은 발암성은 분류가 불가능하다는 것이었다(3그룹).[20]
유전독성
니발레놀은 중국 햄스터 V79(CHO) 세포의 유전자에 염색체 이상 빈도를 약간 높이고 염색체 교환 자매에 의해 영향을 미치는 것으로 나타났다.DNA는 쥐뿐만 아니라 CHO 세포에서도 손상되었다.생쥐(20mg 니발레놀/kg bw 또는 3.7mg/kg bw ip)에서 신장, 골수, 위, 제주눔, 대장 등의 DNA가 손상됐다.흉선과 간의 DNA는 영향을 받지 않았다.DNA 손상이 있는 장기에서는 조직병리학적 검사 결과 괴사성 변화가 발견되지 않았다.이용 가능한 데이터에 근거하여 유전독성에 대한 적절한 평가가 허용되지 않는다는 결론을 내릴 수 있다.[20]
발달 독성 및 생식에 관한 연구
발달 및 재생산 연구의 경우 임신 7~15일에 임신한 생쥐에게 정제된 니발레놀을 다른 양으로 주입하고, 니발레놀을 함유한 곰팡이 쌀로 추가 연구를 했다.그 연구는 그 독소가 쥐에서 발생한다는 것을 보여주었다.Teratogenic의 증거는 제시되지 않았다."구강 노출에 의해 주어지는 니발레놀을 이용한 재생산 연구에서 LOAL은 임신 기간 내내 사료에 주어지는 1.4mg/kg bw, 7~15일 가비지에 의해 주어졌을 때 5mg/kg bw"라고 명시되었다.[20]다른 종의 데이터와 성인 남성과 여성의 생식 효과에 대한 데이터는 아직 제공되지 않았다.[20]
면역독성/해마토독성
니발레놀의 급성 독성은 골수 독성과 림프관의 독성을 유도한다.장기간 노출되면 적혈구 및/또는 백혈구 소모가 발생할 수 있다.생쥐에서 또한 니발레놀은 혈청 IgA의 존재를 증가시켰다는 것이 관찰되었다. "인간의 IgA-신장염과 유사한 신장 내 면역병리학적 변화에 동반되었다."[20]배양된 인간 림프구에서의 발파유전, 피토헤아마그글루틴과 쿡쿡으로 자극된 남성과 여성 림프구의 증식, 쿡쿡에 의해 유도된 면역글로불린 생산은 니발레놀에 의해 억제된다.니발레놀의 영향은 디옥시니발레놀의 동일한 용량과 동일한 범위에 있는 반면 T-2 독소는 100배 더 독성이 있다.니발레놀과 T-2 독소, 4,15-다이아세톡시시페놀 또는 디옥시니발레놀의 조합으로 첨가 효과를 얻는다.[20]
신경계에 미치는 영향
신경계에 관한 자료는 아직 제공되지 않았다.[20]
참조
- ^ a b "Nivalenol". Cayman Chemical. Retrieved 28 March 2018.
- ^ a b c d e f "Nivalenol" (PDF). Safety Data Sheet. Retrieved 28 March 2018.
- ^ "Nivalenol". PubChem. Retrieved 28 March 2018.
- ^ a b c "Scientific Opinion on risks for animal and public health related to the presence of nivalenol in food and feed". European Food Safety Authority (EFSA) Journal. 11 (6): 1–5. 2013.
- ^ a b c Hedman, R.; Pettersson, H.; Lindberg, J.E. (2009). "Absorption and metabolism of nivalenol in pigs". Archiv für Tierernaehrung. 50–1 (1): 13–24. doi:10.1080/17450399709386115. PMID 9205733.
- ^ EFSA CONTAM Panel (EFSA Panel on Contaminants in the Food Chain) (2013). "Scientific Opinion on risks for animal and public health related to the presence of nivalenol in food and feed". EFSA Journal. 11 (6): 3262–119. doi:10.2903/j.efsa.2013.3262.
- ^ Gupta, R. C., ed. (2015). Handbook of Toxicology of Chemical Warfare Agents. Academic Press. pp. 353–369. ISBN 9780128001592.
- ^ Venkataramana, M.; Chandranayaka, S.; Prakash, H. S.; Niranja, R. (2014). "na, S. (2014). Mycotoxins Relevant to Biowarfare and Their Detection". Biological Toxins and Bioterrorism: 22. doi:10.1007/978-94-007-6645-7_32-1.
- ^ a b c McCormick, S. P.; Stanley, A. M.; Stover, N. A.; Alexander, N. J. (2011). "Trichothecenes: From Simple to Complex Mycotoxins". Toxins. 3 (7): 802–814. doi:10.3390/toxins3070802. PMC 3202860. PMID 22069741.
- ^ a b c d Sidell, F. R.; Takafuji, E. T.; Franz, D. R. (1997). Medical Aspects of Chemical and Biological Warfare. United States Government Printing. pp. 662–664. ISBN 978-9997320919.
- ^ US National Library of Medicine. "HSDB: Hazardous Substances Data Bank". Retrieved 2018-03-23.
- ^ Deshmaneand, S. L.; Kremlev, S.; Amini, S.; Sawaya, B. E. (2009). "Monocyte Chemoattractant Protein-1 (MCP-1): An Overview". Journal of Interferon & Cytokine Research. 29 (6): 313–326. doi:10.1089/jir.2008.0027. PMC 2755091. PMID 19441883.
- ^ Nagashima, H.; et al. (2012). "Environ Toxicol Pharmacol". Environmental Toxicology and Pharmacology. 34 (3): 1014–7. doi:10.1016/j.etap.2012.07.008. PMID 22964157.
- ^ Deshmane, S. L.; et al. (2009). "Monocyte chemoattractant protein-1 (MCP-1): an overview". Journal of Interferon & Cytokine Research. 29 (6): 313–326. doi:10.1089/jir.2008.0027. PMC 2755091. PMID 19441883.
- ^ Sugita-Konishi, Y.; Pestka, J. J. (2001). "Differential upregulation of TNF-alpha, IL-6, and IL-8 production by deoxynivalenol (vomitoxin) and other 8-ketotrichothecenes in a human macrophage model". Toxicol Environ Health A. 64 (8): 619–36. doi:10.1080/152873901753246223. PMID 11766169.
- ^ Minervini, F.; et al. (2004). "Toxicity and apoptosis induced by the mycotoxins nivalenol, deoxynivalenol and fumonisin B1 in a human erythroleukemia cell line". Toxicol in Vitro. 18 (1): 21–8. doi:10.1016/S0887-2333(03)00130-9. PMID 14630058.
- ^ Taranu, I.; et al. (2010). "Comparative aspects of in vitro proliferation of human and porcine lymphocytes exposed to mycotoxins". Arch Anim Nutr. 64 (5): 383–93. doi:10.1080/1745039X.2010.492140. PMID 21114234. S2CID 20521758.
- ^ Sundstøl Eriksen, G.; Pettersson, H.; Lundh, T. (2004). "Comparative cytotoxicity of deoxynivalenol, nivalenol, their acetylated derivatives and de-epoxy metabolites". Food and Chemical Toxicology. 42 (4): 619–624. doi:10.1016/j.fct.2003.11.006. PMID 15019186.
- ^ Pettersson, H.; Hedman, R. (1997). "Toxicity and metabolism of nivalenol in farm animals". Cereal Research Communications. Akadémiai Kiadó. 25–3 (3): 423–427. doi:10.1007/BF03543746.
- ^ a b c d e f g h i j k "Opinion of the Scientific Committee on Food on Fusarium Toxins Part 41: Nivalenol" (PDF). Scientific Committee on Food: 2–6. 2000.