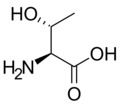
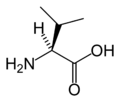
단백질원성아미노산
Proteinogenic amino acid단백질 생성 아미노산은 번역 중에 단백질에 생합성적으로 결합되는 아미노산이다."단백질 생성"이라는 단어는 "단백질 생성"을 의미한다.알려진 삶을 통해, 22개의 유전적으로 암호화된 (단백질 생성) 아미노산이 있고, 표준 유전 코드에 20개가 있으며, 특별한 번역 [1]메커니즘에 의해 통합될 수 있는 추가적인 2개 (셀레노시스테인과 필로리신)가 있다.
반대로, 비단백질 아미노산은 단백질에 통합되지 않거나(GABA, L-DOPA 또는 트리요오드티로닌과 같은), 유전적으로 부호화된 아미노산 대신 잘못 결합되거나, 표준 세포 기계(히드록시프롤린과 같은)에 의해 직접 생성되지 않는 아미노산이다.후자는 종종 단백질의 번역 후 변형에서 비롯된다.일부 비단백질성 아미노산은 비리보솜펩타아제에 의해 합성되는 비리보솜펩타이드에 함유된다.
진핵생물과 원핵생물은 SECIS 요소로 알려진 뉴클레오티드 배열을 통해 셀레노시스테인을 단백질에 통합할 수 있으며, 이것은 세포가 셀레노시스테인으로 근처의 UGA 코돈을 번역하도록 지시한다.일부 메타노겐 원핵생물에서는 UAG 코돈(통상 정지 코돈)이 필롤리신으로 [2]변환될 수도 있다.
진핵생물에는 표준 유전자 코드 중 20개인 21개의 단백질 생성 아미노산과 셀레노시스테인이 있습니다.인간은 이들 중 12개를 서로 또는 중간 신진대사의 다른 분자로부터 합성할 수 있다.나머지 9개는 소비되어야 하고, 그래서 그것들은 필수 아미노산이라고 불립니다.필수 아미노산은 히스티딘, 이소류신, 류신, 리신, 메티오닌, 페닐알라닌, 트레오닌, 트립토판 및 발린(즉, H, I, L, K, M, F, T, W, V)[3]이다.
단백질 생성 아미노산은 리보자임 오토아미노아실화 [4]시스템에 의해 인식될 수 있는 아미노산 세트와 관련이 있는 것으로 밝혀졌다.따라서, 비단백질 아미노산은 뉴클레오티드 기반 생명체의 우발적인 진화적 성공에 의해 제외되었을 것이다.특정 특정 비단백질 아미노산이 일반적으로 단백질에 통합되지 않는 이유를 설명하는 다른 이유들이 제시되었다. 예를 들어, 오르니틴과 호모세린은 펩타이드 골격에 대해 순환하고 상대적으로 짧은 반감기로 단백질을 단편화하는 반면, 다른 이유들은 프로에 잘못 통합될 수 있기 때문에 독성이 있다.아르기닌 아날로그 카나바닌과 같은 틴.
원시 수프로부터 특정 단백질 생성 아미노산이 진화적으로 선택되는 것은 비단백질 생성 아미노산이 [5]아닌 폴리펩타이드 사슬에 더 잘 결합되기 때문이라고 제안되어 왔다.
구조물들
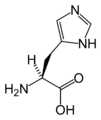
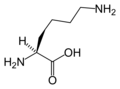
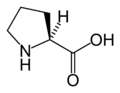
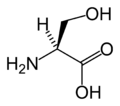
다음은 진핵생물의 유전자 코드에 의해 단백질 합성을 위해 직접 부호화된 21개의 아미노산의 구조와 약어를 보여준다.아래에 제시된 구조는 수용액에 존재하는 일반적인 zwitterion 형태가 아닌 표준 화학 구조입니다.
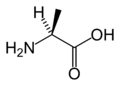
L-알라닌
(Ala/A)L-아르기닌
(아그 / R)L-아스파라긴
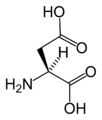
(Asn/N)L-아스파르트산
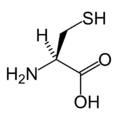
(ASP/D)L-시스테인
(CYS / C)L-글루탐산
(글루/E)L-글루타민
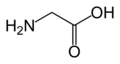
(글렌/Q)글리신
(Gly / G)L-히스티딘
(His / H)L-이소류신
(일레 / I)L-류신
(Leu / L)라이신
(리스 / K)L-메티오닌
(Met / M)L-페닐알라닌
(페/F)L-프로라인
(프로 / P)L-Serine
(Ser/S)L-트레오닌
(Thr/T)L-트립토판
(Trp/W)L-티로신
(타이어/Y)L-발린
(밸브/V)
IUPAC/IUBMB는 또한 다음 두 개의 아미노산에 대한 표준 약어를 권장합니다.
화학적 성질
아래 표는 표준 아미노산 측쇄의 한 글자 기호, 세 글자 기호 및 화학적 특성을 나열한 것입니다.나열된 질량은 원소 동위원소의 자연 함유량 가중 평균에 기초한다.펩타이드 결합을 형성하면 물 분자가 제거된다.따라서 단백질의 질량은 아미노산 질량과 동일하며 단백질은 펩타이드 결합당 마이너스 18.01524Da로 구성되어 있다.
일반적인 화학적 성질
| 아미노산 | 짧다 | Abbrev. | 평균 질량(Da) | pI | pK1 (α-COOH) | pK2 (α-+NH3) |
|---|---|---|---|---|---|---|
| 알라닌 | A | 알라 | 89.09404 | 6.01 | 2.35 | 9.87 |
| 시스테인 | C | 씨스 | 121.15404 | 5.05 | 1.92 | 10.70 |
| 아스파라긴산 | D | ASP | 133.10384 | 2.85 | 1.99 | 9.90 |
| 글루탐산 | E | 글루 | 147.13074 | 3.15 | 2.10 | 9.47 |
| 페닐알라닌 | F | 페 | 165.19184 | 5.49 | 2.20 | 9.31 |
| 글리신 | G | 글리 | 75.06714 | 6.06 | 2.35 | 9.78 |
| 히스티딘 | H | 그의 | 155.15634 | 7.60 | 1.80 | 9.33 |
| 이소류신 | I | 일레 | 131.17464 | 6.05 | 2.32 | 9.76 |
| 리신 | K | 리스 | 146.18934 | 9.60 | 2.16 | 9.06 |
| 류신 | L | 류 | 131.17464 | 6.01 | 2.33 | 9.74 |
| 메티오닌 | M | 만났다 | 149.20784 | 5.74 | 2.13 | 9.28 |
| 아스파라긴 | N | ASN | 132.11904 | 5.41 | 2.14 | 8.72 |
| 필로리신 | O | 필 | 255.31 | ? | ? | ? |
| 프롤린 | P | 프로 | 115.13194 | 6.30 | 1.95 | 10.64 |
| 글루타민 | Q | 글린 | 146.14594 | 5.65 | 2.17 | 9.13 |
| 아르기닌 | R | 아르그 | 174.20274 | 10.76 | 1.82 | 8.99 |
| 세린 | S | 서 | 105.09344 | 5.68 | 2.19 | 9.21 |
| 트레오닌 | T | 스루 | 119.12034 | 5.60 | 2.09 | 9.10 |
| 셀레노시스테인 | U | 초 | 168.053 | 5.47 | 1.91 | 10 |
| 발린. | V | 발 | 117.14784 | 6.00 | 2.39 | 9.74 |
| 트립토판 | W | Trp | 204.22844 | 5.89 | 2.46 | 9.41 |
| 티로신 | Y | 티르 | 181.19124 | 5.64 | 2.20 | 9.21 |
사이드 체인 속성
| 아미노산 | 짧다 | Abbrev. | 사이드 체인 | 하이드로 공포증 | pKa§ | 북극의 | pH | 작은. | 아주 작은 | 방향제 또는 지방족 | 판데르발스볼륨 (O3) |
|---|---|---|---|---|---|---|---|---|---|---|---|
| 알라닌 | A | 알라 | -CH3 | - | - | 지방족 | 67 | ||||
| 시스테인 | C | 씨스 | - CHSH2 | 8.55 | 산성의 | - | 86 | ||||
| 아스파라긴산 | D | ASP | - CHOOH2 | 3.67 | 산성의 | - | 91 | ||||
| 글루탐산 | E | 글루 | - CHCOOH22 | 4.25 | 산성의 | - | 109 | ||||
| 페닐알라닌 | F | 페 | - CHH265 | - | - | 방향제 | 135 | ||||
| 글리신 | G | 글리 | -H | - | - | - | 48 | ||||
| 히스티딘 | H | 그의 | (CH-CHN2332) | 6.54 | 약한 염기성 | 방향제 | 118 | ||||
| 이소류신 | I | 일레 | - CH(CH3)CH23 | - | - | 지방족 | 124 | ||||
| 리신 | K | 리스 | -(CH2)4NH2 | 10.40 | 기본의 | - | 135 | ||||
| 류신 | L | 류 | -CH2(2CH3) | - | - | 지방족 | 124 | ||||
| 메티오닌 | M | 만났다 | - CHCHSH223 | - | - | 지방족 | 124 | ||||
| 아스파라긴 | N | ASN | - CHCONH22 | - | - | - | 96 | ||||
| 필로리신 | O | 필 | -(CH2)4NH코치453 | N.D. | 약한 염기성 | - | ? | ||||
| 프롤린 | P | 프로 | - CHACH-222 | - | - | - | 90 | ||||
| 글루타민 | Q | 글린 | - CHCONH222 | - | - | - | 114 | ||||
| 아르기닌 | R | 아르그 | -(CH2)3NH-C(NH)NH2 | 12.3 | 강염기성 | - | 148 | ||||
| 세린 | S | 서 | - CHOH2 | - | - | - | 73 | ||||
| 트레오닌 | T | 스루 | -CH(OH)CH3 | - | - | - | 93 | ||||
| 셀레노시스테인 | U | 초 | - CHSeH2 | 5.43 | 산성의 | - | ? | ||||
| 발린. | V | 발 | -CH(CH3)2 | - | - | 지방족 | 105 | ||||
| 트립토판 | W | Trp | (CHCHN286 | - | - | 방향제 | 163 | ||||
| 티로신 | Y | 티르 | - CH-CHOH264 | 9.84 | 약산성 | 방향제 | 141 |
: : Asp, Cys, Glu, His, Lys 및 Tyr의 값은 알라닌 [6]펜타펩타이드 중앙에 배치된 아미노산 잔기를 이용하여 측정하였다.Arg 값은 Pace 등의 값입니다.(2009년).[7]Sec의 가치는 변&강(2011년)[8]의 것입니다.
필롤리신의 pKa 값은 보고되지 않았다.
참고: 작은 펩타이드 내 아미노산 잔류물의 pKa 값은 단백질 내에 있을 때 일반적으로 약간 다릅니다.이러한 상황에서 아미노산 잔기의 pKa 값 변화를 계산하기 위해 단백질 pKa 계산이 사용되기도 한다.
유전자 발현과 생화학
| 아미노산 | 짧다 | Abbrev. | 코드 | 발생. | 사람에게 있어서 필수 ★ | |||
|---|---|---|---|---|---|---|---|---|
| 고대 단백질에서 (%)& | 세균단백질에서 (%)& | 진핵생물 단백질에서 (%)& | 발생. 인간단백질에서 (%)& | |||||
| 알라닌 | A | 알라 | GCU, GCC, GCA, GCG | 8.2 | 10.06 | 7.63 | 7.01 | 아니요. |
| 시스테인 | C | 씨스 | UGU, UGC | 0.98 | 0.94 | 1.76 | 2.3 | 조건부로 |
| 아스파라긴산 | D | ASP | GAU, GAC | 6.21 | 5.59 | 5.4 | 4.73 | 아니요. |
| 글루탐산 | E | 글루 | GAA, GAG | 7.69 | 6.15 | 6.42 | 7.09 | 조건부로 |
| 페닐알라닌 | F | 페 | UUU, UUC | 3.86 | 3.89 | 3.87 | 3.65 | 네. |
| 글리신 | G | 글리 | GGU, GGC, GGA, GG | 7.58 | 7.76 | 6.33 | 6.58 | 조건부로 |
| 히스티딘 | H | 그의 | CAU, CAC | 1.77 | 2.06 | 2.44 | 2.63 | 네. |
| 이소류신 | I | 일레 | AUU, AUC, AUA | 7.03 | 5.89 | 5.1 | 4.33 | 네. |
| 리신 | K | 리스 | AAA, AAG | 5.27 | 4.68 | 5.64 | 5.72 | 네. |
| 류신 | L | 류 | UUA, UUG, CUU, CUC, CUA, CUG | 9.31 | 10.09 | 9.29 | 9.97 | 네. |
| 메티오닌 | M | 만났다 | 8월 | 2.35 | 2.38 | 2.25 | 2.13 | 네. |
| 아스파라긴 | N | ASN | AAU, AAC | 3.68 | 3.58 | 4.28 | 3.58 | 아니요. |
| 필로리신 | O | 필 | UAG* | 0 | 0 | 0 | 0 | 아니요. |
| 프롤린 | P | 프로 | CCU, CCC, CCA, CCG | 4.26 | 4.61 | 5.41 | 6.31 | 아니요. |
| 글루타민 | Q | 글린 | CAA, CAG | 2.38 | 3.58 | 4.21 | 4.77 | 아니요. |
| 아르기닌 | R | 아르그 | CGU, CGC, CGA, CGG, AGA, AG | 5.51 | 5.88 | 5.71 | 5.64 | 조건부로 |
| 세린 | S | 서 | UCU, UCC, UCA, UCG, AGU, AGC | 6.17 | 5.85 | 8.34 | 8.33 | 아니요. |
| 트레오닌 | T | 스루 | ACU, ACC, ACA, ACG | 5.44 | 5.52 | 5.56 | 5.36 | 네. |
| 셀레노시스테인 | U | 초 | UGA** | 0 | 0 | 0 | 0을 넘다 | 아니요. |
| 발린. | V | 발 | GUU, GUC, GUA, GUG | 7.8 | 7.27 | 6.2 | 5.96 | 네. |
| 트립토판 | W | Trp | UGG | 1.03 | 1.27 | 1.24 | 1.22 | 네. |
| 티로신 | Y | 티르 | UAU, UAC | 3.35 | 2.94 | 2.87 | 2.66 | 조건부로 |
| 코돈 정지★ | - | 용어 | UAA, UAG, UGA †† | ? | ? | ? | — | — |
* UAG는 보통 호박정지 코돈이지만, pylTSBCD 유전자에 의해 코드된 생체기구를 포함하는 유기체에는 아미노산 필롤리신이 [9]함유됩니다.
** UGA는 보통 오팔(또는 앰버) 정지 코돈이지만 SECIS 요소가 존재하는 경우 셀레노시스테인을 부호화합니다.
② 스톱코돈은 아미노산이 아니라 완전성을 위해 함유되어 있다.
UAG 및 UGA가 항상 정지 코돈으로 기능하는 것은 아닙니다(위 참조).
② 필수아미노산은 인체에서 합성할 수 없으므로 식단에 공급하여야 한다.조건부 필수 아미노산은 보통 식단에 필요하지 않지만 적절한 양을 합성하지 않는 특정 모집단에 외부적으로 공급되어야 한다.
아미노산의 발생은 각각 [10]135세고균, 3775세균, 614세진핵생물단백질 및 인간단백질(21006단백질)을 기준으로 한다.
질량 분석
펩타이드와 단백질의 질량 분석에서는 잔류물의 질량에 대한 지식이 유용하다.펩타이드 또는 단백질의 질량은 잔기 질량과 물의 질량의 합이다(단백질량=18.01056Da, 평균질량=18.0153Da).잔류 질량은 표로 된 화학식과 [11]원자량에서 계산된다.질량 분석에서 이온은 또한 하나 이상의 양성자를 포함할 수 있다(단일 이성질량 = 1.00728Da, 평균질량* = 1.0074Da).*프로톤은 평균 질량을 가질 수 없으며, 이는 듀테론에게 유효한 동위원소로서 혼란스럽게 추론되지만, 그것들은 다른 종이어야 한다(Hydron(화학) 참조).
| 아미노산 | 짧다 | Abbrev. | 공식 | 월질량 ()Da ( ) | Avg. mass (Da ) |
|---|---|---|---|---|---|
| 알라닌 | A | 알라 | 채널35 | 71.03711 | 71.0779 |
| 시스테인 | C | 씨스 | 채널35 | 103.00919 | 103.1429 |
| 아스파라긴산 | D | ASP | 채널453 | 115.02694 | 115.0874 |
| 글루탐산 | E | 글루 | 채널573 | 129.04259 | 129.1140 |
| 페닐알라닌 | F | 페 | 채널99 | 147.06841 | 147.1739 |
| 글리신 | G | 글리 | 채널23 | 57.02146 | 57.0513 |
| 히스티딘 | H | 그의 | 채널673 | 137.05891 | 137.1393 |
| 이소류신 | I | 일레 | 채널611 | 113.08406 | 113.1576 |
| 리신 | K | 리스 | 채널6122 | 128.09496 | 128.1723 |
| 류신 | L | 류 | 채널611 | 113.08406 | 113.1576 |
| 메티오닌 | M | 만났다 | 채널59 | 131.04049 | 131.1961 |
| 아스파라긴 | N | ASN | 채널4622 | 114.04293 | 114.1026 |
| 필로리신 | O | 필 | 채널121932 | 237.14773 | 237.2982 |
| 프롤린 | P | 프로 | 채널57 | 97.05276 | 97.1152 |
| 글루타민 | Q | 글린 | 채널5822 | 128.05858 | 128.1292 |
| 아르기닌 | R | 아르그 | 채널6124 | 156.10111 | 156.1857 |
| 세린 | S | 서 | 채널352 | 87.03203 | 87.0773 |
| 트레오닌 | T | 스루 | 채널472 | 101.04768 | 101.1039 |
| 셀레노시스테인 | U | 초 | 채널35 | 150.95364 | 150.0489 |
| 발린. | V | 발 | 채널59 | 99.06841 | 99.1311 |
| 트립토판 | W | Trp | 채널11102 | 186.07931 | 186.2099 |
| 티로신 | Y | 티르 | 채널992 | 163.06333 | 163.1733 |
§ 단이성 질량
세포 내 스토이코메트리 및 대사 비용
아래 표는 E.coli 세포에 아미노산이 풍부하고 아미노산 합성을 위한 대사 비용(ATP)을 보여줍니다.음의 수치는 신진대사 과정이 에너지 친화적이며 [12]세포의 순 ATP 비용이 들지 않음을 나타냅니다.아미노산의 풍부함에는 자유로운 형태와 중합 형태(단백질)의 아미노산이 포함됩니다.
| 아미노산 | 짧다 | Abbrev. | 풍부 (분자수(×108)) 대장균 세포당) | 합성 ATP 비용 | |
|---|---|---|---|---|---|
| 에어로빅 조건들 | 혐기성 조건들 | ||||
| 알라닌 | A | 알라 | 2.9 | -1 | 1 |
| 시스테인 | C | 씨스 | 0.52 | 11 | 15 |
| 아스파라긴산 | D | ASP | 1.4 | 0 | 2 |
| 글루탐산 | E | 글루 | 1.5 | -7 | -1 |
| 페닐알라닌 | F | 페 | 1.1 | -6 | 2 |
| 글리신 | G | 글리 | 3.5 | -2 | 2 |
| 히스티딘 | H | 그의 | 0.54 | 1 | 7 |
| 이소류신 | I | 일레 | 1.7 | 7 | 11 |
| 리신 | K | 리스 | 2.0 | 5 | 9 |
| 류신 | L | 류 | 2.6 | -9 | 1 |
| 메티오닌 | M | 만났다 | 0.88 | 21 | 23 |
| 아스파라긴 | N | ASN | 1.4 | 3 | 5 |
| 필로리신 | O | 필 | - | - | - |
| 프롤린 | P | 프로 | 1.3 | -2 | 4 |
| 글루타민 | Q | 글린 | 1.5 | -6 | 0 |
| 아르기닌 | R | 아르그 | 1.7 | 5 | 13 |
| 세린 | S | 서 | 1.2 | -2 | 2 |
| 트레오닌 | T | 스루 | 1.5 | 6 | 8 |
| 셀레노시스테인 | U | 초 | - | - | - |
| 발린. | V | 발 | 2.4 | -2 | 2 |
| 트립토판 | W | Trp | 0.33 | -7 | 7 |
| 티로신 | Y | 티르 | 0.79 | -8 | 2 |
언급
| 아미노산 | Abbrev. | 언급 | |
|---|---|---|---|
| 알라닌 | A | 알라 | 매우 풍부하고 매우 다용도적이며 글리신보다 강하지만 단백질 구조에 대해 작은 입체 한계만 제시할 수 있을 정도로 작습니다.그것은 꽤 중성적으로 작용하며, 외부 단백질의 친수성 영역과 내부 소수성 영역 모두에 위치할 수 있습니다. |
| 아스파라긴 또는 아스파라긴산 | B | Asx | 아미노산이 위치를 차지할 수 있는 자리 표시자 |
| 시스테인 | C | 씨스 | 황 원자는 중금속 이온에 쉽게 결합한다.산화 조건 하에서 2개의 시스테인이 디술피드 결합에 결합되어 아미노산 시스틴을 형성할 수 있다.예를 들어, 시스틴이 단백질의 일부일 때, 인슐린은 3차 구조가 안정되어 단백질이 변성에 더 잘 저항하게 된다. 따라서 디술피드 결합은 소화 효소(예: 펩신 및 키모트립신)와 구조 단백질(예: 케라틴)을 포함한 가혹한 환경에서 기능해야 하는 단백질에서 흔하다.또한 디술피드는 크기가 너무 작아 스스로 안정된 형태를 유지할 수 없는 펩타이드(예: 인슐린)에서 발견된다. |
| 아스파라긴산 | D | ASP | Asp는 글루탐산과 유사하게 반응하며 강한 음전하를 가진 친수성 산성기를 지니고 있다.보통, 그것은 단백질의 바깥 표면에 위치하여 수용성이 된다.그것은 양전하를 띤 분자와 이온에 결합하고, 종종 금속 이온을 고정하기 위해 효소에 사용됩니다.단백질의 내부에 위치할 때, 아스파르트산염과 글루탐산염은 보통 아르기닌과 리신과 짝을 이룬다. |
| 글루탐산 | E | 글루 | 글루(Glu)는 아스파라긴산과 유사하게 작용하며, 더 길고 약간 더 유연한 측쇄를 가지고 있습니다. |
| 페닐알라닌 | F | 페 | 사람에게 필수적인 페닐알라닌, 티로신 및 트립토판은 측쇄에 크고 단단한 방향족 그룹을 포함합니다.이것들은 가장 큰 아미노산입니다.이소류신, 류신, 발린과 같이, 이것들은 소수성이고 접힌 단백질 분자의 내부로 향하는 경향이 있다.페닐알라닌은 티로신으로 전환될 수 있다. |
| 글리신 | G | 글리 | α탄소에는 두 개의 수소 원자가 있기 때문에 글리신은 광학적으로 활성화되지 않는다.그것은 가장 작은 아미노산이고 쉽게 회전하며 단백질 사슬에 유연성을 더해줍니다.콜라겐의 삼중나선 등 가장 좁은 공간에 들어갈 수 있습니다.일반적으로 너무 많은 유연성은 바람직하지 않기 때문에 구조적 구성 요소로서 알라닌보다 덜 흔하다. |
| 히스티딘 | H | 그의 | 그의 것은 인간에게 필수적이다.약한 산성 조건에서도 질소의 양성화가 일어나 히스티딘과 폴리펩타이드 전체의 특성이 변화한다.그것은 많은 단백질에 의해 조절 메커니즘으로 사용되며, 후기 엔도솜 또는 리소좀과 같은 산성 영역에서 폴리펩타이드의 형태와 행동을 변화시키고, 효소의 형태 변화를 강제한다.그러나 히스티딘은 몇 개만 필요하기 때문에 비교적 적다. |
| 이소류신 | I | 일레 | Ile은 인간에게 필수적이다.이소류신, 류신 및 발린은 지방족 소수성 측쇄가 크다.그들의 분자는 단단하고, 그들의 상호 소수성 상호작용은 단백질 분자 안에 위치하는 경향이 있기 때문에 단백질의 정확한 접힘에 중요합니다. |
| 류신 또는 이소류신 | J | 즐기다 | 아미노산이 위치를 차지할 수 있는 자리 표시자 |
| 리신 | K | 리스 | 리스는 인간에게 필수적이며 아르기닌과 비슷하게 작용한다.양전하를 띤 길고 유연한 사이드 체인이 포함되어 있습니다.사슬의 유연성은 리신과 아르기닌을 표면에 음전하가 많은 분자와 결합하기에 적합하게 만든다.예를 들어, DNA 결합 단백질은 아르기닌과 리신이 풍부한 활성 영역을 가지고 있다.강한 전하로 인해 이 두 아미노산은 단백질의 외부 친수성 표면에 위치하는 경향이 있습니다; 그들이 내부에서 발견될 때, 그들은 보통 아스파르트산이나 글루탐산 같은 음전하 아미노산과 짝을 이룹니다. |
| 류신 | L | 류 | Leu는 인간에게 필수적이며, 이소류신이나 발린과 비슷하게 행동한다. |
| 메티오닌 | M | 만났다 | Met은 인간에게 필수적이다.항상 단백질에 포함된 첫 번째 아미노산은 번역 후 제거되기도 한다.시스테인처럼, 그것은 유황을 함유하고 있지만 수소 대신 메틸기를 가지고 있다.이 메틸기는 활성화될 수 있으며 새로운 탄소 원자가 다른 분자에 추가되는 많은 반응에 사용됩니다. |
| 아스파라긴 | N | ASN | 아스파라긴산과 마찬가지로 아스엔은 아스파라긴이 카르복실기를 갖는 아미드기를 포함한다. |
| 필로리신 | O | 필 | 리신과 비슷하지만 파이로린 고리가 붙어있어요 |
| 프롤린 | P | 프로 | Pro는 CO-NH 아미드 배열을 고정 배향으로 강제하는 N-end 아민 그룹에 대한 특이한 고리를 포함합니다.α나선 또는 β시트와 같은 단백질 접힘 구조를 교란시켜 단백질 사슬에서 원하는 꼬임을 강제할 수 있다.콜라겐에서 흔히 볼 수 있으며, 종종 히드록시프롤린으로 번역 후 수정을 거칩니다. |
| 글루타민 | Q | 글린 | 글루탐산과 마찬가지로 Gln은 글루가 카르복실기를 갖는 아미드기를 포함한다.단백질과 암모니아 저장소로 사용되며 체내에서 가장 풍부한 아미노산이다. |
| 아르기닌 | R | 아르그 | 기능적으로 리신과 유사합니다. |
| 세린 | S | 서 | 세린과 트레오닌은 수산기로 끝나는 짧은 그룹을 가지고 있다.그것의 수소는 제거하기가 쉬워서, 세린과 트레오닌은 종종 효소에서 수소 공여자로 작용합니다.둘 다 매우 친수성이기 때문에, 수용성 단백질의 바깥쪽 영역은 그들과 함께 풍부한 경향이 있습니다. |
| 트레오닌 | T | 스루 | 인간에게 필수적인 Thr는 세린과 비슷하게 행동한다. |
| 셀레노시스테인 | U | 초 | 셀레늄이 황 원자를 대체하는 시스테인의 셀레늄 유사체입니다. |
| 발린. | V | 발 | 인간에게 필수적인 Val은 이소류신이나 류신과 비슷하게 행동한다. |
| 트립토판 | W | Trp | 인간에게 필수적인 Trp는 페닐알라닌 및 티로신과 유사하게 작용합니다.그것은 세로토닌의 전구체이며 자연적으로 형광성이 있다. |
| 알 수 없는 | X | Xa | 아미노산이 불분명하거나 중요하지 않은 경우 자리 표시자. |
| 티로신 | Y | 티르 | Tyr는 페닐알라닌(티로신의 사전) 및 트립토판과 유사하게 행동하며 멜라닌, 에피네프린 및 갑상선 호르몬의 전구체입니다.자연적으로 형광을 띠며, 그 형광은 보통 트립토판으로의 에너지 전달에 의해 냉각된다. |
| 글루탐산 또는 글루타민 | Z | GLX | 아미노산이 위치를 차지할 수 있는 자리 표시자 |
이화 작용
아미노산은 주요 [13]산물의 특성에 따라 분류할 수 있다.
- 글루코오스제닉, 글루코오스 형성에 의한 포도당 형성 능력을 가진 제품
- Ketogenic, 포도당을 형성할 수 없는 제품:이 제품들은 케톤 생성이나 지질 합성에 여전히 사용될 수 있다.
- 글루코겐산 및 케톤산 생성물로 분해된 아미노산
「 」를 참조해 주세요.
레퍼런스
- ^ Ambrogelly A, Palioura S, Söll D (January 2007). "Natural expansion of the genetic code". Nature Chemical Biology. 3 (1): 29–35. doi:10.1038/nchembio847. PMID 17173027.
- ^ Lobanov AV, Turanov AA, Hatfield DL, Gladyshev VN (August 2010). "Dual functions of codons in the genetic code". Critical Reviews in Biochemistry and Molecular Biology. 45 (4): 257–65. doi:10.3109/10409231003786094. PMC 3311535. PMID 20446809.
- ^ Young VR (August 1994). "Adult amino acid requirements: the case for a major revision in current recommendations" (PDF). The Journal of Nutrition. 124 (8 Suppl): 1517S–1523S. doi:10.1093/jn/124.suppl_8.1517S. PMID 8064412.
- ^ Erives A (August 2011). "A model of proto-anti-codon RNA enzymes requiring L-amino acid homochirality". Journal of Molecular Evolution. 73 (1–2): 10–22. Bibcode:2011JMolE..73...10E. doi:10.1007/s00239-011-9453-4. PMC 3223571. PMID 21779963.
- ^ Frenkel-Pinter, Moran; Haynes, Jay W.; C, Martin; Petrov, Anton S.; Burcar, Bradley T.; Krishnamurthy, Ramanarayanan; Hud, Nicholas V.; Leman, Luke J.; Williams, Loren Dean (2019-08-13). "Selective incorporation of proteinaceous over nonproteinaceous cationic amino acids in model prebiotic oligomerization reactions". Proceedings of the National Academy of Sciences. 116 (33): 16338–16346. doi:10.1073/pnas.1904849116. ISSN 0027-8424. PMC 6697887. PMID 31358633.
- ^ Thurlkill RL, Grimsley GR, Scholtz JM, Pace CN (May 2006). "pK values of the ionizable groups of proteins". Protein Science. 15 (5): 1214–8. doi:10.1110/ps.051840806. PMC 2242523. PMID 16597822.
- ^ Pace CN, Grimsley GR, Scholtz JM (May 2009). "Protein ionizable groups: pK values and their contribution to protein stability and solubility". The Journal of Biological Chemistry. 284 (20): 13285–9. doi:10.1074/jbc.R800080200. PMC 2679426. PMID 19164280.
- ^ Byun BJ, Kang YK (May 2011). "Conformational preferences and pK(a) value of selenocysteine residue". Biopolymers. 95 (5): 345–53. doi:10.1002/bip.21581. PMID 21213257. S2CID 11002236.
- ^ Rother M, Krzycki JA (August 2010). "Selenocysteine, pyrrolysine, and the unique energy metabolism of methanogenic archaea". Archaea. 2010: 1–14. doi:10.1155/2010/453642. PMC 2933860. PMID 20847933.
- ^ Kozlowski LP (January 2017). "Proteome-pI: proteome isoelectric point database". Nucleic Acids Research. 45 (D1): D1112–D1116. doi:10.1093/nar/gkw978. PMC 5210655. PMID 27789699.
- ^ "Atomic Weights and Isotopic Compositions for All Elements". NIST. Retrieved 2016-12-12.
- ^ Phillips R, Kondev J, Theriot J, Garcia HG, Orme N (2013). Physical biology of the cell (Second ed.). Garland Science. p. 178. ISBN 978-0-8153-4450-6.
- ^ Ferrier DR (2005). "Chapter 20: Amino Acid Degradation and Synthesis". In Champe PC, Harvey RA, Ferrier DR (eds.). Lippincott's Illustrated Reviews: Biochemistry (Lippincott's Illustrated Reviews). Hagerstwon, MD: Lippincott Williams & Wilkins. ISBN 978-0-7817-2265-0.
일반 참고 자료
- Nelson, David L.; Cox, Michael M. (2000). Lehninger Principles of Biochemistry (3rd ed.). Worth Publishers. ISBN 978-1-57259-153-0.
- Kyte J, Doolittle RF (May 1982). "A simple method for displaying the hydropathic character of a protein". Journal of Molecular Biology. 157 (1): 105–32. CiteSeerX 10.1.1.458.454. doi:10.1016/0022-2836(82)90515-0. PMID 7108955.
- Meierhenrich, Uwe J. (2008). Amino acids and the asymmetry of life (1st ed.). Springer. ISBN 978-3-540-76885-2.
- Biochemistry, Harpers (2015). Harpers Illustrated Biochemistry (30st ed.). Lange. ISBN 978-0-07-182534-4.