아프로티닌
Aprotinin | |
| 임상 데이터 | |
|---|---|
| 기타 이름 | 트라실롤, 소 췌장 트립신 억제제 |
| AHFS/Drugs.com | 모노그래프 |
| 임신 카테고리 |
|
| 의존성 책임 | 없음. |
| 루트 행정부. | 정맥 주사 |
| ATC 코드 | |
| 법적 상태 | |
| 법적 상태 |
|
| 약동학 데이터 | |
| 바이오 어베이러빌리티 | 100%(연속) |
| 식별자 | |
| |
| CAS 번호 | |
| IUPHAR/BPS | |
| 드러그뱅크 | |
| 켐스파이더 |
|
| 유니 | |
| 케그 | |
| 첸블 | |
| ECHA 정보 카드 | 100.029.983 |
| 화학 및 물리 데이터 | |
| 공식 | C284H432N84O79S7 |
| 몰 질량 | 6511.51g/표준−1 |
| | |
약물 아프로티닌(트래실롤, 이전에는 바이엘, 현재는 노르딕 그룹 의약품)은 작은 단백질 소 췌장 트립신 억제제(BPTI) 또는 소 췌장의 염기성 트립신 억제제이며, 이는 트립신과 관련된 단백질 분해 효소를 억제하는 항섬유 분해 분자입니다.트라실롤이라는 상표명으로, 아프로티닌은 심장 및 간 수술과 같은 복잡한 수술에서 출혈을 줄이기 위해 주사제로 사용되었다.그 주된 효과는 혈전의 분해로 이어지는 과정인 섬유소 용해 속도가 느려지는 것이다.이 방법의 목적은 현저한 출혈로 인한 저혈압(저혈압)으로 인한 말단 장기 손상뿐만 아니라 수술 중 수혈의 필요성을 줄이는 것이었다.이 약은 2007년 전 세계적으로 사용이 합병증이나 [1]사망 위험을 증가시켰다는 연구 결과가 나온 후 일시적으로 철회되었다. 이는 후속 연구를 통해 확인되었다.트라실롤의 판매는 2008년 5월에 매우 제한된 연구 사용을 제외하고 중단되었다.2012년 2월 유럽약국(EMA) 과학위원회는 아프로티닌에 대한 기존 입장을 번복하고 정지를 [2]해제할 것을 권고했다.노르딕은 2012년에 [3]아프로티닌의 유통업체가 되었다.
화학
| 소췌장트립신억제제 | |||||||
|---|---|---|---|---|---|---|---|
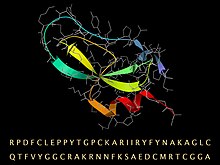 BPTI 시퀀스.접힌 3D 구조는 2차 구조용 리본과 백본 및 사이드체인용 스틱 모델(회색)로 표현됩니다. | |||||||
| 식별자 | |||||||
| 생물 | |||||||
| 기호. | PTI | ||||||
| 엔트레즈 | 404172 | ||||||
| PDB | 4PTI 기타 구조 | ||||||
| RefSeq(mRNA) | NM_001001554 | ||||||
| RefSeq(프로트) | NP_001001554 | ||||||
| 유니프로트 | P00974 | ||||||
| 기타 데이터 | |||||||
| 염색체 | 13: 75.02 ~75.03 Mb | ||||||
| |||||||
아프로티닌은 소의 폐조직에서 파생된 단량체(단쇄) 구상 폴리펩타이드이다.그것은 6512의 분자량을 가지며, 3개의 황화물, 꼬인 β-헤어핀 및 C-말단 [6]α-헬릭스를 포함하는 '작은 SS-리치' 유형의 안정적이고 콤팩트한 3차 구조로 접히는 긴 사슬 58의[4][5] 아미노산 유형으로 구성되어 있다.
소 BPTI의 아미노산 배열은 RPDFC LEPY TGPCK ARIR YFYNA KAGLC QTFVY GGCRA KRNNF CMRTC GGA이다.[7]양전하 리신(K)과 아르기닌(R) 측쇄가 10개, 음전하 아스파르트산(D)과 글루타메이트(E)가 4개밖에 없어 단백질은 염기성이 강해 염기성이 높다.(일반적인 공급원 유기체 때문에 BPTI는 때때로 소 췌장 트립신 억제제라고 불립니다.)[citation needed]
분자의 높은 안정성은 사슬의 6개 시스테인 구성원(Cys5-Cys55, Cys14-Cys38 및 Cys30-Cys51)[8]을 연결하는 3개의 이황화 결합 때문이다.노출된 루프(이미지 왼쪽 위)의 길고 염기성 리신 15 사이드 체인은 트립신의 활성 부위의 특이성 포켓에 매우 단단히 결합되어 효소 작용을 억제합니다.BPTI는 더 긴 전구체 배열로 합성되며, 이는 접힌 후 [citation needed]위에 주어진 성숙한 배열로 분해된다.
BPTI는 쿠니츠형 세린단백질가수분해효소 억제제의 단백질 패밀리 중 고전적인 구성원이다.췌장 [citation needed]내 저장 중 트립시노겐 전구체를 분해함으로써 소량 생산 시 주요 소화효소 트립신의 보호 억제를 포함한다.
약물 작용 메커니즘
아프로티닌은 여러 세린 단백질 분해효소, 특히 트립신, 키모트립신 및 플라스민의 약 125,000IU/ml [5]농도의 칼리크레인의 경쟁적 저해제이다.칼리크레인에 대한 작용은 인자 XIIa의 형성을 억제한다.그 결과 응고 및 섬유분해의 고유경로가 모두 억제된다.플라스민에 대한 그것의 작용은 독립적으로 섬유 분해 속도를 [4]늦춘다.
약효
상당한 출혈 위험이 높은 심장 수술에서 아프로티닌은 출혈, 사망률 및 입원 기간을 [5]유의하게 줄였습니다.고위험 [5]정형외과에서도 유익한 효과가 보고되었다.간이식에서는 [9]독성에 대한 우려로 인해 유익성에 대한 초기 보고가 가려졌다.
2004년에 수행된 메타 분석에서 관상동맥 바이패스 이식편(CABG) [10]수술에서 수혈 요구량이 39% 감소했습니다.정형외과에서도 수혈 감소가 확인됐다.[11]
약물 안전성
아프로티닌의 [5]안전성에 대한 우려가 있어 왔다.아나필락시스(중증 알레르기 반응)는 최초 사용 시 1:200의 비율로 발생하지만, 이러한 테스트의 정확한 해석이 [5]어렵기 때문에 실제로 아나필락시스 위험을 예측하는 혈청학(혈중 아프로티닌에 대한 항체 측정)은 수행되지 않는다.
혈전증은 아마도 섬유소용해계의 과잉 활성 억제에서 더 높은 비율로 발생할 수 있지만, 2006년까지 이 [5][10]연관성에 대한 증거는 제한적이었다.마찬가지로 신장 기능의 생화학적 측정이 때때로 악화되는 것으로 알려져 있었지만,[5] 이것이 결과에 큰 영향을 미쳤다는 증거는 없었다.2006년에 보고된 심장 수술 환자들에 대한 연구는 뇌졸중과 [12]뇌병증뿐만 아니라 급성 신부전, 심근경색, 심부전의 위험이 실제로 있다는 것을 보여주었다.연구 저자들은 이러한 위험이 [12]문서화되지 않은 오래된 항섬유질 용해제(예: 트라넥삼산)를 권장한다.같은 그룹은 2007년에 데이터를 업데이트하고 유사한 [13]결과를 입증했다.
2006년 9월, 바이엘 A.G.는 증언 중에 아프로티닌과 다른 항섬유소용해제를 투여받은 67,000명의 환자들에 대한 위탁 후술 연구의 존재를 밝히지 않아 FDA로부터 비난을 받았다.그 연구는 아프로티닌이 더 큰 위험을 수반한다는 결론을 내렸다.FDA는 관련된 연구원 중 한 명으로부터 그 연구에 대한 경고를 받았다.FDA가 우려 성명을 발표했지만, 그들은 그 약이 특정 하위 환자 [14]집단에 도움이 될 수 있다는 그들의 권고를 바꾸지 않았다.FDA는 2006년 10월 3일자 공중보건 권고 업데이트에서 "의사들은 혈액 손실 감소의 임상적 이익이 의료 관리에 필요하고 잠재적 위험보다 중요한 상황으로 트라실롤 사용을 제한하는 것을 고려하고 환자를 [15]주의 깊게 관찰할 것"을 권고했다.
2007년 10월 25일, FDA는 심장 수술 집단에 대한 "항섬유분해제를 사용한 혈액 보존" (BART) 무작위 실험에 관한 성명을 발표했다.예비 연구 결과에 따르면 다른 항섬유질 용해제(엡실론-아미노카프로산 및 트라넥삼산)에 비해 아프로티닌이 [16]사망 위험을 높일 수 있다.2006년 10월 29일, 식품의약국은 아프로티닌이 심각한 신장 및 심혈관 독성을 가지고 있을 수 있다는 경고를 발표했다.생산자인 바이엘은 추가적인 관찰 연구 결과 사망, 심각한 신장 손상, 울혈성 심부전, 뇌졸중의 가능성을 높일 수 있다고 FDA에 보고했다.FDA는 의료 관리에 있어 출혈 감소의 임상적 이익이 필수적이고 잠재적 [17]위험보다 중요한 상황으로 사용을 제한하는 것을 고려하라고 임상의들에게 경고했다.2007년 11월 5일, 바이엘은 심장 [18]수술 중 출혈을 막기 위해 아프로티닌을 사용했을 때 사망 위험을 증가시켰다는 캐나다 연구 결과 때문에 아프로티닌을 회수할 것이라고 발표했다.
2008년 초에 발표된 두 가지 연구에서 아프로티닌과 아미노카프로산을 비교한 결과 사망률이 각각 32%, 64%[20] 증가했다[19].한 연구는 투석 및 혈관 [20]재생의 필요성이 증가하는 것을 발견했다.
아프로티닌에 의한 광우병 감염 사례는 보고되지 않았지만 이탈리아에서는 [5]이 우려가 제기돼 사용이 중단됐다.
시험관내 사용
소량의 [citation needed]아프로티닌은 글루카곤과 같은 특정 급속 분해 단백질의 실험실 측정을 가능하게 하기 위해 채취된 혈액의 튜브에 첨가될 수 있다.
세포생물학에서 아프로티닌은 세포 및 [citation needed]조직의 용해 또는 균질화 중 단백질 분해를 방지하기 위한 효소 억제제로서 사용된다.
아프로티닌은 플루오레세인 이소티오시아네이트로 표지할 수 있다.이 복합체는 항단백질 및 탄수화물 결합 특성을[21] 유지하며, 우로닉산 [22]또는 시알산이 풍부한 당결합체(점액)를 염색하기 위한 형광 조직 화학 시약으로 사용되어 왔다.
역사
처음에 "칼리크레인 불활성화제"로 명명된 아프로티닌은 1930년에 [23]소의 파라티드샘에서 처음 분리되었고 1936년에는 [24]소 췌장의 트립신 억제제로 독립적으로 분리되었다.그것은 [25]1964년에 소의 폐에서 정제되었다.그것은 췌장 효소를 억제하기 때문에, 처음에는 급성 췌장염 치료에 사용되었고, 이 급성 췌장염은 자체 효소에 의한 선 파괴가 [26]병인의 일부로 생각되었다.그것은 1960년대에 [27]큰 수술에 사용되기 시작했다.
BPTI는 구조 생물학, 실험 및 계산 역학, 돌연변이 유발 및 접힘 경로 측면에서 가장 철저하게 연구된 단백질 중 하나이다.1970년 로버트 [28]휴버의 연구실에서 해결된 최초의 단백질 결정 구조 중 하나였습니다.[29]그리고 1974년 소 트립신 복합체의 맥락에서 해독된 기질 같은 상호작용 모드입니다.이후 [30][31]1980년대 초 취리히 ETH의 쿠르트 뷔트리히 연구실에서 NMR 분광법에 의해 구조가 결정된 최초의 단백질로 유명해졌다.
1975년까지 [32]구조가 높은 분해능으로 결정되는 작고 안정적인 단백질이기 때문에,[33] 1977년 하버드 카플러스 그룹의 J. Andrew McCammon과 Bruce Gelin에 의해 분자 역학 계산을 사용하여 시뮬레이션된 최초의 고분자였습니다.그 연구는 안정된 단백질의 내부에 잘 채워진 방향족 사이드체인도 비교적 빠르게 뒤집힐 수 있다는 것을 NMR 작업에서[34] 발견한 놀라운 사실을 확인시켜 주었다.속도 상수는 사슬을 따라 개별 펩타이드 NH 그룹의 수소 교환에 대해 NMR에 의해 결정되었으며, β 시트 중앙에 가장 많이 매립된 수소 결합 그룹에 대해 너무 빠른 속도에서 수개월까지 다양하며, 이러한 값은 역학에서 볼 수 있는 운동 정도와 상당히 잘 상관관계가 있다.시뮬레이션을 실시합니다.
BPTI는 단백질 접힘 과정, 즉 폴리펩타이드 사슬이 3D로 특정 배열로 자가 조립되는 과정에 대한 지식 개발에 중요했다.6개의 Cys 측쇄 사이에서 올바른 쌍을 이루는 문제는 BPTI 체인 종단 부근에 있는 두 개의 매립형 근접 SS에 대해 특히 어려운 것으로 나타났다. 따라서 성숙한 염기서열을 체외로 접기 위해 비원어 중간체가 필요하다(나중에 전구 염기서열이 생체 내에서 더 쉽게 접히는 것으로 밝혀졌다).BPTI는 1992년 [35]Thomas Creighton에 의해 단백질 접이식 총체적 표지 이미지였다.
현재의 조사 결과
쥐에 대한 한 과학적 연구는 아프로티닌으로 치료하면 C. 네오포만스 감염 [36]중 혈액-뇌 장벽의 교란을 예방한다고 보고했다.세포 배양에 관한 또 다른 연구는 이 약이 SARS-CoV-2 [37]복제를 억제한다는 것을 시사한다.
레퍼런스
- ^ "Bayer Temporarily Suspends Global Trasylol Marketing" (PDF) (Press release). Trasylol.com. 2007-11-05. Archived from the original (PDF) on 2011-07-17. Retrieved 2007-12-03.
- ^ "European Medicines Agency recommends lifting suspension of aprotinin". European Medicines Agency. 2012-02-17.
- ^ "The Nordic Group acquires rights to Trasylol® from Bayer HealthCare". The Nordic Group B.V. Archived from the original on 1 February 2014. Retrieved 28 January 2014.
- ^ a b Mannucci PM (July 1998). "Hemostatic drugs". The New England Journal of Medicine. 339 (4): 245–53. doi:10.1056/NEJM199807233390407. PMID 9673304.
- ^ a b c d e f g h i Mahdy AM, Webster NR (December 2004). "Perioperative systemic haemostatic agents". British Journal of Anaesthesia. 93 (6): 842–58. doi:10.1093/bja/aeh227. PMID 15277296.
- ^ Richardson JS (1981). "The anatomy and taxonomy of protein structure". Advances in Protein Chemistry Volume 34. Advances in Protein Chemistry. Vol. 34. pp. 167–339. doi:10.1016/S0065-3233(08)60520-3. ISBN 978-0-12-034234-1. PMID 7020376.
- ^ Kassell B, Radicevic M, Ansfield MJ, Laskowski M (January 1965). "The basic trypsin inhibitor of bovine pancreas. IV. The linear sequence of the 58 amino acids". Biochemical and Biophysical Research Communications. 18 (2): 255–8. doi:10.1016/0006-291X(65)90749-7. PMID 14282026.
- ^ Kassell B, Laskowski M (August 1965). "The basic trypsin inhibitor of bovine pancreas. V. The disulfide linkages". Biochemical and Biophysical Research Communications. 20 (4): 463–8. doi:10.1016/0006-291X(65)90601-7. PMID 5860161.
- ^ Xia VW, Steadman RH (January 2005). "Antifibrinolytics in orthotopic liver transplantation: current status and controversies". Liver Transplantation. 11 (1): 10–8. doi:10.1002/lt.20275. PMID 15690531.
- ^ a b Sedrakyan A, Treasure T, Elefteriades JA (September 2004). "Effect of aprotinin on clinical outcomes in coronary artery bypass graft surgery: a systematic review and meta-analysis of randomized clinical trials". The Journal of Thoracic and Cardiovascular Surgery. 128 (3): 442–8. doi:10.1016/j.jtcvs.2004.03.041. PMID 15354106.
- ^ Shiga T, Wajima Z, Inoue T, Sakamoto A (December 2005). "Aprotinin in major orthopedic surgery: a systematic review of randomized controlled trials". Anesthesia and Analgesia. 101 (6): 1602–7. doi:10.1213/01.ANE.0000180767.50529.45. PMID 16301226. S2CID 33762135.
- ^ a b Mangano DT, Tudor IC, Dietzel C (January 2006). "The risk associated with aprotinin in cardiac surgery". The New England Journal of Medicine. 354 (4): 353–65. doi:10.1056/NEJMoa051379. PMID 16436767.
- ^ Mangano DT, Miao Y, Vuylsteke A, Tudor IC, Juneja R, Filipescu D, et al. (February 2007). "Mortality associated with aprotinin during 5 years following coronary artery bypass graft surgery". JAMA. 297 (5): 471–9. doi:10.1001/jama.297.5.471. PMID 17284697.
- ^ Harris G (2006-09-30). "F.D.A. Says Bayer Failed to Reveal Drug Risk Study - New York Times". The New York Times. Retrieved 2007-11-05.
- ^ "Facts & Comparisons: Trasylol Public Health Advisory Update". Retrieved 2007-11-05.
- ^ U.S. Food and Drug Administration. "Early Communication about an Ongoing Safety Review Aprotinin Injection (marketed as Trasylol)". Archived from the original on 2007-10-30. Retrieved 2007-10-28.
{{cite web}}: CS1 maint: 작성자 파라미터 사용(링크) - ^ U.S. Food and Drug Administration. "Information for Healthcare Professionals; Aprotinin (marketed as Trasylol)". Archived from the original on 2006-10-10. Retrieved 2006-10-30.
{{cite web}}: CS1 maint: 작성자 파라미터 사용(링크) - ^ Harris G (2007-11-05). "Bayer Withdraws Heart Surgery Drug". The New York Times. Retrieved 2007-11-05.
- ^ Shaw AD, Stafford-Smith M, White WD, Phillips-Bute B, Swaminathan M, Milano C, et al. (February 2008). "The effect of aprotinin on outcome after coronary-artery bypass grafting". The New England Journal of Medicine. 358 (8): 784–93. doi:10.1056/NEJMoa0707768. PMID 18287601.
- ^ a b Schneeweiss S, Seeger JD, Landon J, Walker AM (February 2008). "Aprotinin during coronary-artery bypass grafting and risk of death". The New England Journal of Medicine. 358 (8): 771–83. doi:10.1056/NEJMoa0707571. PMID 18287600.
- ^ Stoddart RW, Kernan JA (March 1973). "Aprotinin, a carbohydrate-binding protein". Histochemie. Histochemistry. Histochimie. 34 (4): 275–80. doi:10.1007/BF00306299. PMID 4266832. S2CID 44549220.
- ^ Kiernan JA, Stoddart RW (1973). "Fluorescent-labelled aprotinin: a new reagent for the histochemical detection of acid mucosubstances". Histochemistry. 34 (1): 77–84. doi:10.1007/BF00304309. PMID 4119444. S2CID 32032724.
- ^ Kraut H, Frey EK, Bauer E (1930). "Über die Inaktivierung des kallikreins". Hoppe-Seyler's Z Physiol Chem (in German). 192: 1–21. doi:10.1515/bchm2.1930.192.1-3.1.
- ^ Kunitz M, Northrop JH (July 1936). "Isolation from beef pancreas of crystalline trypsinogen, trypsin, trypsin inhibitor, and an inhibitor trypsin compound". The Journal of General Physiology. 19 (6): 991–1007. doi:10.1085/jgp.19.6.991. PMC 2141477. PMID 19872978.
- ^ Kraut H, Bhargava N (1964). "Versuche zur Isolierung des Kallikrein-Inaktivators aus Rinderlunge and seine Identifizierung mit dem Inaktivator aus Rinderparotis" [Experiments on the Isolation of the Kallikrein Inactivator. V. The Isolation of a Kallikrein Inactivator From the Bovine Lung and Its Identification With the Inhibitor From the Bovine Parotid Gland]. Hoppe-Seyler's Zeitschrift für Physiologische Chemie (in German). 338: 231–7. doi:10.1515/bchm2.1964.338.1-2.231. PMID 14330402.
- ^ Nugent FW, Warren KW, Jonasson H, Garciadeparedes G (November 1964). "Early Experience With Trasylol in the Treatment of Acute Pancreatitis". Southern Medical Journal. 57 (11): 1317–21. doi:10.1097/00007611-196411000-00012. PMID 14195953. S2CID 5286289.
- ^ Tice DA, Worth MH, Clauss RH, Reed GH (July 1964). "The Inhibition of Trasylol of Fibrinolytic Activity Associated With Cardiovascular Operations". Surgery, Gynecology & Obstetrics. 119: 71–4. PMID 14179354.
- ^ Huber R, Kukla D, Rühlmann A, Epp O, Formanek H (August 1970). "The basic trypsin inhibitor of bovine pancreas. I. Structure analysis and conformation of the polypeptide chain". Die Naturwissenschaften. 57 (8): 389–92. Bibcode:1970NW.....57..389H. doi:10.1007/BF00599976. PMID 5447861. S2CID 6261274.
- ^ Huber R, Kukla D, Bode W, Schwager P, Bartels K, Deisenhofer J, Steigemann W (October 1974). "Structure of the complex formed by bovine trypsin and bovine pancreatic trypsin inhibitor. II. Crystallographic refinement at 1.9 A resolution". Journal of Molecular Biology. 89 (1): 73–101. doi:10.1016/0022-2836(74)90163-6. PMID 4475115.
- ^ Wagner G, Wüthrich K (March 1982). "Sequential resonance assignments in protein 1H nuclear magnetic resonance spectra. Basic pancreatic trypsin inhibitor". Journal of Molecular Biology. 155 (3): 347–66. doi:10.1016/0022-2836(82)90009-2. PMID 6176717.
- ^ Havel TF, Wüthrich K (March 1985). "An evaluation of the combined use of nuclear magnetic resonance and distance geometry for the determination of protein conformations in solution". Journal of Molecular Biology. 182 (2): 281–94. doi:10.1016/0022-2836(85)90346-8. PMID 2582141.
- ^ Deisenhofer J, Steigemann W (1975). "Crystallographic Refinement of the Structure of Bovine Pancreatic Trypsin Inhibitor at 1.5 Angstroms Resolution" (PDF). Acta Crystallographica B. 31: 238. doi:10.1107/S0567740875002415.
- ^ McCammon JA, Gelin BR, Karplus M (June 1977). "Dynamics of folded proteins". Nature. 267 (5612): 585–90. Bibcode:1977Natur.267..585M. doi:10.1038/267585a0. PMID 301613. S2CID 4222220.
- ^ Wüthrich K, Wagner G (February 1975). "NMR investigations of the dynamics of the aromatic amino acid residues in the basic pancreatic trypsin inhibitor". FEBS Letters. 50 (2): 265–8. doi:10.1016/0014-5793(75)80504-7. PMID 234403. S2CID 46084481.
- ^ Creighton TE (1992). Protein Folding. W. H. Freeman. ISBN 978-0-7167-7027-5.
- ^ Xu CY, Zhu HM, Wu JH, Wen H, Liu CJ (February 2014). "Increased permeability of blood-brain barrier is mediated by serine protease during Cryptococcus meningitis". The Journal of International Medical Research. 42 (1): 85–92. doi:10.1177/0300060513504365. PMID 24398759.
- ^ Bojkova, Denisa; Bechtel, Marco; McLaughlin, Katie-May; McGreig, Jake E.; Klann, Kevin; Bellinghausen, Carla; Rohde, Gernot; Jonigk, Danny; Braubach, Peter; Ciesek, Sandra; Münch, Christian; Wass, Mark N.; Michaelis, Martin; Cinatl, Jindrich (2020). "Aprotinin Inhibits SARS-CoV-2 Replication". Cells. 9 (11): 2377. doi:10.3390/cells9112377. ISSN 2073-4409. PMC 7692688.


