카보닐감소
Carbonyl reduction유기 화학에서 카보닐 감소는 환원제에 의한 모든 카보닐 그룹의 유기적 감소다.
대표적인 카보닐 화합물은 케톤, 알데히드, 카르복실산, 에스테르, 산 할로겐화물이다. 카르복실산, 에스테르, 산 할로겐화물은 환원제의 강도에 따라 알데히드로 감소하거나 1차 알코올로 한 단계 더 떨어질 수 있다. 알데히드 및 케톤은 1차 알코올과 2차 알코올로 각각 감소할 수 있다. 탈산소에서는 알코올을 더욱 감소시키고 완전히 제거할 수 있다.
붕소와 알루미늄을 기반으로 한 금속 하이드라이드는 일반적인 환원제다. 촉매 수소화 또한 카보닐을 줄이는 중요한 방법이다. 수용성 하이드라이드 시약이 발견되기 전, 에스테르는 부보-블랑 감소에 의해 감소되었고,[1][2][3] 알코올이 있는 곳에서 나트륨 금속의 혼합물을 사용하였다.[4][5]
알코올에 대한 카르복실산 유도체, 알데히드, 케톤
하이드라이드 환원 메커니즘
메커니즘
금속 하이드라이드 감소를 위한 반응 메커니즘은 카보닐 카본에 하이드라이드를 핵포틸로 첨가하는 것에 기초한다. 경우에 따라서는 알칼리 금속 계통, 특히 Li가+ 카보닐 산소와 조응하여 카보닐 그룹을 활성화시켜 카보닐의 전기생성을 향상시킨다.
카르복실산 유도체를 감소시키는 경우, 알루미늄 하이드라이드 이온에 의해 감소된 후, 알데히드 제품(알코올에 두 번째로 감소할 수 있음):
알데히드와 케톤을 줄이기 위해, 알루미늄 하이드라이드 이온은 화합물을 줄여 알카산화 염을 형성한다. 완전한 감소 후에 알카산화물을 양성하여 알코올 제품을 다음과 같이 제공한다.
카보닐 반응도 추세
케톤은 알데히드보다 반응성이 덜한데, 이는 더 큰 강직 효과 때문이며, 여분의 알킬 그룹이 극성 C=O 결합의 부분 양성 전하에 전자 밀도를 기부할 수 있기 때문이다.[6] 따라서 알데히드는 케톤보다 더 쉽게 감소하고 약한 시약과 약한 조건을 필요로 한다. 카복시산과 에스테르는 이미 극지방인 C=O 결합에 한 쌍을 기부할 수 있는 두 번째 산소 원자의 존재로 더욱 안정화된다. 아킬 할로겐은 카보닐 중에서 가장 안정적이지 못하다. 왜냐하면 할로겐화물은 가난한 전자 기증자일 뿐만 아니라 위대한 이탈 집단이기 때문이다.[7]
카보닐 반응성의 이러한 경향의 결과는 산 할로겐화물과 케톤, 알데히드는 일반적으로 가장 쉽게 감소하는 화합물인 반면, 산과 에스테르는 더 강한 감소를 필요로 한다는 것이다.
금속 하이드라이드 반응성 동향
금속 하이드라이드 환원제의 강도에 기여하는 4가지 주요 요인은 다음과 같다. 첫째, 카운터 이온의 카보닐 활성화 능력은 카보닐 산소와 얼마나 잘 조응할 수 있느냐에 달려 있다. 리튬은 나트륨보다 작고 전기영양성이 강해 훨씬 강하게 조정하고 카보닐을 더 활성화시킨다.[8] 다중 전하(Mg, Al, Zn 등)를 가질 수 있는 금속은 높은 전하 밀도를 가진 양이온을 형성하고, 따라서 Na보다+ 강한 활성제이기도 하다.[9]
둘째, 중심 금속은 환원제의 강도에 영향을 미칠 수 있다. 알루미늄은 붕소보다 크기 때문에 공격하기 더 자유로운 하이드라이드에 더 약하게 결합된다. 따라서 알루미늄 하이드라이드는 붕수화물보다 환원기가 더 좋다.[10] 세 번째 요인인 스테릭스는 특정 대체 하이드라이드(하나 이상의 하이드라이드가 대체물로 대체되는 하이드라이드)를 다른 금속 하이드라이드보다 훨씬 약한 환원제로 만드는 것이다. 예를 들어, 삼산화수소나트륨(NaBH(OAc)3은 알데히드를 선택적으로 감소시키고 덜 반응하는 케톤을 그대로 둘 수 있다.[11]
마지막으로 대체물은 환원제의 반응성에 다른 영향을 미칠 수 있다: 아세톡시 그룹은 스테릭 벌크를 통해뿐만 아니라 전자 인출이기 때문에 NaBH(3OAc)의 감소 전력을 방해한다. 사이아노 집단은 환원제도 저해하는 반면 알킬집단과 같은 전자기증 집단은 감원시 원치 않는 재배열을 방지할 수 있을 만큼 강력한 핵성분인 초수화물(리튬 3에틸보로무수화물) 등 개량할 수 있다.
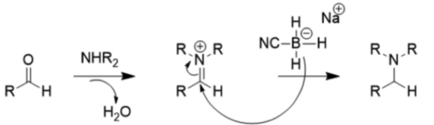
이러한 대체 효과 때문에, NaBHCN은3 중간 pH (>4)에서는 매우 불량한 환원제이기 때문에 아래와 같이 카보닐 감소보다 환원성 아미네이션을 선호한다.
상대적으로 약한 환원제인 붕산나트륨은 일반적으로 케톤과 알데히드를 줄이는 데 사용된다. 왜냐하면 리튬 하이드라이드와 달리 많은 기능군(니트로 그룹, 니트릴, 에스테르)을 허용하고 용매로서 물이나 에탄올과 함께 사용할 수 있기 때문이다.[12] 리튬 알루미늄 하이드라이드와 디이소부틸루미늄 하이드라이드, L-셀렉트라이드, 디보레인, 디아진, 알루미늄 하이드라이드 등의 강력한 환원기도 알데히드와 케톤을 감소시킬 수 있지만 위험하고 격렬하게 반응하기 때문에 바람직하지 않다.[13] 그러나 이러한 화합물은 탄산염과 에스테르를 알코올로 줄이는 데 유용하다. 왜냐하면 붕산나트륨은 그렇게 할 만큼 강력하지 않기 때문이다.
다음 표는 어떤 카보닐 기능 그룹이 어떤 환원제를 통해 감소될 수 있는지를 보여준다(이들 시약들 중 일부는 반응 조건에 따라 효능이 다르다).
알데히드에 대한 카르복실산 유도체
금속 하이드라이드 사용
약한 환원제(NaBH4)는 상대적으로 안정된 에스테르와 카르복실산을 감소시킬 수 없고, 강한 환원제(LiAlH4)는 형성된 알데히드를 즉시 알코올로 감소시키기 때문에 카복실산 유도체로부터 알데히드를 형성하는 것은 종종 어려운 일이다.[14]
산성염화물은 알데히드나 케톤에 비해 안정성이 떨어지기 때문에 알데히드 합성 시 강직적으로 장애가 있는 무수분해제와 함께 사용하는 경우가 많은데, 상대적으로 약한 환원제는 산성염화물 시동물질과 우선적으로 반응해 알데히드 제품이 반응하지 않기 때문이다. 환원제 DIBAL-H(Diisobutyluminium hydriide)는 이러한 목적으로 자주 사용된다. 일반적으로 모든 카보닐을 감소시키지만, 저온에서 단 하나의 동등한 물질만 사용한다면 알데히드에서의 감소를 멈출 수 있다.[15] LiAl(OtBu)3 (LiAlH4 및 tBu에서 형성됨또한 현장 OH)는 DIBAL-H와 유사한 메커니즘을 통해 알데히드에서 감소를 중지할 수 있다.[16]
대체 방법
알코올로 줄이지 않고 알데히드를 형성하는 전통적인 방법은 - 방해된 하이드라이드와 반응성 카보닐을 사용하여 - 좁은 기질 범위와 반응 조건에 대한 큰 의존성에 의해 제한된다. 이 방법을 피하기 위한 한 가지 해결책은 카복실산 유도체를 알코올까지 감소시킨 다음 알코올을 다시 알데히드로 산화시키는 것이다. 다른 대안으로는 티오에스터 또는 와인레브 아미드를 형성한 다음, 각각 후쿠야마 환원 또는 와인레브 반응을 통해 신종을 알데히드로 환원하거나 로젠문트 반응에서와 같이 촉매 수소화를 사용하는 것이 있다.
후쿠야마 환원에서는 우선 티올(에스테르화와 유사한 메커니즘을 가진)을 첨가하여 카르복실산을 티오에스터로 변환한다.[17] 그리고 나서 티오에스터는 팔라듐 촉매를 가진 실릴 하이드라이드에 의해 알데히드로 환원된다.
와인레브 반응에서, 염화 아킬은 먼저 와인레브 아미드(Weinreb amide)로 변환된 다음, 케톤을 형성하기 위한 유기농법 시약이나 알데히드를 형성하기 위한 리튬 알루미늄 하이드라이드로 처리된다.[18]
Weinreb amide는 금속 하이드라이드 감소를 통해 형성되는 전기영양성 카보닐이 아니라 안정된 첼레이트(chelate)를 통해 감소된다. 따라서 첼레이트(chelate)는 아래 그림과 같이 한 번만 감소한다.
로젠문트 반응은 황산바륨에 팔라듐 촉매를 가진 수소 가스를 이용해 아킬 염소화물을 알데히드로 줄여 표면적이 작아 과잉 저감을 방지한다.[19]
알칸에 알데히드 및 케톤
알데히드나 케톤은 알코올뿐 아니라 알칸으로도 줄일 수 있다. 이러한 변형에 대한 일부 반응은 클렘멘슨 감소(강력한 산성 조건에서의)와 울프키슈너 감소(강력한 기초 조건에서의)뿐만 아니라 울프키슈너 반응의 다양한 수정도 포함한다. 예를 들어 칼리오티 수정은 기초가 없는 온화한 조건에서 하이드라이드 공여자가 있는 토실하이드라존을 사용한다. [20]마이어스 수정은 하이드라진을 bis(tert-butyldimethilyl)-hydrazine으로 대체하고 상온에서 온화한 조건을 사용하며 빠르고 효율적이다.[21]
방향족 카보닐
향기로운 탄수화물은 알리파 화합물보다 각각의 알칸으로 더 쉽게 환원된다.[22] 예를 들어, 케톤은 촉매 수소화[23][24] 또는 경미한 조건에서 버치 감소에[25] 의해 각각의 알킬 벤젠으로 감소한다.
α,β-불포화 카보닐
α, β-감소(결합 감소라고도 함)에서 기질은 α, β-불포화 카보닐, 에논 또는 에널이다.
이 기판이 줄어들면 아군 알코올을 생산하는 1,2저감량은 포화 케톤이나 알데히드를 형성하는 1,4저감소와 경쟁하게 된다. 다음의 NaBH4 감소 에논은 두 가지 가능한 제품을 보여준다:[12] 첫째는 1,4 감소에서 둘째는 1,2 감소에서.
에논 기질을 강직하게 방해할수록 1,2 감소 가능성이 높아진다.[12] 또한 선택적으로 알코올을 형성하고 1,4 제품을 피하기 위해 Luche 반응은 더 작은 분자 Ce(BH4)3 (NaBH와4 Cecl이3 결합된 상태에서 파생됨)를 수화원으로 사용한다.[26]
수화원 Zn(BH4)2은 또한 1.2 선택성과 더불어 더 큰 이질회수성을 보여준다; 그것은 카보닐 산소뿐만 아니라 인접한 원자에도 조정함으로써 그렇게 한다.[27]
입체도
탈지극감소
사이클로헥사논의 감소에서 수인원은 축으로 공격하여 적도 알코올을 생산하거나, 적도로 공격하여 축 알코올을 생산할 수 있다. 축방향 공격(빨간색으로 표시됨)에서 하이드라이드는 1,3-디아xial 변형에 부딪친다. 적도 공격(파란색으로 표시)에서 하이드라이드는 1,3-디아xial 상호작용을 피하지만, 새로 형성된 알코올과 첨가된 수소 원자가 반응 중간에서 서로 일식할 때(축 알코올에 대한 뉴먼 투영에서 볼 수 있듯이) 기질은 불리한 비틀림 스트레인을 겪는다.
LiBH(MechCHMe2)3와 같은 대형 환원제는 1,3축 상호작용에 의해 방해받아 적도를 공격한다.[12] 작은 분자에 대한 1,3-디아xial 교호작용이 미미하기 때문에 NaBH와4 같은 작은 환원제는 축방향으로 우선 공격한다. 스테레오 전자적 이유 또한 소형 환원제의 축 선호도에 대해 언급되어 왔다.[28] 그러나 기질을 부피가 커지게 만들면(1,3축 상호작용 증가) 축 공격의 유병률이 감소하며, 심지어 소수 수분체 기증자의 경우에도 감소한다.[29]
항저항감소
비대칭 케톤이 줄어들면 결과적으로 발생하는 2차 알코올은 치랄 촉매로 조절할 수 있는 치랄 중심을 갖게 된다.
비대칭 합성에서 잘 알려진 카보닐 감소는 노요리 비대칭 수소화(베타-케토에스터 감소/Ru/BINAP)와 CBS 감소(BH3, 프롤라인 유도 치랄 촉매)이다.
참고 항목
참조
- ^ Bouveault, Louis; Blanc, Gustave Louis (1903). "Préparation des alcools primaires au moyen des acides correspondants" [Preparation of primary alcohols by means of the corresponding acids]. Compt. Rend. (in French). 136: 1676–1678.
- ^ Bouveault, Louis; Blanc, Gustave Louis (1903). "Préparation des alcools primaires au moyen des acides correspondants" [Preparation of primary alcohols by means of the corresponding acids]. Compt. Rend. (in French). 137: 60–62.
- ^ Bouveault, Louis; Blanc, Gustave Louis (1904). "Transformation des acides monobasiques saturés dans les alcools primaires correspondants" [Transforming saturated monobasic acids into the corresponding primary alcohols]. Bull. Soc. Chim. Fr. (in French). 31: 666–672.
- ^ Moffett, Robert Bruce (1953). "2-(1-Pyrrolidyl)propanol". Organic Syntheses. 33: 82. doi:10.15227/orgsyn.033.0082.; Collective Volume, vol. 4, p. 834
- ^ McMurry, John E. (1973). "Isoxazole Annelation Reaction: 1-Methyl-4,4a,5,6,7,8-hexahydronaphthalen-2(3H)-one". Organic Syntheses. 53: 70. doi:10.15227/orgsyn.053.0070.; Collective Volume, vol. 6, p. 781
- ^ Roche, Alex. "Ketones and Aldehydes" (PDF). Rutgers University. Retrieved December 1, 2015.
- ^ Clayden, Jonathan (2012). Organic Chemistry. OUP Oxford. p. 200. ISBN 978-0199270293.
- ^ König, Burkhard (2009). "Reduction Reactions" (PDF). Modern Methods in Organic Synthesis. Institut für Organische Chemie, Uni Regensburg. Retrieved December 1, 2015.
- ^ Cox, Liam (2007). "Nucleophilic Addition Reactions of Aldehydes and Ketones" (PDF). University of Birmingham. Retrieved December 1, 2015.
- ^ Sweeting, Linda M. (2001). "Reducing Agents". Towson University. Archived from the original on November 16, 2015. Retrieved December 1, 2015.
- ^ Gribble, Gordon W.; Ferguson, Duncan C. (January 1975). "Reactions of sodium borohydride in acidic media. Selective reduction of aldehydes with sodium triacetoxyborohydride". Journal of the Chemical Society, Chemical Communications (13): 535–536. doi:10.1039/C39750000535.
- ^ a b c d Banfi, Luca; Narisano, Enrica; Riva, Renata (2001-01-01). Sodium Borohydride. John Wiley & Sons, Ltd. doi:10.1002/047084289x.rs052. ISBN 9780470842898.
- ^ Chaikin, Saul W.; Brown, Weldon G. (1949-01-01). "Reduction of Aldehydes, Ketones and Acid Chlorides by Sodium Borohydride". Journal of the American Chemical Society. 71 (1): 122–125. doi:10.1021/ja01169a033. ISSN 0002-7863.
- ^ Gaylord, Norman G. (1957-08-01). "Reduction with complex metal hydrides". Journal of Chemical Education. 34 (8): 367. Bibcode:1957JChEd..34..367G. doi:10.1021/ed034p367.
- ^ Zakharkin, L.I.; Khorlina, I.M. (1962). "Reduction of esters of carboxylic acids into aldehydes with diisobutylaluminium hydride". Tetrahedron Letters. 3 (14): 619–620. doi:10.1016/s0040-4039(00)70918-x.
- ^ Cortes, Sergio (2010). "Using Hydrogen as a Nucleophile in Hydride Reductions" (PDF). Dr. Sergio Cortes' Organic Chemistry Page. University of Texas at Dallas. Retrieved December 1, 2015.
- ^ Fukuyama, Tohru; Lin, Shao Cheng; Li, Leping (1990-09-01). "Facile reduction of ethyl thiol esters to aldehydes: application to a total synthesis of (+)-neothramycin A methyl ether". Journal of the American Chemical Society. 112 (19): 7050–7051. doi:10.1021/ja00175a043. ISSN 0002-7863.
- ^ Nahm, Steven; Weinreb, Steven M. (1981). "N-methoxy-n-methylamides as effective acylating agents". Tetrahedron Letters. 22 (39): 3815–3818. doi:10.1016/s0040-4039(01)91316-4.
- ^ Mosettig, Erich; Mozingo, Ralph (2004-01-01). The Rosenmund Reduction of Acid Chlorides to Aldehydes. John Wiley & Sons, Inc. doi:10.1002/0471264180.or004.07. ISBN 9780471264187.
- ^ Caglioti, L.; Magi, M. (1963-01-01). "The reaction of tosylhydrazones with lithium aluminium hydride". Tetrahedron. 19 (7): 1127–1131. doi:10.1016/S0040-4020(01)98571-0.
- ^ Furrow, Michael E.; Myers, Andrew G. (2004-05-01). "Practical Procedures for the Preparation of N-tert-Butyldimethylsilylhydrazones and Their Use in Modified Wolff−Kishner Reductions and in the Synthesis of Vinyl Halides and gem-Dihalides". Journal of the American Chemical Society. 126 (17): 5436–5445. doi:10.1021/ja049694s. ISSN 0002-7863. PMID 15113215.
- ^ Nishimura, Shigeo (2001). Handbook of Heterogeneous Catalytic Hydrogenation for Organic Synthesis (1st ed.). New York: Wiley-Interscience. p. 583. ISBN 9780471396987.
- ^ Zaccheria, Federica; Ravasio, Nicoletta; Ercoli, Mauro; Allegrini, Pietro (2005). "Heterogeneous Cu-catalysts for the reductive deoxygenation of aromatic ketones without additives". Tetrahedron Letters. 46 (45): 7743–7745. doi:10.1016/j.tetlet.2005.09.041.
- ^ Walker, Gordon (1956). "Reduction of Enols. New Synthesis of Certain Methoxybenzsuberenes via Hydrogenation of Dehydroacetic Acids". Journal of the American Chemical Society. 78 (13): 3201–3205. doi:10.1021/ja01594a062.
- ^ Hall, Stan; Lipsky, Sharon; McEnroe, Frank; Bartels, Anne (1971). "Lithium-ammonia reduction of aromatic ketones to aromatic hydrocarbons". The Journal of Organic Chemistry. 36 (18): 2588–2591. doi:10.1021/jo00817a004.
- ^ Laszlo Kurti, Barbara Czako ISBN 0-12-429785-4의 유기합성(Paperback)에서 명명된 반응의 전략적 응용
- ^ Greeves, Nick (2015). "Diastereoselective Ketone Reduction". ChemTube3D. University of Liverpool. Retrieved December 1, 2015.
- ^ Wong, Stephen S.; Paddon-Row, Michael N. (January 1990). "Theoretical evidence in support of the Anh?Eisenstein electronic model in controlling ?-facial stereoselectivity in nucleophilic additions to carbonyl compounds". Journal of the Chemical Society, Chemical Communications (6): 456–458. doi:10.1039/c39900000456.
- ^ Krishnamurthy, S.; Brown, Herbert C. (1976-05-01). "Lithium trisiamylborohydride. A new sterically hindered reagent for the reduction of cyclic ketones with exceptional stereoselectivity". Journal of the American Chemical Society. 98 (11): 3383–3384. doi:10.1021/ja00427a061. ISSN 0002-7863.