종양 M2-PK
Tumor M2-PK종양 M2-PK는 종양 대사 내 핵심 효소인 피루바이트 키나아제 이소엔자임 타입 M2(PKM2)의 희미한 형태와 동의어다.종양 M2-PK는 PSA와 같은 장기별 종양 표식기가 아니라 많은 종양 유형에서 상승할 수 있다.대장종양 선별 방법으로 대변(혈관) 수치 증가가 조사되고 있으며, EDTA 혈장 수치도 다양한 암의 후속 치료에서 적용 가능한 검사를 받고 있다.
구체적으로 Tumor M2-PK(M2-PK의 조광 형태)를 인식하는 두 개의 단핵 항체를 기반으로 하는 샌드위치 ELISA는 각각 대변 및 EDTA-plasma 검체에서 Tumor M2-PK의 정량화를 위해 사용할 수 있다.바이오마커로서 대변과 EDTA 플라즈마에서 종양 M2-PK의 양은 종양의 특정 대사 상태를 반영한다.
대장종양 및 용종 조기 발견
대변에서 측정된 M2-PK는 대장암의 잠재적 종양 표식이다.컷오프 값이 4U/ml인 대변에서 측정했을 때 민감도는 대장암의 경우 85%(신뢰 구간 65~96%), 직장암의 경우 56%(신뢰 구간 41~74%)로 추정됐다.[1]그것의 특수성은 95%이다.[2]
M2-PK 검사는 암혈(ELISA 방법)에 의존하지 않기 때문에 출혈이나 비출혈 장암을 검출할 수 있으며, 또한 거짓 음성 없이 민감도와 특이성이 높은 용종도 검출할 수 있으나 거짓 양성반응이 나타날 수 있다.[3]
대부분의 사람들은 비침습적 예방 의료 검진을 기꺼이 받아들인다.따라서 대변 검체에서 종양 M2-PK의 양성 결과를 명확히 하기 위한 대장내시경 검사에 의한 추적검사를 통해 종양 M2-PK의 측정은 대장암 조기 발견의 진전으로 판명될 수 있다.CE 마크 M2-PK 시험은 ELISA 정량적 결과를 위한 테스트 또는 몇 분 이내에 결과를 수신하기 위한 관리 지점 테스트의 형태로 이용할 수 있다.
종양 M2-PK는 폐암 진단에도 유용하며 SCC와 NSE 종양 표지자보다 우수하다.[4]신장세포암(RCC)이 있는 경우 M2PK 검사는 전이성 RCC의 경우 66.7%, 비 전이성 RCC의 경우 27.5%의 민감도를 갖지만 M2PK 검사는 방광의 전이성 세포암, 전립선암, 양성 전립선 비대증 등을 검출할 수 없다.[5]
암 후속 조치
다양한 국제 워킹 그룹의 연구는 종양 단계와 상관관계가 있는 흑색종뿐만 아니라 신장, 폐, 유방, 자궁경부 및 위장 종양(오소파거스, 위, 췌장, 대장, 직장) 환자의 EDTA 플라스마 검체에서 종양 M2-PK의 양이 현저히 증가했음을 밝혀냈다.
Tumor M2-PK와 장암의 경우 CEA, 췌장암의 경우 CA 19-9, 위암의 경우 CA 72-4 등 적절한 클래식 종양 마커의 조합은 각종 암을 검출할 수 있는 민감도를 크게 높인다.
EDTA-plasma에서 Tumor M2-PK 테스트의 중요한 적용은 종양 치료 중 후속 치료, 선택된 치료의 성패 모니터링, "치유"와 생존 가능성을 예측하는 것이다.
치료 중 종양 M2-PK 수치가 감소하고 치료 후에도 낮은 상태를 유지하면 성공적인 치료를 가리킨다.치료 중 또는 치료 후 종양 M2-PK 값이 증가하면 재발 및/또는 전이가 나타난다.
종양 M2-PK 값이 증가하면 심한 염증성 질환에서도 간혹 발생할 수 있는데, 이는 차등 진단에 의해 제외되어야 한다.
4중 및 조광 PKM2
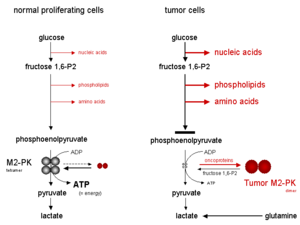
Pyruvate kinase는 글리콜리틱 시퀀스 내의 마지막 단계인 인산염피루베이트를 피루베이트에 대한 탈인산화를 촉진하고 글리콜리틱 경로 내에서 순에너지 생산을 담당한다.조직의 서로 다른 대사 기능에 따라, 화농산 키나아제의 다른 이소엔자임들이 표현된다.
M2-PK(PKM2)는 섬유소, 배아 세포 및 성체 줄기세포와 같은 세포 증식 시 주로 사용되는 피루브레이트 키나아제 등소형이며 폐, 방광, 신장, 흉선을 포함한 대부분의 인체 조직이다. M2-PK는 많은 인간 종양에서 분포를 이루고 있다.[6]
M2-PK는 증식 세포에서 두 가지 다른 형태로 발생할 수 있다.
- 4개의 서브유닛으로 구성된 사선형.
- 2개의 하위 유니트로 구성된 희미한 형태
M2-PK의 4중형 형태는 기질인 인에노폴피루베이트(PEP)에 친화력이 높으며 생리학적 PEP 농도에 매우 활발하다.게다가, M2-PK의 4중형 형태는 소위 글리코화 효소 복합체 내에 있는 여러 다른 글리코화 효소와 연관되어 있다.효소의 근접성 때문에 글리콜리틱 효소 복합체 내의 연관성은 포도당을 젖산염으로 매우 효과적으로 전환시킨다.M2-PK가 대부분 정상세포에서 흔히 볼 수 있는 활동성이 높은 4중격 형태일 때 포도당은 대부분 젖산염으로 전환되며 에너지의 동반생산이 이루어진다.
이와는 대조적으로 M2-PK의 조광성 형태는 인산염피루베이트에 대한 친화력이 낮으며 생리학적 PEP 농도에서 거의 활동하지 않는다.M2-PK가 주로 종양 세포의 경우인 조광체 형태일 때, 피루베이트 키나아제 위의 모든 인광산염은 축적되어 핵산, 인지질, 아미노산과 같은 글리코알화 중간체로부터 분지되는 합성 과정으로, 티와 같은 고증식 세포의 중요한 세포 구성 블록이다.우머 세포들
글리콜리시스 내 피루베이트키나아제의 주요 위치의 결과로, Tetramer : M2-PK의 조광비율은 포도당 탄화수소가 에너지 생산(테트라메릭 형태)과 함께 피루베이트와 젖산염으로 전환되는지 또는 합성 공정(디메릭 형태)으로 샹넬링되는지 여부를 결정한다.종양 세포에서 M2-PK는 주로 조광체 형태다.따라서 M2-PK의 희미한 형태는 Tumorm M2-PK라고 불렸다.
종양 세포에서 M2-PK의 조광화는 M2-PK와 서로 다른 종양 세포의 직접적인 상호작용에 의해 유도된다.
단, M2-PK의 테트라머 : 조광기 비율은 일정하지 않다.
과당 1,6-비스포산염(과당 1,6-P2)이나 아미노산 세린과 같은 산소 결핍 또는 고도로 축적된 당화 중간체는 M2-PK의 조광 형태의 4중 형으로 재분석을 유도한다.결과적으로 M2-PK의 활성화로 인해 과당 1,6-P2 수준이 특정 임계값 아래로 떨어질 때까지 에너지 생산 하에서 포도당은 화농산염과 젖산염으로 변환되어 M2-PK의 사중상 형태를 조광체 형태로 분리할 수 있게 된다.이후 과당 1,6-P2 레벨이 M2-PK의 사선화를 유도하는 특정 상한 임계값에 도달하면 진동 주기가 다시 시작된다.
M2-PK가 주로 덜 활동적인 조광체 형태일 때 아미노산 글루타민이 아스파테, 화루베이트, 젖산염으로 분해되어 에너지가 생성되는데, 이를 글루타미노분해라고 한다.
종양 세포에서는 산소가 존재하는 곳에서 젖산염의 증가율을 워버그 효과라고 부른다.
돌연변이
피루바이트 키나제 M2 효소가 암에 걸리기 쉬운 블룸 증후군 환자의 세포에서 발견된 H391Y와 K422R이라는 두 가지 오감 돌연변이와 함께 처음으로 보고되었다.결과에 따르면 K422R과 H391Y 돌연변이 단백질은 단위 간 접촉 영역에 돌연변이가 존재함에도 불구하고 야생형 단백질과 유사한 동음극 구조를 유지했지만 각각 75%, 20%의 활동 손실을 보였다.H391Y는 기질 인산염피루베이트에 대한 친화력이 6배 증가했으며, 협력 결합이 손상된 비알로스테릭 단백질처럼 행동했다.그러나 인산염피루브산염에 대한 친화력은 K422R에서 현저히 상실되었다.K422R과 달리 H391Y는 열 안정성, pH 값의 범위에 걸친 안정성, 알로스테릭 억제제 Phe의 덜 효과, 활성제(과당 1,6-비스포산염)와 억제제(Phe) 결합 시 구조적 변화에 대한 저항성을 보였다.두 돌연변이 모두 pH 최적값이 7.4에서 7.0으로 약간 이동했다.[7]모노머 수준에서 두 사람 사이의 상호작용을 유발하는 세포 환경에서 호모테트라메릭 야생형과 돌연변이 PKM2의 공동 표현은 시험관내 실험에 의해 더욱 입증되었다.교차 모노머 상호작용은 조광화와 이질화 방식을 선호하여 PKM2의 과점 상태를 크게 변화시켰다.실리코 연구는 이성질체화가 활기차게 유리하다는 것을 보여주는 추가적인 지원을 제공했다.PKM2의 이질성-고질성 개체군은 활동성과 친화력을 변화시켰고, 이들의 표현은 다형성 증가율과 함께 포유류 세포뿐만 아니라 대장균 성장률을 증가시키는 결과를 낳았다.이러한 특징들은 종양 진행에 필수적인 것으로 알려져 있다.[8]
잠재적 다기능 단백질
참고 항목
참조
- ^ Haug, U.; Rothenbacher, D.; Wente, M. N.; Seiler, C. M.; Stegmaier, C.; Brenner, H. (2007). "Tumour M2-PK as a stool marker for colorectal cancer: Comparative analysis in a large sample of unselected older adults vs colorectal cancer patients". British Journal of Cancer. 96 (9): 1329–34. doi:10.1038/sj.bjc.6603712. PMC 2360192. PMID 17406361.
- ^ 4004.pdf Wayback Machine에 2014-10-09 보관
- ^ "Tumor M2-PK Stool Test". Retrieved June 8, 2013.
- ^ Oremek, G; Kukshaĭte, R; Sapoutzis, N; Ziolkovski, P (2007). "The significance of TU M2-PK tumor marker for lung cancer diagnostics". Klinicheskaia Meditsina. 85 (7): 56–58. PMID 17882813.
- ^ Roigas J, Schulze G, Raytarowski S, Jung K, Schnorr D, Loening SA. (September 2001). "Tumor M2 pyruvate kinase in plasma of patients with urological tumors". Tumour Biol. 22 (5): 282–5. doi:10.1159/000050628. PMID 11553857. S2CID 46855687.
{{cite journal}}: CS1 maint : 복수이름 : 작성자 목록(링크) - ^ Bluemlein K, Grüning NM, Feichtinger RG, Lehrach H, Kofler B, Ralser M (2011). "No evidence for a shift in pyruvate kinase PKM1 to PKM2 expression during tumorigenesis". Oncotarget. 2 (5): 393–400. doi:10.18632/oncotarget.278. PMC 3248187. PMID 21789790.
- ^ Akhtar K, Gupta V, Koul A, Alam N, Bhat R, Bamezai RN (May 2009). "Differential behavior of missense mutations in the intersubunit contact domain of the human pyruvate kinase M2 isozyme". J. Biol. Chem. 284 (18): 11971–81. doi:10.1074/jbc.M808761200. PMC 2673266. PMID 19265196.
- ^ Gupta V, Kalaiarasan P, Faheem M, Singh N, Iqbal MA, Bamezai RN (May 2010). "Dominant negative mutations affect oligomerization of human pyruvate kinase M2 isozyme and promote cellular growth and polyploidy". J. Biol. Chem. 285 (22): 16864–73. doi:10.1074/jbc.M109.065029. PMC 2878009. PMID 20304929.
- ^ Gupta V, Bamezai RN (Sep 2010). "Human pyruvate kinase-M2: "A multi-functional protein"". Protein Sci. 19 (11): 2031–44. doi:10.1002/pro.505. PMC 3005776. PMID 20857498.
걸상
- Hardt PD, Mazurek S, Toepler M, Schlierbach P, Bretzel RG, Eigenbrodt E, Kloer HU (2004). "Faecal tumour M2 pyruvate kinase: a new, sensitive screening tool for colorectal cancer. Brit. J". Cancer. 91 (5): 980–984. doi:10.1038/sj.bjc.6602033. PMC 2409989. PMID 15266315.
- Koss K, Maxton D, Jankowski JAZ.대장암(CRC) 검사에 대변 조광제 M2 피루바이트 키나아제(Tumor M2-PK)의 잠재적 사용.2005년 5월 소화기 질환 주간에서 발췌; 미국 시카고.
- 맥 로플린 R, 시엘 E, 세바스찬 S, 라이언 B, 오코너 HJ, 오모레인 C.대장암 검진 도구인 종양 M2-PK.2005년 5월, 시카고/미국 소화기병 주간에서 발췌
플라즈마
- Cerwenka H, Aigner R, Bacher H, Werkgartner G, El-Shabrawi A, Quehenberger F, Mischinger HJ (1999). "TUM2-PK (pyruvate kinase type tumor M2), CA19-9 and CEA in patients with benign, malignant and metastasizing pancreatic lesions". Anticancer Res. 19 (1B): 849–52. PMID 10216504.
- Kaura B, Bagga R, Patel FD (2004). "Evaluation of the pyruvate kinase isoenzyme tumor (Tu M2-PK) as a tumor marker for cervical carcinoma". J. Obstet. Gynaecol. Res. 30 (3): 193–196. doi:10.1111/j.1447-0756.2004.00187.x. PMID 15210041. S2CID 31214841.
- Kim CW, Kim JI, Park SH, et al. (November 2003). "Usefulness of plasma tumor M2-pyruvate kinase in the diagnosis of gastrointestinal cancer". The Korean Journal of Gastroenterology = Taehan Sohwagi Hakhoe Chi. 42 (5): 387–93. PMID 14646575.
- Lüftner D, Mesterharm J, Akrivakis C, Geppert R, Petrides PE, Wernecke KD, Possinger K (2000). "Tumor M2-pyruvate kinase expression in advanced breast cancer". Anticancer Res. 20 (6D): 5077–5082. PMID 11326672.
- Oremek GM, Teigelkamp S, Kramer W, Eigenbrodt E, Usadel KH (1999). "The pyruvate kinase isoenzyme tumor M2 (Tu M2-PK) as a tumor marker for renal carcinoma". Anticancer Res. 19 (4A): 2599–2601. PMID 10470201.
- Schneider J, Morr H, Velcovsky HG, Weisse G, Eigenbrodt E (2000). "Quantitative detection of tumor M2-pyruvate kinase in plasma of patients with lung cancer in comparison to other lung diseases". Cancer Detection and Prevention. 24 (6): 531–5. PMID 11198266.
- Schneider J, Schulze G (2003). "Comparison of Tumor M2-pyruvate kinase (Tumor M2-PK), carcinoembryonic antigen (CEA), carbohydrate antigens CA 19-9 and CA 724 in the diagnosis of gastrointestinal cancer". Anticancer Res. 23 (6D): 5089–5095. PMID 14981971.
- Ugurel S, Bell N, Sucker A, Zimpfer A, Rittgen W, Schadendorf D (2005). "Tumor type M2 pyruvate kinase (TuM2-PK) as a novel plasma tumor marker in melanoma". Int. J. Cancer. 117 (5): 825–830. doi:10.1002/ijc.21073. PMID 15957165.
- Ventrucci M, Cipolla A, Racchini C, Casadei R, Simoni P, Gullo L (2004). "Tumor M2-pyruvate kinase, a new metabolic marker for pancreatic cancer". Dig. Dis. Sci. 49 (7–8): 1149–1155. doi:10.1023/B:DDAS.0000037803.32013.aa. PMID 15387337. S2CID 1237419.
- Wechsel HW, Petri E, Bichler KH, Feil G (1999). "Marker for renal carcinoma (RCC): The dimeric form of pyruvate kinase type M2 (Tu M2-PK)". Anticancer Res. 19 (4A): 2583–2590. PMID 10470199.
- Zhang B, Chen JY, Chen DD, Wang GB, Shen P (2004). "Tumor type M2 pyruvate kinase expression in gastric cancer, colorectal cancer and controls". World J. Gastroenterol. 10 (11): 1643–1646. doi:10.3748/wjg.v10.i11.1643. PMC 4572770. PMID 15162541.
과학적 배경
- Mazurek S, Boschek CB, Hugo F, Eigenbrodt E (2005). "Pyruvate kinase type M2 and its role in tumor growth and spreading". Semin. Cancer Biol. 15 (4): 300–308. doi:10.1016/j.semcancer.2005.04.009. PMID 15908230.