궤도 교배
Orbital hybridisation화학에서 궤도 혼성화(or hybridization)는 원자가 결합 이론에서 화학 결합을 형성하기 위해 전자 쌍에 적합한 새로운 혼성 궤도(원자 궤도 성분과 다른 에너지, 모양 등을 가진)를 형성하기 위해 원자 궤도를 혼합하는 개념이다.예를 들어 4개의 단일결합을 형성하는 탄소원자에서 원자가껍질 오비탈은 3개의 원자가껍질 p 오비탈과 결합해 4개의 다른 원자에 결합하기 위해 탄소 주위에 사면체 배열로 4개의 등가스펙3 혼합물을 형성한다.하이브리드 오비탈은 분자 기하학과 원자 결합 특성을 설명하는 데 유용하며 공간에 대칭적으로 배치됩니다.일반적으로 하이브리드 오비탈은 동등한 [1]에너지의 원자 오비탈을 혼합하여 형성됩니다.
이력 및 용도
화학자 라이너스 폴링은 1931년 원자 [2]궤도를 이용한 메탄(CH)과4 같은 단순한 분자의 구조를 설명하기 위해 하이브리드화 이론을 처음 개발했다.폴링은 탄소 원자가 1개의 s와 3개의 p 오비탈을 사용하여 4개의 결합을 형성하고, 따라서 탄소 원자가 직각으로 3개의 결합을 형성하고 (p 오비탈을 사용하여) 임의의 방향으로 s 오비탈을 사용하여 4번째 약한 결합을 형성할 것이라고 "추정할 수 있다"고 지적했다.실제로 메탄은 4개의 동등한 강도를 가진 C-H 결합을 가지고 있다.두 결합 사이의 각도는 109°28'([3]약 109.5°)의 사면체 결합 각도이다.폴링은 4개의 수소 원자가 존재할 때, s와 p 오비탈이 그가 하이브리드 오비탈이라고 부르는 4개의 동등한 조합을 형성한다고 가정했다.각 하이브리드는 그 조성을 나타내기 위해 sp로 표시되며3, 4개의 C-H [4]결합 중 하나를 따라 유도된다.이 개념은 그러한 단순한 화학 시스템을 위해 개발되었지만, 그 접근법은 나중에 더 광범위하게 적용되었고, 오늘날에는 유기 화합물의 구조를 합리화하는 데 효과적인 발견적 접근법으로 여겨지고 있다.이것은 루이스 구조물과 동등한 단순한 궤도 그림을 제공한다.
하이브리드 이론은 유기 화학의 필수적인 부분이며, 가장 설득력 있는 예 중 하나는 Baldwin의 법칙입니다.반응 메커니즘을 그리기 위해서는 두 개의 원자가 두 개의 [5]전자를 공유하는 고전적인 결합 그림이 필요할 수 있습니다.잡종화 이론은 알켄과[6] [7]메탄에서의 결합을 설명한다.주로 궤도 교잡에 의해 결정되는 p 문자 또는 s 성질의 양은 산도 또는 염기성 [8]등의 분자 특성을 신뢰성 있게 예측하는 데 사용될 수 있다.
개요
오비탈은 분자 내 전자의 행동을 모델로 표현한 것이다.단순 교잡의 경우, 이 근사치는 슈뢰딩거 방정식이 정확히 풀릴 수 있는 유일한 중성 원자인 수소 원자에 대해 얻어진 것과 유사한 원자 궤도에 기초한다.탄소, 질소, 산소와 같은 무거운 원자에서 사용되는 원자 궤도는 수소의 들뜬 상태 궤도와 유사한 2s 및 2p 궤도다.
하이브리드 궤도는 다양한 비율로 서로 겹치는 원자 궤도의 혼합으로 가정한다.예를 들어 메탄에서 각 탄소-수소 결합을 형성하는 C 하이브리드 오비탈은 25 % s 특성 및 75% p 특성으로 구성되며, 따라서 sp(s-p-3으로 읽음) 교잡으로 설명된다3.양자역학에서는 이 잡종을 N(s + δ3p),) 형태의 sp파함수로3 설명하고 있습니다.여기서 N은 정규화 상수(여기서는 1/2)이고 pθ는 시그마 결합을 형성하기 위해 C-H 축을 따라 향하는 p 궤도입니다.이 예에서는 계수 비율(일반적으로 θ로 표시됨)이 3보다 작습니다.궤도와 관련된 전자밀도는 파동함수의 제곱에 비례하므로 p-문자 대 s-문자 비율은 θ2 = 3이다.p 성분의 p 문자 또는 무게는 Nµ22 = 3/4이다.
하이브리드화의 종류
sp3
하이브리드화는 원자의 관점에서 원자의 결합을 설명한다.4면체배위 탄소(예: 메탄4 CH)의 경우, 탄소는 4개의 수소 원자에 결합하기 위한 정확한 대칭을 가진 4개의 궤도를 가져야 한다.
카본의 접지 상태 구성은 1s2 2s2 2p2 이상입니다.
| C | ↑↓ | ↑↓ | ↑ | ↑ | |
| 1s | 2초 | 2p | 2p | 2p |
탄소 원자는 단독으로 점유된 [contradictory]두 개의 p형 궤도를 사용하여 두 개의 수소 원자와 두 개의 공유 결합을 형성할 수 있으며, 가장 단순한 카르벤인 싱글트 메틸렌2 CH를 생성합니다.탄소 원자는 또한 두 번 점유된 2s 오비탈에서 비어 있는 2p 오비탈로 전자의 들뜸(또는 승격)에 의해 네 개의 수소 원자에 결합할 수 있으며, 네 개의 단일 점유된 오비탈을 생성한다.
| C* | ↑↓ | ↑ | ↑ | ↑ | ↑ |
| 1s | 2초 | 2p | 2p | 2p |
두 개의 추가 결합의 형성에 의해 방출되는 에너지는 필요한 들뜸 에너지를 보상하는 것보다 더 많으며, 에너지적으로 네 개의 C-H 결합의 형성을 선호한다.
양자역학적으로 네 개의 결합이 등가라면 가장 낮은 에너지를 얻을 수 있으며, 이는 탄소상의 등가 궤도로부터 형성되어야 한다.4개의3 sp 하이브리드인 원자가 셸([9]코어 오비탈은 결합에 거의 관여하지 않음) 및 p파 함수의 선형 조합인 4개의 등가 오비탈 세트를 얻을 수 있다.
| C* | ↑↓ | ↑ | ↑ | ↑ | ↑ |
| 1s | sp3 | sp3 | sp3 | sp3 |
CH에서는4 4sp3 하이브리드 오비탈이 수소 1s 오비탈에 의해 중첩되어 길이와 강도가 동일한 4γ(시그마) 결합(단일 공유 결합)을 생성한다.
sp2
다른 탄소화합물과 다른 분자도 비슷한 방식으로 설명될 수 있다.예를 들어 에텐(CH24)은 탄소간에 이중결합을 가진다.
이 분자는 탄소간 이중결합에 1γ(pi)결합이 필요하고 탄소원자당 3γ결합만 형성되기 때문에 탄소sp2 하이브리드가 이루어진다.sp 하이브리제이션에서2 2s 오비탈은 3개의 사용 가능한y 2p 오비탈 중 2개(일반적으로x 2p와 2p로 표시됨)와 혼합된다.세 번째 2p 궤도(2pz)는 교잡되지 않은 상태로 남아 있다.
| C* | ↑↓ | ↑ | ↑ | ↑ | ↑ |
| 1s | sp2 | sp2 | sp2 | 2p |
하나의 남은 p 오비탈과 함께 총 3개의2 sp 오비탈을 형성한다.에틸렌(에틸렌)은 탄소원자별로 1sp2 오비탈을 겹침으로써 2개의 탄소원자가 δ결합을 형성한다.분자평면에 수직인 탄소원자간의 δ결합은 2p~2p의 중첩으로 형성된다.각 탄소 원자는 s–sp2 중첩에 의해 두 개의 수소와 공유 C–H 결합을 형성하며, 모두 결합 각도가 120°이다.수소-탄소 결합은 실험 데이터와 일치하여 모두 강도와 길이가 같다.
sp
삼중 결합을 가진 알킨과 같은 화합물의 화학적 결합은 sp 혼성화에 의해 설명된다.이 모델에서 2s 오비탈은 3개의 p 오비탈 중 하나와 혼합된다.
| C* | ↑↓ | ↑ | ↑ | ↑ | ↑ |
| 1s | sp | sp | 2p | 2p |
결과적으로 두 개의 sp 오비탈과 두 개의 남은 p 오비탈이 생성됩니다.아세틸렌(에틴)(CH22)의 화학적 결합은 δ 결합을 형성하는 두 탄소 원자와 p–p 중첩에 의해 형성된 두 개의 추가 δ 결합 사이의 sp–sp 중첩으로 구성된다.또한 각 탄소는 180° 각도로 µ s-sp 중첩으로 수소에 결합한다.
잡종화 및 분자 모양
결합 사이의 각도가 하이브리드 궤도 사이의 각도와 거의 같기 때문에 하이브리드화는 분자 형태를 설명하는 데 도움이 된다.이는 원자가 결합이나 궤도 [10]이론보다는 경험적 규칙에 기초한 분자 기하학을 예측하는 데 사용될 수 있는 VSEPR(Valence Shell Electron-pair reposition) 이론과 대조적이다.
SP하이브리제x
주족 원소의 원자가 오비탈은 대응하는 옥텟 규칙에 의한 1s 및 3p 오비탈이므로 이들 분자의 형상을 모델화하기 위해 sp 하이브리드가 사용된다x.
| 코디네이션 번호 | 모양. | 하이브리드화 | 예 |
|---|---|---|---|
| 2 | 선형 | sp 하이브리드화(180°) | CO2 |
| 3 | 삼각 평면 | sp2 하이브리드화(120°) | BCL3 |
| 4 | 사면체 | SP하이브리제이션3(180.5°) | CCL4 |
| 궤도간[11] 각도 | |||
SPDxy 하이브리드화
전이 금속의 원자가 오비탈은 5d, 1s, 3p 오비탈이며, 이에 대응하는 18전자 법칙이 적용되므로 이들 분자의 형상을 모델링하기 위해 spdxy 하이브리드화가 사용된다.이들 분자는 관련된 d-오비탈이 다르기 때문에 동일한 교배에 대응하는 여러 형태를 갖는 경향이 있다.정사각형 평면 복합체는 1개의 점유되지 않은 p-궤도를 가지며, 따라서 16개의 원자가 [12]전자를 가진다.
| 코디네이션 번호 | 모양. | 하이브리드화 | 예 |
|---|---|---|---|
| 4 | 정사각형 평면 | SPD2 하이브리드화 | PtCl42− |
| 5 | 삼각 쌍추체 | SPD3 하이브리드화 | Fe(CO)5 |
| 정사각형 피라미드 | MnCl52− | ||
| 6 | 팔면체 | SPD32 하이브리드화 | 모(CO)6 |
| 7 | 오각쌍뿔 | SPD33 하이브리드화 | ZrF73− |
| 뚜껑이 있는 팔면체 | MoF7− | ||
| 뚜껑이 있는 삼각 프리즘 | TaF72− | ||
| 8 | 정사각형 반작용 | SPD34 하이브리드화 | 레프8− |
| 십이면체 | Mo(CN)84− | ||
| 이중 삼각 프리즘 | ZrF84− | ||
| 9 | 삼각형 프리즘 | SPD35 하이브리드화 | 리히92− |
| 캡이 있는 정사각형 내진 대책 |
SDx 하이브리드화
d 전자 카운트가 낮은 특정 전이 금속 착화체에서는 p-오비탈이 점유되지 않고x sd 혼성화가 이들 [11][13][12]분자의 모양을 모델링하기 위해 사용된다.
| 코디네이션 번호 | 모양. | 하이브리드화 | 예 |
|---|---|---|---|
| 3 | 삼각뿔 | sd2 하이브리드화(90°) | CrO3 |
| 4 | 사면체 | sd3 하이브리드화(70.5°, 109.5°) | TiCl4 |
| 5 | 정사각형 피라미드 | sd4 하이브리드화(65.9°, 114.1°) | Ta(CH3)5 |
| 6 | C3v. 삼각 프리즘 | sd5 하이브리드화(63.4°, 116.6°) | W(CH3)6 |
| 궤도간[11] 각도 | |||
고가의 분자의 잡종화
옥텟 확장
일부 일반 화학 교과서에서는 폴링이 처음 제안한 d-오비탈을 가진 "확장 옥텟" 방식을 사용하여 주군 배위 번호 5 이상에 대해 교배화가 제시된다.그러나, 그러한 계획은 계산 화학 계산에 비추어 볼 때 잘못된 것으로 간주된다.
| 코디네이션 번호 | 모양. | 하이브리드화 | 예 |
|---|---|---|---|
| 5 | 삼각 쌍추체 | SPD3 하이브리드화 | PF5 |
| 6 | 팔면체 | SPD32 하이브리드화 | SF6 |
| 7 | 오각쌍뿔 | SPD33 하이브리드화 | 만약7 |
1990년 뉴사우스웨일스 대학의 Eric Alfred Magnusson은 2행(3주기) 원소의 초가 화합물에서의 결합에서 d-궤도 교잡의 역할을 명백히 배제하는 논문을 발표하여 논쟁과 혼란의 지점을 종결시켰다.혼동의 일부는 d-함수가 이러한 화합물을 설명하는 데 사용되는 기초 집합에서 필수적이라는 사실에서 비롯된다(또는 비정상적으로 높은 에너지와 왜곡된 기하학적 결과).또한 분자파 함수에 대한 d-함수의 기여가 크다.이러한 사실은 d-오비탈이 [14][15]결합에 관여해야 한다는 의미로 잘못 해석되었습니다.
공명
계산 화학에 비추어 볼 때, 더 나은 치료법은 교배와 더불어 시그마 결합 공명을 호출하는 것인데, 이는 각 공진 구조가 자체 교배 체계를 가지고 있다는 것을 의미한다.모든 공명 구조는 옥텟 규칙을 [16]따라야 합니다.
| 코디네이션 번호 | 공명 구조 |
|---|---|
| 5 | 삼각 쌍추체 |
 | |
| 6 | 팔면체 |
 | |
| 7 | 오각쌍뿔 |
 |
등가 하이브리드화
이상적인 하이브리드 궤도는 유용할 수 있지만, 실제로는 대부분의 결합이 중간 성질의 궤도를 필요로 합니다.이는 각 유형(s, p, d)의 원자 궤도의 유연한 가중치를 포함하도록 확장이 필요하며 분자 기하학이 이상적인 결합각에서 벗어날 때 결합 형성의 정량적 묘사를 가능하게 한다.p 문자의 양은 정수 값으로 제한되지 않습니다.즉, sp와 같은2.5 하이브리드화도 쉽게 기술됩니다.
결합 궤도의 교배는 벤트의 법칙에 의해 결정된다: "원자 특성은 전기양성 치환기를 향하는 궤도에 집중한다."
단일 쌍을 가진 분자
단일 쌍을 가진 분자의 경우 결합 오비탈은 등가x sp 하이브리드입니다.예를 들어 물 중 산소의 결합형성 하이브리드 궤도 2개를 sp로4.0 표현하면 안와간 각도가 104.5°[17]가 된다.즉, 산소의 2p 서브셸에는 3p 오비탈만 포함되어 있기 때문에 산소의 1s 오비탈과 4p 오비탈에서 하이브리드 오비탈이 형성된다는 의미는 아닙니다.단일 쌍을 가진 분자의 모양은 다음과 같습니다.
이러한 경우, 수학적으로 동일한 두 가지 방법으로 단일 쌍을 표현할 수 있습니다.그것들은 분자 궤도 이론과 유사한 시그마 및 파이 대칭의 궤도 또는 VSEPR 이론과 유사한 동등한 궤도로 표현될 수 있다.
초가 분자
단독쌍을 가진 고원자가 분자의 경우 결합방식은 고원자가 성분과 등가x sp결합 하이브리드로 이루어진 성분으로 분할할 수 있다.초가 성분은 p 오비탈을 사용하는 공명 결합으로 구성됩니다.아래 표는 각 형상이 두 구성 요소와 어떻게 관련되어 있는지와 각각의 설명을 보여줍니다.
| 등가 결합 하이브리드 수(빨간색으로 표시) | ||||
|---|---|---|---|---|
| 두명 | 하나. | – | ||
| 하이퍼밸런스[16] 컴포넌트 | 선형축 (1p 궤도) | 시소 | T자형 | 선형 |
 |  |  | ||
| 정사각형 평면 적도 (2p 궤도) | 정사각형 피라미드 | 정사각형 평면 | ||
 | 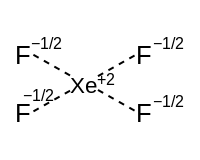 | |||
| 오각형 평면 적도 (2p 궤도) | 오각형 피라미드 | 오각형 평면 | ||
 |  | |||
하이브리드화 결함
효과적인x sp 하이브리드를 형성하기 위해 s와 p 오비탈을 교배하려면 두 오비탈이 동등한 반경 범위를 가져야 한다.2p 오비탈은 평균 2s보다 10% 더 크지만, 부분적으로는 2p 오비탈에 방사형 노드가 없기 때문에 1개의 방사형 노드가 있는 3p 오비탈은 3s 오비탈을 20-33%[18] 초과한다.s와 p 오비탈 범위의 차이는 그룹을 따라 더욱 증가한다.화학 결합에서 원자의 교배는 예를 들어 자연 결합 궤도(NBO) 체계에서 자연 국재 분자 궤도를 사용하여 국재 분자 궤도를 고려함으로써 분석할 수 있다.메탄, CH에서4 계산된 p/s 비율은 "이상적" sp3 교배와 일치하는 약 3인 반면, 실란, SiH의4 경우 p/s 비율은 2에 가깝다.다른 2p 요소에서도 비슷한 경향이 보입니다.수소에 불소를 치환하면 p/s비가 [19]더욱 낮아진다.2p 요소는 직교 하이브리드 궤도와의 이상적인 교배 현상을 보인다.무거운 p 블록 요소의 경우 이러한 직교성 가정은 정당화될 수 없습니다.Kutzelnigg는 [20]이러한 이상적인 교잡화로부터의 편차를 교잡화 결함이라고 불렀다.
광전자 스펙트럼
궤도 교배와 관련된 한 가지 오해는 그것이 많은 분자의 자외선 광전자 스펙트럼을 잘못 예측한다는 것이다.만약 쿠프만의 정리가 국소적인 잡종에 적용된다면, 양자 역학은 (이 경우 이온화된) 파동 함수가 원자가 결합 이론에서 공명을 암시하는 분자의 대칭에 따를 것을 요구한다.예를 들어 메탄에서 이온화 상태(CH4+)는 방출된 전자를 4개의3 sp 궤도 각각에 귀속시키는 4개의 공명 구조로부터 구성될 수 있다.이들 4개 구조의 선형 조합은 구조 수를 보존하면 3중 퇴화2 T 상태와 A [21][22]상태로1 이어진다.각 이온화 상태와 지면 상태 간의 에너지 차이는 이온화 에너지로, 실험 결과와 일치하는 두 가지 값을 산출한다.
국부적 분자 궤도 대 표준 분자 궤도
하이브리드 원자 궤도로부터 형성된 결합 궤도는 적절한 수학적 변환에 의해 분자 궤도 이론의 비국재화된 궤도로부터 형성될 수 있는 국소적 분자 궤도로 간주될 수 있다.지면 상태의 분자에 대해, 이러한 궤도 변환은 총 다전자파 함수를 변경하지 않습니다.따라서 지상 상태의 하이브리드 궤도 설명은 지상 상태의 총 에너지 및 전자 밀도에 대한 비국재화 궤도 설명과 동일하며, 최소 총 에너지 값에 해당하는 분자 기하학도 마찬가지입니다.
2개의 현지화된 표현
다중 결합 또는 다중 단독 쌍을 가진 분자는 시그마 및 파이 대칭 또는 등가 궤도로 표현되는 궤도를 가질 수 있습니다.서로 다른 원자가 결합 방법은 수학적으로 동등한 총 다전자파 함수를 가지며 점유된 분자 궤도 세트의 단일 변환과 관련이 있는 두 가지 표현 중 하나를 사용한다.
다중 결합의 경우 등가 궤도(굴절 결합) 표현과 비교하여 시그마-pi 표현이 지배적이다.이와는 대조적으로, 여러 개의 단일 쌍의 경우 대부분의 교과서는 동등한 궤도 표현을 사용합니다.그러나 시그마-파이 표현은 와인홀드와 랜디스에 의해서도 사용된다. 예를 들어 자연 결합 오비탈의 맥락 내에서는 고전적인 결합 쌍과 단독 [23]쌍의 현대화된 아날로그를 포함하는 국소화된 궤도 이론이다.예를 들어 플루오르화수소 분자의 경우, 2개의 F 론쌍은 본질적으로 비하이브리드화된 p 오비탈이며, 다른 한 쌍은 spx 하이브리드 오비탈이다.유사한 고려사항이 물에 적용된다(한 O 단독 쌍은 순수 p 오비탈에 있고 다른 O 쌍은 sp 하이브리드x 오비탈에 있음).
「 」를 참조해 주세요.
레퍼런스
- ^ Housecroft, Catherine E.; Sharpe, Alan G. (2005). Inorganic Chemistry (2nd ed.). Pearson Prentice-Hal. p. 100. ISBN 0130-39913-2.
- ^ Pauling, L. (1931), "The nature of the chemical bond. Application of results obtained from the quantum mechanics and from a theory of paramagnetic susceptibility to the structure of molecules", Journal of the American Chemical Society, 53 (4): 1367–1400, doi:10.1021/ja01355a027
- ^ Brittin, W. E. (1945). "Valence Angle of the Tetrahedral Carbon Atom". J. Chem. Educ. 22 (3): 145. Bibcode:1945JChEd..22..145B. doi:10.1021/ed022p145.
- ^ L. Pauling The Nature of the Chemical Bond (제3판, 옥스퍼드 대학 출판부 1960) 페이지 111–120.
- ^ Clayden, Jonathan; Greeves, Nick; Warren, Stuart; Wothers, Peter (2001). Organic Chemistry (1st ed.). Oxford University Press. p. 105. ISBN 978-0-19-850346-0.
- ^ 유기화학, 제3판 메리 앤 폭스 제임스 K.Whitesell 2003 ISBN 978-0-7637-3586-9
- ^ 유기화학 2001년 9월 3일 Paula Erkanis Bruice ISBN 978-0-130-17858-9
- ^ "Acids and Bases". Orgo Made Simple. Retrieved 23 June 2015.
- ^ 맥머레이, J. (1995년)화학 주석 강사판 (제4판)프렌티스 홀, 272페이지ISBN 978-0-131-40221-8
- ^ Gillespie, R.J. (2004), "Teaching molecular geometry with the VSEPR model", Journal of Chemical Education, 81 (3): 298–304, Bibcode:2004JChEd..81..298G, doi:10.1021/ed081p298
- ^ a b c Weinhold, Frank; Landis, Clark R. (2005). Valency and bonding: A Natural Bond Orbital Donor-Acceptor Perspective. Cambridge: Cambridge University Press. pp. 367, 374–376, 381–383. ISBN 978-0-521-83128-4.
- ^ a b Bayse, Craig; Hall, Michael (1999). "Prediction of the Geometries of Simple Transition Metal Polyhydride Complexes by Symmetry Analysis". J. Am. Chem. Soc. 121 (6): 1348–1358. doi:10.1021/ja981965+.
- ^ Kaupp, Martin (2001). ""Non-VSEPR" Structures and Bonding in d(0) Systems". Angew Chem Int Ed Engl. 40 (1): 3534–3565. doi:10.1002/1521-3773(20011001)40:19<3534::AID-ANIE3534>3.0.CO;2-#. PMID 11592184.
- ^ Magnusson, E. (1990). "Hypercoordinate molecules of second-row elements: d functions or d orbitals?". J. Am. Chem. Soc. 112 (22): 7940–7951. doi:10.1021/ja00178a014.
- ^ David L. Cooper; Terry P. Cunningham; Joseph Gerratt; Peter B. Karadakov; Mario Raimondi (1994). "Chemical Bonding to Hypercoordinate Second-Row Atoms: d Orbital Participation versus Democracy". Journal of the American Chemical Society. 116 (10): 4414–4426. doi:10.1021/ja00089a033.
- ^ a b Richard D. Harcourt; Thomas M. Klapötke (2003). "Increased valence (qualitative valence bond) descriptions of the electronic structures of electron-rich fluorine-containing molecules". Journal of Fluorine Chemistry. 123 (1): 5–20. doi:10.1016/S0022-1139(03)00012-5.
- ^ Frenking, Gernot; Shaik, Sason, eds. (2014). "Chapter 3: The NBO View of Chemical Bonding". The Chemical Bond: Fundamental Aspects of Chemical Bonding. John Wiley & Sons. ISBN 978-3-527-66471-9.
- ^ Kaupp, Martin (2007). "The role of radial nodes of atomic orbitals for chemical bonding and the periodic table". Journal of Computational Chemistry. 28 (1): 320–325. doi:10.1002/jcc.20522. ISSN 0192-8651. PMID 17143872. S2CID 12677737.
- ^ Kaupp, Martin (2014) [1st. Pub. 2014]. "Chapter 1: Chemical bonding of main group elements". In Frenking, Gernod & Shaik, Sason (eds.). The Chemical Bond: Chemical Bonding Across the Periodic Table. Wiley-VCH. ISBN 9781234567897.
- ^ Kutzelnigg, W. (August 1988). "Orthogonal and non-orthogonal hybrids". Journal of Molecular Structure: THEOCHEM. 169: 403–419. doi:10.1016/0166-1280(88)80273-2.
- ^ Andrei M. Tokmachev; Andrei L. Tchougreeff; Igor A. Misurkin (2001). "Ionization potentials within semiempirical antisymmetrized product of strictly localized geminals approach". International Journal of Quantum Chemistry. 85 (3): 109–117. doi:10.1002/qua.1060.
- ^ Sason S. Shaik; Phillipe C. Hiberty (2008). A Chemist's Guide to Valence Bond Theory. New Jersey: Wiley-Interscience. pp. 104–106. ISBN 978-0-470-03735-5.
- ^ Weinhold, Frank; Landis, Clark R. (2012). Discovering Chemistry with Natural Bond Orbitals. Hoboken, N.J.: Wiley. pp. 67–68. ISBN 978-1-118-11996-9.










