마이크로 전극 어레이
Microelectrode array마이크로 전자 어레이(MEAs)는 신경 신호를 얻거나 전달하는 다중(tens to 수천) 마이크로 전극을 포함하는 장치로, 기본적으로 뉴런을 전자 회로에 연결하는 신경 인터페이스 역할을 한다. MEA에는 체외에서 사용되는 이식성 MEA와 체외에서 사용되는 비이식성 MEA의 두 가지 일반적인 등급이 있다.
이론
신경세포와 근육세포는 흥분하면 자신의 막을 통해 이온전류를 생성해 세포 내부와 외부 사이에 전압 변화를 일으킨다. MEA의 전극은 이온에 의해 전달되는 환경으로부터 전자에 의해 전달되는 전류(전자 전류)로 전압의 변화를 변환한다. 자극할 때 전극은 전류를 매체를 통해 이온전류로 변환한다. 이것은 흥분성 세포의 막에 있는 전압 게이트 이온 채널을 촉발시켜 세포가 탈극화되고, 신경세포일 경우 작용 전위를 촉발시킨다.[citation needed]
기록된 신호의 크기와 모양은 몇 가지 요인에 따라 달라진다: 셀 또는 셀이 위치한 매체의 특성(예: 매체의 전기 전도성, 정전용량 및 동질성), 셀과 MEA 전극 사이의 접촉 특성(예: 접촉 영역 및 조임성), MEA 전극 자체의 특성(예: MEA 전극 자체의 특성).g. 기하학, 임피던스 및 노이즈), 아날로그 신호 처리(예: 컷오프 주파수를 벗어난 시스템의 이득, 대역폭 및 동작) 및 데이터 샘플링 속성(예:[1] 샘플링 속도 및 디지털 신호 처리) 평면 전극을 부분적으로 덮는 단일 셀의 기록의 경우, 접촉 패드의 전압은 셀과 전극의 겹치는 부분의 전압에 전체 전극의 면적과 겹치는 부분의 표면적을 곱한 비율과 대략 같다.
전극 주위의 영역이 잘 절연되어 있으며 전극과 관련된 캐패시턴스가 매우 작다고 가정한다.[1] 그러나 위의 방정식은 전극, 셀 및 주변 환경을 동등한 회로도로 모델링하는 것에 의존한다. 셀 전자파 동작을 예측하는 대안적인 수단은 복잡한 회로 요소 다이어그램에서 시스템을 과도하게 단순화하는 한계를 회피하기 위해 기하학적 기반의 유한 요소 분석을 사용하여 시스템을 모델링하는 것이다.[2]
MEA는 조직 조각이나 분리된 세포 배양액에 대한 전기생리학적 실험을 수행하는 데 사용될 수 있다. 급성 조직 슬라이스를 사용하면 추출 및 도금 전에 조직 슬라이스 내의 세포 간 연결이 다소 보존되는 반면, 분리된 배양액의 세포 간 연결은 도금 전에 파괴된다. 분열된 뉴런 문화로, 뉴런들은 자발적으로 네트워크를 형성한다.[3]
전극이 경험하는 전압 진폭은 셀이 탈극화되는 거리와 반비례한다는 것을 알 수 있다.[4] 따라서 셀을 배양하거나 가능한 한 전극에 가깝게 배치해야 할 수 있다. 조직 슬라이스로 부종 때문에 절개 부위 주변에 전기적으로 수동적인 죽은 세포 층이 형성된다.[5] 이에 대처하는 방법은 마스킹과 화학 식각으로 가공한 3차원 전극으로 MEA를 조작하는 것이다. 이 3-D 전극들은 슬라이스 조직의 죽은 세포층을 관통하여 살아있는 세포와 전극 사이의 거리를 감소시킨다.[6] 분리된 문화에서, 강력한 신호를 얻기 위해서는 MEA 기질에 대한 세포의 적절한 결합이 중요하다.
역사
최초의 이식 가능한 배열은 1950년대에 개발된 전자레인지 배열이었다.[7] 배양된 세포에서 녹음하기 위해 일련의 평면 전극을 사용하는 것과 관련된 첫 번째 실험은 1972년에 C.A.에 의해 수행되었다. 토마스 주니어와 그의 동료들.[4] 실험 설정에서는 각각 100 µm 간격으로 백금 흑백 도금된 2 x 15의 금 전극을 사용했다. 배아 병아리에서 채취한 근세포는 MEA에 분리되어 배양되었으며, 진폭 1mV까지 높은 신호가 기록되었다.[8] MEA는 1977년 구엔터 그로스(Guenter Gross)와 그의 동료들이 토마스(Thomas)와 그의 동료들의 작업에 대한 사전 지식 없이 독자적으로 달팽이 갱년기의 전기생리학을 탐구하기 위해 건설되고 이용되었다.[4] 1982년 그로스는 분리된 척수 신경세포로부터 자발적 전기생리학적 활동을 관찰했고, 활동이 온도에 매우 의존한다는 것을 발견했다. 약 30˚C 이하에서는 상온에서 신호 진폭이 상대적으로 작은 값으로 급격히 감소한다.[4]
1990년대 이전에는 맞춤형 MEA 제작과 소프트웨어 개발로 인해 MEA 연구를 수행하고자 했던 새로운 연구소에 상당한 진입 장벽이 존재했다.[3] 그러나 저렴한 컴퓨팅 성능과 상용[1] MEA 하드웨어 및 소프트웨어의 등장으로 많은 다른 연구소가 MEA를 이용한 연구를 수행할 수 있게 되었다.[3] 이 비침습성 전기생리학 실험실 기법은 패치 클램프 방법보다 더 효율적일 수 있다.
종류들
마이크로 전자 배열은 잠재적인 사용에 따라 체외 배열과 체내 배열로 구분할 수 있다.
체외 배열
시험관내 MEA의 표준 유형은 8 x 8 또는 6 x 10 전극의 패턴으로 나타난다. 전극은 일반적으로 인듐 주석 산화물 또는 티타늄으로 구성되며 직경은 10~30μm이다. 이 배열들은 보통 단세포 배양액이나 급성 뇌 조각에 사용된다.[1]
시험관내 MEA들 중 한 가지 도전은 마이크로미터의 순서에 따라 낮은 작동 거리를 요구하는 고출력 렌즈를 사용하는 현미경으로 그것들을 촬영하는 것이었다. 이러한 문제를 피하기 위해 커버 슬립 글라스를 사용하여 "씬"-MEA를 만들었다. 이 배열은 약 180μm로 고출력 렌즈와 함께 사용할 수 있다.[1][9]
또 다른 특수 설계에서는 60개의 전극을 500 μm로 분리하여 6 × 5 배열로 나눈다. 그룹 내의 전극은 직경이 10μm인 30 um으로 분리된다. 이와 같은 배열은 유기체 조각의 기능적 연결성을 연구하면서 뉴런의 국소 반응을 조사하는 데 사용된다.[1][10]
공간 분해능은 MEA의 주요 장점 중 하나로, 고밀도 MEA를 사용할 때 장거리에서 전송되는 신호를 보다 정밀하게 취할 수 있다. 이 배열은 보통 2.8 X 2.8 mm의 면적을 포함하는 256개의 전극의 사각 격자 패턴을 가진다.[1]
공간 분해능이 향상된 CMOS 기반의 고밀도 마이크로 전극 어레이는 썸네일 크기의 콤팩트 칩에 통합 판독 및 자극 회로와 함께 수천 개의 전극을 갖추고 있다.[11] 심지어 단일 축을 따라 전파되는 신호의 분해능도 입증되었다.[12]
품질 신호를 얻기 위해서는 전극과 조직이 서로 밀접하게 접촉해야 한다. 천공된 MEA 설계는 조직 슬라이스가 전극에 배치되어 접촉 및 기록된 신호를 향상시킬 수 있도록 기질 내 개구부에 음압을 가한다.[1]
전극 임피던스를 낮추기 위한 다른 접근방식은 예를 들어 탄소 [13][14]나노튜브를 사용하거나 전극 구조를 수정하여 금[15] 나노필러나 나노크리티와 같은 인터페이스 물질을 수정하는 것이다.[16]
체내 배열
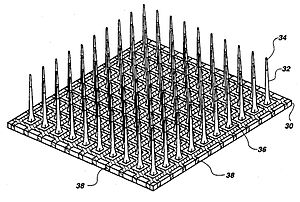
이식 가능한 MEA의 세 가지 주요 범주는 전자레인지, 실리콘 기반 [17]및 유연한 마이크로 전극 어레이다. 전자레인지 MEA는 주로 스테인리스강이나 텅스텐으로 만들어지며 삼각측정에 의해 기록된 개별 뉴런의 위치를 추정하는 데 사용할 수 있다. 실리콘 기반의 마이크로 전극 어레이에는 두 가지 특정 모델인 미시간 어레이와 유타 어레이가 포함된다. 미시건 어레이는 전자레인지 MEA보다 높은 공간 분해능뿐만 아니라 삽입을 위한 센서의 밀도를 허용한다. 그들은 또한 쐐기 끝에서가 아니라 쐐기 길이를 따라 신호를 얻을 수 있도록 한다. 미시간 어레이와 대조적으로 유타 어레이는 3-D로 100개의 전도성 실리콘 바늘로 구성되어 있다. 그러나 유타 어레이에서는 각 전극의 끝에서 신호만 수신하므로 한 번에 얻을 수 있는 정보의 양이 제한된다. 게다가, 유타 어레이는 정해진 치수와 매개변수로 제조되는 반면 미시간 어레이는 더 많은 설계 자유를 허용한다. 폴리이미드, 파릴렌 또는 벤조시클로부텐으로 만들어진 유연한 배열은 영의 실리콘 계수가 뇌조직 계통보다 훨씬 커서 전단 유도 염증을 일으키는 원인이 되기 때문에 단단한 미세전극 배열에 비해 더 가까운 기계적 매칭을 제공하기 때문에 장점을 제공한다.[7]
데이터 처리 방법
뉴런의 의사소통의 기본 단위는 전기적으로, 적어도 행동 잠재력이다. 이 전부 또는 아무것도 아닌 현상은 축음기 언덕에서 발생하여 [18]축음기 아래로 전파되는 세포내 환경의 탈극화를 초래한다. 세포막을 통과하는 이온 유량은 세포외 환경에서 급격한 전압 변화를 발생시키며, 이는 MEA 전극이 궁극적으로 감지하는 것이다. 그러므로, 전압 스파이크 카운팅과 정렬은 종종 네트워크 활동의 특성화를 위한 연구에 사용된다. 또한 스파이크 트레인 분석은 전압 측정과 비교하여 처리 시간과 컴퓨팅 메모리를 절약할 수 있다. 스파이크 타임스탬프는 개별 전극에 의해 측정된 전압이 임계값을 초과하는 시간(흔히 비활성 기간 평균으로부터의 표준 편차로 정의됨)으로 식별된다. 이러한 타임스탬프는 버스트를 식별하기 위해 추가로 처리할 수 있다. 이러한 열차의 추가 분석은 스파이크 조직과 시간적 패턴을 밝혀낼 수 있다.[19]
역량
이점
일반적으로 패치 클램핑과 같은 전통적인 방법과 비교할 때 체외 어레이의 주요 강점은 다음과 같다.[20]
- 여러 전극을 개별적으로 배치하는 것이 아니라 한 번에 배치할 수 있도록 허용
- 동일한 실험 설정 내에서 제어 장치를 설정하는 기능(한 전극을 제어기로 사용하고 다른 전극을 실험용으로 사용) 이것은 특히 자극 실험에 관심이 많다.
- 어레이 내에서 서로 다른 녹화 사이트를 선택하는 기능
- 여러 사이트에서 동시에 데이터를 수신하는 기능
- 온전한 망막의 녹음은 실시간 광학적 자극을 전달할 수 있는 가능성, 예를 들어 수용적인 장을 재구성할 수 있는 가능성 때문에 큰 관심을 끌고 있다.
더욱이, 체외 배열은 세포막을 깨는 것이 필요하지 않기 때문에 패치 클램핑에 비해 비침습적이다.
그러나 체내 어레이와 관련하여 패치 클램핑에 대한 주요 이점은 높은 공간 분해능이다. 이식 가능한 배열은 보철장치를 제어하는 데 사용될 수 있는 운동 이동의 위치나 속도 같은 정보를 가능하게 하는 개별 뉴런으로부터 신호를 얻을 수 있게 한다. 동물 행동 중에 적어도 설치류에서는 수십 개의 이식된 전극이 있는 대규모 병렬 녹화가 가능하다. 이는 그러한 세포외 기록을 신경회로를 식별하고 그 기능을 연구하기 위한 선택방법으로 만든다. 그러나 다극성 세포외 배열을 사용하여 녹화된 뉴런을 명확하게 식별하는 것은 현재까지 문제가 되고 있다.
단점들
시험관내 MEA는 패치 클램프, 동적 클램프 시스템에 비해 공간 분해능이 낮아 단일 셀의 기록과 자극에 적합하지 않다. MEA 전극이 다른 셀에 효과적으로 전송할 수 있는 신호의 복잡성은 동적 클램프의 기능에 비해 제한적이다.
또한, 특히 만성 삽입과 관련하여 마이크로 전극 배열의 삽입에 대한 생물학적 반응도 여러 가지가 있다. 이러한 효과 중에서 가장 주목할 만한 것은 신경 세포 손실, 활공 흉터, 기능하는 전극의 수 감소 등이다.[21] 삽입에 대한 조직 반응은 MEA 쐐기 크기, 쐐기 사이의 거리, MEA 재료 구성 및 삽입 기간을 포함한 많은 요인 사이에서 결정된다. 조직 반응은 일반적으로 단기 반응과 장기 반응으로 나뉜다. 단기 반응은 이식 후 몇 시간 내에 발생하며 장치를 둘러싸고 있는 아스트로사이테와 활공 세포의 수가 증가하면서 시작된다. 그런 다음 모집된 미세혈관이 염증을 일으키고 이물질의 포자세포증 과정이 시작된다. 시간이 지남에 따라 장치에 채용된 아스트로사이테스와 마이크로글리아는 축적되기 시작하며, 장치 주위로 수십 마이크로미터가 확장되는 배열을 둘러싸는 피복을 형성한다. 이것은 전극 프로브 사이의 공간을 증가시킬 뿐만 아니라 전극을 절연시키고 임피던스 측정을 증가시킨다. 배열을 만성적으로 이식하는 문제는 이 기기들의 연구에 원동력이 되어 왔다. 한 새로운 연구는 만성 이식수술에 의한 염증의 신경퇴행 효과를 조사했다.[22] 면역항진화학물질 표지는 전극 기록장 부근에 알츠하이머병 지표인 초인산화 타우가 놀라운 존재감을 보였다. 전극 물질의 포고사이토시스 또한 생체적합성 반응에 대한 문제를 제기하는데, 연구는 이 반응이 경미하고 생체내 12주가 지나면 거의 존재하지 않는다고 시사한다. 기기 삽입의 부정적 영향을 최소화하기 위한 연구에는 라미네인과 같은 뉴런 부착을 촉진하는 단백질로 기기의 표면 코팅이나 약물 용출 물질이 포함된다.[23]
적용들
체외
분열된 신경망의 특성은 체내 모델과 비교할 때 약리학적 반응의 성격을 바꾸거나 감소시키지 않는 것으로 보이며, MEA는 보다 단순하고 통제된 환경에서 분열된 신경 문화에 대한 약리학적 영향을 연구하는 데 사용될 수 있음을 시사한다.[24] 분리된 신경망에서 MEA를 사용하는 여러 약리학적 연구(예: 에탄올을 사용한 연구)[25] MEA를 사용하여 실험실 간 유효성 검사가 수행되었다.[26]
또한, 네트워크 기능의 다양한 생물물리학적 측면에 대한 실질적인 연구 주체가 행태적 수준에서 주로 연구되는 현상을 분리피질적 네트워크 수준으로 감소시킴으로써 수행되었다. 예를 들어, 폐쇄 루프 방식을 사용한 학습의 다양한 입력 신호의 공간적[27] 및 시간적[28] 특징, 동기화의 역학,[29] 신경계절에[30][31][32] 대한 민감성 및 운동학을 추출할 수 있는 그러한 네트워크의 용량.[33][34] 마지막으로, MEA 기술과 콘코칼로컬 현미경 기술을 결합하면 네트워크 활동과 시냅스 리모델링 사이의 관계를 연구할 수 있다.[9]
MEA는 뉴런 네트워크와 비생물학적 시스템을 제어기로 연결하는 데 사용되어 왔다. 예를 들어, 신경-컴퓨터 인터페이스는 MEA를 사용하여 만들어질 수 있다. 분리된 쥐의 피질 뉴런은 닫힌 자극-반응 피드백 루프에 통합되어 가상 환경에서 애니매트를 제어했다.[35] 포터, 맨하반, 드마르스의 MEA와 [36]독서대학의 마크 해먼드, 케빈 워윅, 벤 웰리 등의 MEA를 이용한 폐쇄 루프 자극 대응 시스템도 구축되었다. 약 30만 개의 분리된 쥐 뉴런이 MEA에 도금되었는데, MEA는 로봇의 모터와 초음파 센서에 연결되었고, 감지될 때 장애물을 피하도록 조건화되었다.[37] 이러한 노선을 따라, 테크니온의 시몬 마롬과 동료들은 MEAs에서 자라고 있는 분리된 신경 네트워크를 레고 마인드스톰 로봇에 연결했다; 로봇의 시각장은 네트워크에 의해 분류되었고, 로봇 바퀴에 명령이 전달되어 장애물에 완전히 부딪히지 않게 되었다.[27] 이 "Braitenberg 차량"은 모든 관련 정보에 실질적으로 무제한으로 접근할 수 있는 간단한 설정에서도 [38]로봇의 행동을 유도하기 위해 사용된 특정한 신경 부호화 계획을 확실하게 추론할 수 없다는 것을 보여주는 역신경공학에 대한 불변성을 입증하기 위해 사용되었다.
MEA는 해마 조각으로 네트워크 사격을 관찰하는 데 사용되어 왔다.[39]
체내
심뇌 자극기, 달팽이관 이식, 심장박동기를 포함하여 현재 소비자가 사용할 수 있는 몇 가지 이식 가능한 인터페이스가 있다. 심뇌자극(DBS)은 파킨슨병 등 운동장애 치료에 효과가 있었고,[40] 달팽이관 이식수술은 청각신경의 자극을 보조해 청력 향상에 많은 도움을 주었다. 그들의 주목할 만한 잠재력 때문에, MEA는 신경과학 연구의 중요한 영역이다. 연구는 MEA가 기억 형성과 지각과 같은 과정에 대한 통찰력을 제공할 수 있고 간질, 우울증, 강박성 장애와[citation needed] 같은 조건들에 대한 치료적 가치를 가질 수 있다고 제안한다. BrainGate라는 프로젝트에서 척수 손상 후 또는 ALS 치료로 모터 제어 복원을 위한 인터페이스 장치를 사용한 임상 시험이 시작되었다(비디오 데모: BrainGate 참조). MEA는 케빈 워윅, 마크 가슨, 피터 카이버드가 보여주듯이, 시간 변화 신호를 기록하는 데 필요한 고해상도 기능을 제공하므로, 이를 제어하고 보철 장치로부터 피드백을 얻는 데 사용할 수 있다.[41][42] 연구에 따르면 MEA 사용은 시신경로를 자극함으로써 시력 회복에 도움을 줄 수 있을 것으로 보인다.[7]
MEA 사용자 미팅
루틀링겐에서는 튀빙겐 대학의 자연과학연구소(NMI)가 주관하는 2년마다 과학 사용자 회의가 열린다. 이 회의에서는 산업용 약물 발견, 안전 약리학, 신경 기술뿐만 아니라 기초 및 응용 신경 과학 분야의 Microelectrode Arrays의 새로운 개발 및 현재 적용과 관련된 모든 측면에 대한 포괄적인 개요를 제공한다. 2년마다 열리는 이번 학술대회는 산학관 모두 MEA를 개발하고 활용하는 과학자들의 국제적인 장으로 발전해 고품질의 정보포괄적 과학포럼으로 인정받고 있다. 회의 기고문은 공개접속 진행 도서로 이용할 수 있다.
예술에 사용
MEA는 과학적인 목적으로 사용되는 것 외에도, 현대 미술에서 기술과 생물학의 관계에 대한 철학적 질문들을 조사하기 위해 사용되었다. 전통적으로 서구 사상 내에서 생물학과 기술은 두 가지 뚜렷한 범주로 분리되어 왔다. 바이오스와 테크네.[43] 2002년 MEART: 세미 리빙 아티스트는 퍼스 웨스턴 오스트레일리아 대학의 공생생물학A와 애틀랜타의 조지아 공과대학의 포터랩이 생물학과 기술의 관계를 의심하기 위해 공동 예술과 과학 프로젝트로 만들어졌다.[44][45][46][47] MEART는 애틀랜타의 MEA에서 체외에서 자란 쥐 피질 뉴런, 퍼스에서는 종이에 펜으로 그림을 그릴 수 있는 공압 로봇 팔, 그리고 둘 사이의 통신을 통제하는 소프트웨어로 구성되었다. MEA가 공압팔을 자극함에 따라 퍼스와 애틀랜타 사이의 폐쇄 루프에 뉴런으로부터의 신호가 전달되었다. MEART는 2002년 퍼스 현대미술연구소에서 열린 바이오펠 전시회에서 처음으로 대중에게 전시되었다.[46][48]
참고 항목
참조
- ^ a b c d e f g h Boven, K.-H.; Fejtl, M.; Möller, A.; Nisch, W.; Stett, A. (2006). "On Micro-Electrode Array Revival". In Baudry, M.; Taketani, M. (eds.). Advances in Network Electrophysiology Using Multi-Electrode Arrays. New York: Springer. pp. 24–37. ISBN 0-387-25857-4.
- ^ Buitenweg, J. R.; Rutten, W. L.; Marani, E. (2003). "Geometry-based finite element modeling of the electrical contact between a cultured neuron and a microelectrode". IEEE Trans Biomed Eng. 50 (4): 501–509. doi:10.1109/TBME.2003.809486. PMID 12723062. S2CID 15578217.
- ^ a b c Potter, S. M. (2001). "Distributed processing in cultured neuronal networks". Prog Brain Res. Progress in Brain Research. 130. pp. 49–62. doi:10.1016/S0079-6123(01)30005-5. PMID 11480288.
- ^ a b c d Pine, J. (2006). "A History of MEA Development". In Baudry, M.; Taketani, M. (eds.). Advances in Network Electrophysiology Using Multi-Electrode Arrays. New York: Springer. pp. 3–23. ISBN 0-387-25857-4.
- ^ Heuschkel, M. O.; Wirth, C.; Steidl, E. M.; Buisson, B. (2006). "A History of MEA Development". In Baudry, M.; Taketani, M. (eds.). Advances in Network Electrophysiology Using Multi-Electrode Arrays. New York: Springer. pp. 69–111. ISBN 0-387-25857-4.
- ^ Thiebaud, P.; deRooij, N. F.; Koudelka-Hep, M.; Stoppini, L. (1997). "Microelectrode arrays for electrophysiological monitoring of hippocampal organotypic slice cultures". IEEE Trans Biomed Eng. 44 (11): 1159–63. doi:10.1109/10.641344. PMID 9353996. S2CID 22179940.
- ^ a b c Cheung, K. C. (2007). "Implantable microscale neural interfaces". Biomedical Microdevices. 9 (6): 923–38. doi:10.1007/s10544-006-9045-z. PMID 17252207. S2CID 37347927.
- ^ Thomas, C. A.; Springer, P. A.; Loeb, G. E.; Berwald-Netter, Y.; Okun, L. M. (1972). "A miniature microelectrode array to monitor the bioelectric activity of cultured cells". Exp. Cell Res. 74 (1): 61–66. doi:10.1016/0014-4827(72)90481-8. PMID 4672477.
- ^ a b Minerbi, A.; Kahana, R.; Goldfeld, L.; Kaufman, M.; Marom, S.; Ziv, N. E. (2009). "Long-term relationships between synaptic tenacity, synaptic remodeling, and network activity". PLOS Biol. 7 (6): e1000136. doi:10.1371/journal.pbio.1000136. PMC 2693930. PMID 19554080.
- ^ Segev, R.; Berry II, M. J. (2003). "Recording from all of the ganglion cells in the retina". Soc Neurosci Abstr. 264: 11.
- ^ Hierlemann, A.; Frey, U.; Hafizovic, S.; Heer, F. (2011). "Growing Cells atop Microelectronic Chips: Interfacing Electrogenic Cells in Vitro with CMOS-based Microelectrode Arrays". Proceedings of the IEEE. 99 (2): 252–284. doi:10.1109/JPROC.2010.2066532. S2CID 2578216.
- ^ Bakkum, D. J.; Frey, U.; Radivojevic, M.; Russell, T. L.; Müller, J.; Fiscella, M.; Takahashi, H.; Hierlemann, A. (2013). "Tracking axonal action potential propagation on a high-density microelectrode array across hundreds of sites". Nature Communications. 4: 2181. Bibcode:2013NatCo...4.2181B. doi:10.1038/ncomms3181. PMC 5419423. PMID 23867868.
- ^ Yu, Z.; et al. (2007). "Vertically Aligned Carbon Nanofiber Arrays Record Electrophysiological Signals from Hippocampal Slices". Nano Lett. 7 (8): 2188–95. Bibcode:2007NanoL...7.2188Y. doi:10.1021/nl070291a. PMID 17604402.
- ^ Gabay, T.; et al. (2007). "Electro-chemical and biological properties of carbon nanotube based multi-electrode arrays". Nanotechnology. 18 (3): 035201. Bibcode:2007Nanot..18c5201G. doi:10.1088/0957-4484/18/3/035201. PMID 19636111.
- ^ Brüggemann, D.; et al. (2011). "Nanostructured gold microelectrodes for extracellular recording from electrogenic cells". Nanotechnology. 22 (26): 265104. Bibcode:2011Nanot..22z5104B. doi:10.1088/0957-4484/22/26/265104. PMID 21586820.
- ^ Hofmann, B.; et al. (2011). "Nanocavity electrode array for recording from electrogenic cells". Lab Chip. 11 (6): 1054–8. doi:10.1039/C0LC00582G. PMID 21286648.
- ^ Bhandari, R.; Negi, S.; Solzbacher, F. (2010). "Wafer Scale Fabrication of Penetrating Neural Electrode Arrays". Biomedical Microdevices. 12 (5): 797–807. doi:10.1007/s10544-010-9434-1. PMID 20480240. S2CID 25288723.
- ^ Angelides, K. J.; Elmer, L. W.; Loftus, D.; Elson, E. (1988). "Distribution and lateral mobility of voltage-dependent sodium channels in neurons". J. Cell Biol. 106 (6): 1911–25. doi:10.1083/jcb.106.6.1911. PMC 2115131. PMID 2454930.
- ^ Dastgheyb, Raha M.; Yoo, Seung-Wan; Haughey, Norman J. (2020). "MEAnalyzer – a Spike Train Analysis Tool for Multi Electrode Arrays". Neuroinformatics. 18 (1): 163–179. doi:10.1007/s12021-019-09431-0. PMID 31273627. S2CID 195795810.
- ^ Whitson, J.; Kubota, D.; Shimono, K.; Jia, Y.; Taketani, M. (2006). "Multi-Electrode Arrays: Enhancing Traditional Methods and Enabling Network Physiology". In Baudry, M.; Taketani, M. (eds.). Advances in Network Electrophysiology Using Multi-Electrode Arrays. New York: Springer. pp. 38–68. ISBN 0-387-25857-4.
- ^ Biran, R.; Martin, D. C.; Tresco, P. A. (2005). "Neuronal cell loss accompanies the brain tissue response to chronically implanted silicon microelectrode arrays". Experimental Neurology. 195 (1): 115–26. doi:10.1016/j.expneurol.2005.04.020. PMID 16045910. S2CID 14077903.
- ^ McConnell GC, Rees HD, Levey AI, Gross RG, Bellamkonda RV. 2008. 만성 전극은 국소적인 신경퇴행 상태를 유도한다. 만성 기록 신뢰성에 대한 영향. 워싱턴 D. 뉴로사이언스를 위한 사회C[citation not found]
- ^ He, W.; McConnell, G. C.; Bellamkonda, R. V. (2006). "Nanoscale laminin coating modulates cortical scarring response around implanted silicon microelectrode arrays". Journal of Neural Engineering. 3 (4): 316–26. Bibcode:2006JNEng...3..316H. doi:10.1088/1741-2560/3/4/009. PMID 17124336.
- ^ Gopal, K. V.; Gross, G. W. (2006). "Emerging Histotypic Properties of Cultured Neuronal Networks". In Baudry, M.; Taketani, M. (eds.). Advances in Network Electrophysiology Using Multi-Electrode Arrays. New York: Springer. pp. 193–214. ISBN 0-387-25857-4.
- ^ Xia, Y. & Gross, G. W. (2003). "Histotypic electrophysiological responses of cultured neuronal networks to ethanol". Alcohol. 30 (3): 167–74. doi:10.1016/S0741-8329(03)00135-6. PMID 13679110.
- ^ Novellino, A; Scelfo, B; Palosaari, T; Price, A; Sobanski, T; Shafer, T; Johnstone, A; Gross, G; Gramowski, A; Scroeder, O; Jügelt, K; Chiappalone, M; Benfenati, F; Martinoia, S; Tedesco, M; Defranchi, E; D'Angelo, P; Whelan, M (April 27, 2011). "Development of micro-electrode array based tests for neurotoxicity: assessment of interlaboratory reproducibility with neuroactive chemicals". Front. Neuroeng. 4 (4). doi:10.3389/fneng.2011.00004. PMC 3087164. PMID 21562604. Retrieved 21 December 2020.
- ^ a b Shahaf, G.; Eytan, D.; Gal, A.; Kermany, E.; Lyakhov, V.; Zrenner, C.; Marom, S. (2008). "Order-based representation in random networks of cortical neurons". PLOS Comput. Biol. 4 (11): e1000228. Bibcode:2008PLSCB...4E0228S. doi:10.1371/journal.pcbi.1000228. PMC 2580731. PMID 19023409.
- ^ Eytan, D.; Brenner, N.; Marom, S. (2003). "Selective adaptation in networks of cortical neurons". J. Neurosci. 23 (28): 9349–9356. doi:10.1523/JNEUROSCI.23-28-09349.2003. PMC 6740578. PMID 14561862.
- ^ Eytan, D.; Marom, S. (2006). "Dynamics and effective topology underlying synchronization in networks of cortical neurons". J. Neurosci. 26 (33): 8465–8476. doi:10.1523/JNEUROSCI.1627-06.2006. PMC 6674346. PMID 16914671.
- ^ Eytan, D.; Minerbi, A.; Ziv, N. E.; Marom, S. (2004). "Dopamine-induced dispersion of correlations between action potentials in networks of cortical neurons". J Neurophysiol. 92 (3): 1817–1824. doi:10.1152/jn.00202.2004. PMID 15084641.
- ^ Tateno, T.; Jimbo, Y.; Robinson, H. P. (2005). "Spatio-temporal cholinergic modulation in cultured networks of rat cortical neurons: spontaneous activity". Neuroscience. 134 (2): 425–437. doi:10.1016/j.neuroscience.2005.04.049. PMID 15993003. S2CID 22745827.
- ^ Tateno, T.; Jimbo, Y.; Robinson, H. P. (2005). "Spatio-temporal cholinergic modulation in cultured networks of rat cortical neurons: evoked activity". Neuroscience. 134 (2): 439–448. doi:10.1016/j.neuroscience.2005.04.055. PMID 15979809. S2CID 6922531.
- ^ Shahaf, G.; Marom, S. (2001). "Learning in networks of cortical neurons". J. Neurosci. 21 (22): 8782–8788. doi:10.1523/JNEUROSCI.21-22-08782.2001. PMC 6762268. PMID 11698590.
- ^ Stegenga, J.; Le Feber, J.; Marani, E.; Rutten, W. L. (2009). "The effect of learning on bursting". IEEE Trans Biomed Eng. 56 (4): 1220–1227. doi:10.1109/TBME.2008.2006856. PMID 19272893. S2CID 12379440.
- ^ DeMarse, T. B.; Wagenaar, D. A.; Blau, A. W.; Potter, S. M. (2001). "The Neurally Controlled Animat: Biological Brains Acting with Simulated Bodies". Autonomous Robots. 11 (3): 305–10. doi:10.1023/A:1012407611130. PMC 2440704. PMID 18584059.
- ^ Potter, S. M.; Madhavan, R.; DeMarse, T. B. (2003). "Long-term bidirectional neuron interfaces for robotic control, and in vitro learning studies". Proc. 25th IEEE EMBS Annual Meeting: 3690–3693. doi:10.1109/IEMBS.2003.1280959. ISBN 0-7803-7789-3. S2CID 12213854.
- ^ Marks, P. (2008). "Rise of the rat-brained robots". New Scientist. 199 (2669): 22–23. doi:10.1016/S0262-4079(08)62062-X.
- ^ Marom, S.; Meir, R.; Braun, E.; Gal, A.; Kermany, E.; Eytan, D. (2009). "On the precarious path of reverse neuro-engineering". Front Comput Neurosci. 3: 5. doi:10.3389/neuro.10.005.2009. PMC 2691154. PMID 19503751.
- ^ Colgin, L. L.; Kramar, E. A.; Gall, C. M.; Lynch, G. (2003). "Septal modulation of excitatory transmission in hippocampus". J Neurophysiol. 90 (4): 2358–2366. doi:10.1152/jn.00262.2003. PMID 12840078.
- ^ Breit, S.; Schulz, J. B.; Benabid, A. L. (2004). "Deep Brain Stimulation". Cell and Tissue Research. 318 (1): 275–288. doi:10.1007/s00441-004-0936-0. PMID 15322914. S2CID 25263765.
- ^ Warwick, K.; Gasson, M.; Hutt, B.; Goodhew, I.; Kyberd, P.; Andrews, B.; Teddy, P.; Shad, A. (2003). "The Application of Implant Technology for Cybernetic Systems". Archives of Neurology. 60 (10): 1369–1373. doi:10.1001/archneur.60.10.1369. PMID 14568806.
- ^ Schwartz, A. B. (2004). "Cortical Neural Prosthetics". Annual Review of Neuroscience. 27: 487–507. doi:10.1146/annurev.neuro.27.070203.144233. PMID 15217341.
- ^ Tacker, Eugene(2010) "Critical Terms for Media Studies" University of Chicago Press에서 "Biomedia란 무엇인가?" 시카고와 런던, 페이지118-30
- ^ Bakkum DJ, Gamblen PM, Ben-Ary G, Chao ZC, Potter SM (2007). "MEART: The Semi-Living Artist". Frontiers in Neurorobotics. 1: 5. doi:10.3389/neuro.12.005.2007. PMC 2533587. PMID 18958276.
- ^ Bakkum, Douglas J.; Shkolnik, Alexander C.; Ben-Ary, Guy; Gamblen, Phil; DeMarse, Thomas B.; Potter, Steve M. (2004). Removing Some 'A' from AI: Embodied Cultured Networks. Lecture Notes in Computer Science. 3139. pp. 130–45. doi:10.1007/978-3-540-27833-7_10. ISBN 978-3-540-22484-6.
- ^ a b SymbiosA 연구 그룹 (2002) MEART – 준생활 예술가 (AKA Fish & Chips) Stage 2 pp.60-68. BEAP, Electronic Arts, 2002: 박람회. 토마스, 폴, 에드, 펍 커틴 대학교. ISBN 1 74067 157 0.
- ^ Ben-Ary, G, Zurr, I, Richards, M, Gamblen, P, Catts, O and Bunt, S (2001) “Fish and Chips, The current Status of the Research by the SymbioticA research group” in Takeover, wer macht die Kunst von morgen (who's doing the art of tomorrow) pp. 141-147 Springer Vien.
- ^ "BioFeel: biology + art". Perth Institute for Contemporary Art. Archived from the original on 2014-08-11.