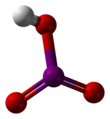
요오드산
Iodic acid이 글은 검증을 위해 인용구가 추가로 필요하다.– · · 책· · (2013년 5월)(이 템플릿 |
 | |||
| | |||
| 이름 | |||
|---|---|---|---|
| 기타 이름 요오드산(V) | |||
| 식별자 | |||
3D 모델(JSmol) | |||
| 체비 | |||
| 켐벨 | |||
| 켐스파이더 | |||
| ECHA InfoCard | 100.029.056 | ||
펍켐 CID | |||
| 유니 | |||
CompTox 대시보드 (EPA) | |||
| |||
| |||
| 특성. | |||
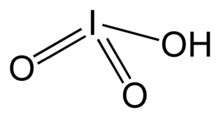
| 히오3 | |||
| 어금질량 | 175.91 g/190 | ||
| 외관 | 화이트솔리드 | ||
| 밀도 | 4.62 g/cm3, 솔리드 | ||
| 녹는점 | 110°C(230°F, 383K) | ||
| 269 g/100 mL(20°C) | |||
| 산도(pKa) | 0.75 | ||
| 콘게이트 베이스 | 요오드산염 | ||
자기 감수성(magnetic susibility) | -48.0·10cm−63/190cm | ||
| 위험 | |||
| 산업안전보건(OHS/OSH): | |||
주요 위험 | 산성, 부식성, 산화제 | ||
| GHS 라벨 표시:[1] | |||
  | |||
| 위험 | |||
| NFPA 704(화재 다이아몬드) | |||
| 플래시 포인트 | 불연성 | ||
| 관련 화합물 | |||
기타 양이온 | 요오드산 리튬 요오드산칼륨 | ||
관련 할로겐산소산화물 | 염소산 브롬산 | ||
관련 화합물 | 하이드로다이오드산 오산화 요오드 주기산 | ||
달리 명시된 경우를 제외하고, 표준 상태(25°C [77°F], 100 kPa)의 재료에 대한 데이터가 제공된다. | |||
| Infobox 참조 자료 | |||
요오드산은 화학식 HIO와3 함께 백색 수용성 고체다. 그것의 강건성은 염소산과 브롬산의 불안정성과 대비된다. 요오드산은 산화상태 +5에 요오드가 특징이며 할로겐의 가장 안정적인 산소 산화물 중 하나이다. 가열하면 검체가 탈수하여 오산화 요오드를 만든다. 추가 가열 시, 오산화 옥소드는 더욱 분해되어 요오드, 산소 및 요오드의 낮은 산화물이 혼합된다.
준비
요오드산은 질산 HNO
3, 염소 Cl
2, 염소산 HClO
3 또는 과산화수소 HO와
2
2 같은 강한 산화제로 요오드 I를2 산화시켜 다음과 같은 방법으로 생산할 수 있다.[2]
구조
요오드산은 P222111 우주군에서 정형혼합체 α-HClO로서
3 산성 용액으로부터 결정된다. 이 구조는 수소 결합과 분자간 요오드-산소 상호작용에 의해 연결된 피라미드 분자로 구성되어 있다. I=O 결합 길이는 1.81 å인 반면 I-OH 거리는 1.89 while이다.[3][4][5] 우주 그룹 Pbca의 정형혼합체 γ 형태,[6] 우주 그룹 P222의111 정형혼합체 Δ 형태,[7] P222의111 정형혼합체 β 형태 등 여러 다른 폴리모프들이 보고되었다.[8] 모든 폴리모르프는 피라미드 분자, 수소 결합, I··O 상호작용 등을 포함하고 있으나 포장 배열은 다르다.
특성.
요오드산은 pK가a 0.75인 비교적 강한 산이다. 그것은 기본적인 용액보다는 산성 용액에서 강하게 산화되고 있다. 요오드산이 산화제 역할을 할 때, 그 반응의 산물은 요오드 즉 요오드 이온이다. 일부 특수 조건(농축 염산 등 매우 낮은 pH 및 고농도의 염화 이온)에서는 요오드산은 용액 내 황금 황색 화합물인 요오드 트리클로라이드(요오드 트리클로라이드)로 감소하고 더 이상의 감소는 일어나지 않는다. 염화물이온이 없을 때 환원제가 과다하면 모든 요오드산물이 요오드이온으로 전환된다. 요오드산염의 양이 많으면 요오드산염의 일부가 요오드로 변환된다. 알킬 할로겐화물을 형성하기 위해 이온화를 준비하는 데 사용될 수 있다.
사용하다
요오드산은 분석 화학에서 강한 산으로 사용된다. 메틸 레드 또는 메틸 오렌지를 지표로 사용하여 약한 베이스와 강한 베이스의 솔루션을 표준화하는 데 사용할 수 있다.
소금 산업에서 사용
요오드산은 소금의 요오드 함량을 증가시키기 위해 나트륨이나 요오드산칼륨을 합성하는데 사용될 수 있다.[citation needed]
기타옥시드
요오드산염은 요오드가 -1, +1, +3, +5 또는 +7의 산화 상태를 가정할 수 있는 일련의 옥시산염의 부분이다. 중성 요오드산화물도 다수 알려져 있다.
| 요오드 산화 상태 | −1 | +1 | +3 | +5 | +7 |
|---|---|---|---|---|---|
| 이름 | 요오드화수소 | 저자극산 | 요오드산 | 요오드산 | 주기산 |
| 공식 | 안녕 | 히오 | 히오2 | 히오3 | HIO4 또는 HIO56 |
참조
- ^ "Iodic acid" (PDF).
- ^ Holleman, Arnold F.; Wiberg, Nils (2007). Lehrbuch der Anorganischen Chemie (in German) (102nd ed.). Berlin. ISBN 978-3-11-017770-1.
- ^ Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (2nd ed.). Butterworth-Heinemann. p. 863. ISBN 978-0-08-037941-8.
- ^ Rogers, Max T.; Helmholz, Lindsay (1941). "The Crystal Structure of Iodic Acid". J. Am. Chem. Soc. 63 (1): 278–284. doi:10.1021/ja01846a068.
- ^ Ståhl, Kenny; Szafranski, Marek (1992). "A Single-Crystal Neutron Diffraction Study of HIO3 at 295 and 30 K and of DIO3 at 295 K". Acta Chem. Scand. 46: 1146–1148. doi:10.3891/acta.chem.scand.46-1146.
- ^ Fischer, Andreas; Lindsjö, Martin (2005). "γ-HIO3 – a Metastable, Centrosymmetric Polymorph of Iodic Acid". Z. Anorg. Allg. Chem. 631 (9): 1574–1576. doi:10.1002/zaac.200500099.
- ^ Wu, Tao; Zavalij, Peter Y.; Zachariah, Michael R. (2017). "Crystal structure of a new polymorph of iodic acid, δ-HIO3, from powder diffraction". Powder Diffraction. 32 (4): 261–264. doi:10.1017/S0885715617000859.
- ^ Smith, Dylan K.; Unruh, Daniel K.; Pantoya, Michelle L. (2018). "Discovery of β-HIO3: A Metastable Polymorph of HIO3". Adv. Mater. Phys. Chem. 8 (5). doi:10.4236/ampc.2018.85016.246-256