브롬산
Bromous acid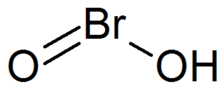 | |
 | |
 | |
| 이름 | |
|---|---|
| IUPAC 이름 히드록시브로마논3 하이드록시도브로민 브롬산 | |
| 식별자 | |
3D 모델(JSmol) | |
| 체비 | |
| 켐스파이더 | |
PubChem CID | |
CompTox 대시보드 (EPA ) | |
| |
| |
| 특성. | |
| HBrO2 | |
| 몰 질량 | 112.120 g/140 |
| 켤레 기저 | 브롬산염 |
| 관련 화합물 | |
기타 음이온 | 브롬산, 하이포브롬산, 브롬산, 과브롬산 |
달리 명시되지 않은 한 표준 상태(25°C[77°F], 100kPa)의 재료에 대한 데이터가 제공됩니다. | |
브롬산은 HBrO의2 식으로 이루어진 무기화합물이다.이것은 불안정한 화합물이지만, 그것의 결합 염기인 브롬산염은 분리되었다.산성 용액에서 브롬산염은 브롬으로 [1]분해된다.
검출
1905년 리처드 A.H.는 질산은(AgNO3)과 브롬을 [2]포함한 일련의 실험을 통해 브롬산의 존재를 증명했다.과잉 냉수 수분이 차아브롬산(HBrO), 브롬화은(AgBr) 및 질산3(HNO)을 형성하는 반응:
- Br2 + AgNO3 + HO2 → HBrO + AgBr + HNO3
Richards는 농축 질산 은(AgNO)에3 여분의 액체 브롬을 첨가하는 효과가 다른 반응 메커니즘을 발생시킨다는 것을 발견했습니다.이전 반응에서 형성된 산 브롬의 등가 부분 수로부터 산소와 브롬의 비율을 O:Br(0.149975:0.3745)의 정확한 값으로 계산하여 산 화합물이 2개의 산소 원자와 1개의 브롬 원자를 포함하고 있음을 시사했다.따라서 산성 화합물의 화학적 구조는 HBrO로2 [2]차감되었다.
Richards에 따르면 차아브롬산(HBromous acid, HBrO)은 브롬과 질산은의 [2]반응에 의해 발생합니다.
- Br2 + AgNO3 + HO2 → HBrO + AgBr + HNO3
- 23 AgNO + HBrO + Br22 + HO → HBrO2 + 2 AgBr + 23 HNO
이성질
HBrO2 분자는 γ(H-O-Br) 각도가 106.1°인 굽은 구조를 가지고 있다.또한 HOBRO는 74.2°의 이면각θ(H-O-Br-O)를 채용한 하나의 이성체 구조(2a)에 대해 비평면 구조를 채용하고 있다.또한 다른 2개의 이성질체(2b-cis 및 2c-trans)의 평면구조는 고속 에난티오머화를 [3]위한 전이상태이다.
또 다른 연구는 HOOBr, HOBr, HOBrO, HBr([4]O)O의 세 가지 이성질체를 확인했다.
합성
차아브롬산(HBrO)과 차아염소산(HCl)의 산화반응을 이용하여 브롬산(HBrO2)과 염산(HCl)[5]을 제조할 수 있다.
- HBrO + HClO → HBrO2 + HCl
하이포브롬산(HBrO)의 산화환원반응은 [5]브롬산(HBrO2)을 생성물로 형성할 수 있다.
- HBrO + HO2 - 2e− → HBrO2 + 2H+
두 가지 동등한 하이포브롬산(HBroomous acid, HBr)의 불균형 반응은 브롬산(HBroomous2 acid, HBr)과 하이드로브롬산(HBr)[5]을 모두 형성한다.
- 2 HBrO → HBrO2 + HBr
브롬산(HBrO3)과 브롬산(HBr)의 합성 비율에 의해 발생하는 재배열 반응은 다음과 같이 브롬산(HBrO2)[5]을 생성한다.
- 2 HBrO3 + HBr → 3 HBrO2
브롬산나트륨
염류2 NaBrO · 3HO2 및 Ba(BrO2)..2HO가2 결정되었습니다.이들 수용액을 Pb2+, Hg, Ag의2++ 소금으로 처리하면 대응하는 중금속 브롬산염이 [1]고체로서 침전된다.
벨루소프-자보틴스키 반응
브롬산은 브롬산칼륨, 세륨의 조합에 의한 벨루소프-자보틴스키 반응의 산물이다.IV) 희황산 중의 황산, 프로판디오산 및 구연산.브롬산은 브롬산 이온(BrO−
3)과 브롬산(Br−)[6][7] 사이의 중간 반응 단계이다.
- BrO−
3 + 2 Br− → HBrO2 + HBro
이러한 진동 반응에 관련된 다른 반응은 다음과 같다.
- HBrO2 + BrO−
3 + H+ → 2 BrO•
2 + HO2 - 2 HBrO2 → BrO−
3 + HOBr + H+
브롬산염은 과망간산염을 망간산염(VI)[1]으로 환원합니다.
- 2−
4 MnO + BrO−
2 + OH− → 2 MnO2−
4 + BrO−
3 + HO2
pKa 측정
그 산의 해리 아브롬산, Ka).mw-parser-output .sfrac{white-space:nowrap}.mw-parser-output.sfrac.tion,.mw-parser-output.sfrac .tion{디스플레이:inline-block, vertical-align:-0.5em, font-size:85%;text-align:센터}.mw-parser-output.sfrac .num,.mw-parser-output.sfrac .den{디스플레이:블록, line-height:1em, 마진:00.1em}.mw-parser-o의 상수입니다.Utput.sfrac .den{border-top:1px 고체}.mw-parser-output .sr-onlyᆭ[H+][BrO−2][HBrO2], 다른 메서드를 사용하여 결심했다.
브롬산염의 분해를 연구한 연구에서 브롬산염의 pKa 값을 추정하였다.연구는 수소와 브롬산 이온 농도의 함수로 브롬산염 분해 속도를 측정했다.초기 속도 로그의 실험 데이터는 pH에 대해 플롯되었다.이 방법을 사용하여 브롬산에 대한 추정a pK 값은 6.[8]25였다.
또 다른 방법으로 브롬산염 pK는a 25°C에서 2.9~8.0의 pH 범위에서 브롬산나트륨과 요오드칼륨의 초기 반응속도에 기초하여 측정하였으며, 이온강도는 0.06M이었다.4.5 – 8.0의 pH 범위에서+ [H]에 대한 이 불균형 반응의 초기 속도의 1차 의존성.이 방법으로 측정한 산 해리 상수 값은 K = (3.7±0.9)×10−4 M, pKa = 3.43±0.[9]05이다a.
반응성
다른 산소 중심 산화제(하이포할라이트, 과산화물의 음이온)에 비해 염기가 낮기 때문에 브롬산염은 다소 약한 [10]친핵체이다.카보레이션 및 수용체 치환 올레핀에 대한 브롬산염의 속도 상수는 하이포브롬산염으로 측정한 것보다 1~3배 낮다.
레퍼런스
- ^ a b c Egon Wiberg, Arnold Frederick Holleman (2001) 무기화학, Elsevier ISBN0-12-352651-5
- ^ a b c "Journal of the Society of Chemical Industry. v.25 1906". HathiTrust. Retrieved 2017-04-28.
- ^ Glaser, Rainer; Jost, Mary (2012-08-16). "Disproportionation of bromous acid HOBrO by direct O-transfer and via anhydrides O(BrO)2 and BrO-BrO2. An ab initio study of the mechanism of a key step of the Belousov–Zhabotinsky oscillating reaction". The Journal of Physical Chemistry A. 116 (32): 8352–8365. Bibcode:2012JPCA..116.8352G. doi:10.1021/jp301329g. ISSN 1520-5215. PMID 22871057.
- ^ Souza, Gabriel L. C. de; Brown, Alex (2016-07-01). "The ground and excited states of HBrO2 [HOOBr, HOBrO, and HBr(O)O] and HBrO3 (HOOOBr and HOOBrO) isomers". Theoretical Chemistry Accounts. 135 (7): 178. doi:10.1007/s00214-016-1931-8. ISSN 1432-881X. S2CID 99067360.
- ^ a b c d C., Ropp, R. (2013-01-01). Encyclopedia of the alkaline earth compounds. Elsevier. ISBN 9780444595508. OCLC 964753424.
- ^ Vassalini, Irene; Alessandri, Ivano (2015). "Spatial and Temporal Control of Information Storage in Cellulose by Chemically Activated Oscillations". ACS Applied Materials & Interfaces. 7 (51): 28708–28713. doi:10.1021/acsami.5b11857. PMID 26654462.
- ^ Field, Richard J.; Koros, Endre; Noyes, Richard M. (1972-12-01). "Oscillations in chemical systems. II. Thorough analysis of temporal oscillation in the bromate-cerium-malonic acid system". Journal of the American Chemical Society. 94 (25): 8649–8664. doi:10.1021/ja00780a001. ISSN 0002-7863.
- ^ Massagli, A. (1970-01-01). "Kinetic investigation of the decomposition of bromite - ScienceDirect". Inorganica Chimica Acta. 4: 593–596. doi:10.1016/S0020-1693(00)93357-7.
- ^ Faria, R. B.; Epstein, Irving R.; Kustin, Kenneth (1994-01-01). "Kinetics of Disproportionation and pKa of Bromous Acid". The Journal of Physical Chemistry. 98 (4): 1363–1367. doi:10.1021/j100055a051. ISSN 0022-3654.
- ^ Mayer, Robert J.; Ofial, Armin R. (2018-02-22). "Nucleophilic Reactivities of Bleach Reagents". Organic Letters. 20 (10): 2816–2820. doi:10.1021/acs.orglett.8b00645. PMID 29741385.


