규산
Silicic acid이 기사는 검증을 위해 추가적인 인용이 필요합니다. 찾기 : acid – · · 책 · (2022년 7월)(이 를 및 |
화학에서, 이산화규산(/s ɪˈ ɪs ɪk/)은 산화물()에 부착된 규소 원소를 포함하는 모든 화학 화합물입니다. =O) 및 하이드록실(-OH) 그룹이며, 일반식은 [HSiO] 또는 동등하게 [SiO(OH)]입니다.오르토실릭산이 대표적인 예입니다.규산은 분리되어 관찰되는 경우는 드물지만 해수를 포함한 수용액에 존재하여 생물광물화에 역할을 하는 것으로 생각됩니다.[3]그들은 일반적으로 물에 거의 용해되지 않는 무색의 약한 산입니다.그들의 더 잘 알려진 결합 염기인 규산염 음이온과 마찬가지로, 규산은 올리고머성 또는 중합체성으로 제안됩니다.단순한 규산은 발견된 적이 없는데, 이 종들은 주로 이론적으로 관심이 있기 때문입니다.
존재하는 실리콘 원자의 수에 따라 모노- 및 폴리실릭(다이-, 트라이-, 테트라실릭 등) 산이 있습니다.잘 정의된 규산은 X선 결정학을 특징으로 하는 형태로 얻어지지 않았습니다.
예
| 공식 | 이름. | 계산 구조 |
|---|---|---|
| HSiO 4 4 또는 Si(OH) 4 | 오르토실릭산 |  |
| HSiO 2 3 또는 SiO(OH) 2 | 메타규산 |  |
| HSiO 6 2 7 또는 O(Si(OH)) 3 2 | 피로규산 | 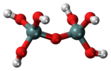 |
| HSiO 2 2 5 또는 SiO 2 3(OH) 2 | 이산화규산 |  |
반응
규산은 실리카의 수화된 형태, 즉 2 HSiO = SiO·(HO)로 볼 수 있습니다.사실, 농축 용액에서, 규산은 일반적으로 중합되고 응축되며, 궁극적으로 이산화규소와 물로 분해됩니다.중간 단계는 매우 두꺼운 액체 또는 젤과 같은 고체일 수 있습니다.[4][5][6]후자를 탈수하면 원자 크기의 기공을 가진 단단한 반투명 형태의 실리카가 생성되는데, 이는 흡수제와 건조제로 널리 사용됩니다.
실리카는 물에[citation needed] 매우 드물게 용해되며 100 ppm 미만의 농도로 바닷물에 존재합니다.이러한 희석 용액에서 실리카는 오르토실릭산으로 존재하는 것으로 가정됩니다.이론적 계산에 의하면 물에서 실리카의 용해는 SiO2·2의 형성을 통해 진행됩니다.HO2 complex 그리고 오르토실릭산.[7]
화학식 HSiO에23 의해 암시되는 메타규산의 실리콘-산소 이중 결합은 가상적이거나 매우 불안정합니다.이러한 이중 결합은 한 쌍의 하이드록실(-OH) 그룹에 수화될 수 있습니다.[4]
예를들면,
아니면
대안적으로, 메타규산은 고리형 폴리머 [-SiO(OH)-]를 형성하기 쉽고, 이는 사슬형 폴리머 HO[-SiO(OH)-]H로의 수화에 의해 개방될 수 있습니다. 유사하게, 디규산은 4가 단위인 [=SiO(OH)=]를 갖는 복합 폴리머를 형성하기 쉽습니다.반대로 올리고머산과 고분자산은 Si-O-Si 브리지의 가수분해에 의해 탈중합될 수도 있고, 그러한 브리지는 축합에 의해 생성될 수도 있습니다.
유기 실란올과 마찬가지로, 규산은 약한 산입니다.오르토실릭산은 25 °C에서 해리 전위 pK = 9.84, pK = 13.2를 계산했습니다.
용액 내의 규산과 규산염은 몰리브데이트 음이온과 반응하여 황색 규산염 복합체를 생성합니다.이 반응은 수용액 중 실리콘의 함량을 적정화하고 그 특성을 결정하는 데 사용되어 왔습니다.전형적인 제제에서, 단량체 오르토실릭산은 75초 만에, 이량체 파이로실릭산은 10분 만에, 더 높은 올리고머는 상당히 긴 시간에 완전히 반응하는 것으로 확인되었습니다.콜로이드 실리카에서는 반응이 관찰되지 않습니다.[8]
수용액 중 규산의 중합 정도는 용액의 어는점에 미치는 영향(크라이오스코프)으로 판단할 수 있습니다.[8]
역사
이산화규소(실리카, 석영)가 물에 용해되는 것을 설명하기 위해 19세기 초에 얀스 야코프 베르젤리우스(Jöns Jacob Berzelius)에 의해, 즉 수화 반응을 통해 이산화규소의 용해를 설명했습니다.
실리카겔에 대한 증기압 곡선을 바탕으로, Reinout Willem Van Bemellen은 실리카 수화물은 존재하지 않으며, 오직 실리카겔만 존재한다고 주장했습니다.반면에, Gustav Tschermak von Seysenegg는 그가 천연 규산염 겔의 분해 생성물로서 다른 규산을 관찰했다고 믿었습니다.[9]
최초의 결정형 규산은 1924년에 필로실리케이트 나트로실라이트(NaSiO225)로부터 제조되었습니다.15개 이상의 결정성 산이 알려져 있고 적어도 6개의 HSiO225 변형을 포함합니다.일부 산은 유기 분자를 흡착하고 삽입할 수 있으므로 실리카의 흥미로운 대안이 됩니다.[10]
준비
결정성 규산은 이온 교환 수지를 사용하여 규산 나트륨 용액에서 양이온을 제거하거나 규산 나트륨을 농축 황산으로 처리하여 제조할 수 있습니다.[10]
참고 항목
참고문헌
- ^ Greenwood, N. N.; Earnshaw, A. (2012). Chemistry of the Elements. Elsevier Science. p. 346. ISBN 978-0-08-050109-3. Retrieved July 27, 2022.
- ^ Iler, R. K. (1979). The Chemistry of Silica. New York: Wiley. ISBN 0-471-02404-X.
- ^ Frank Wigglesworth Clarke (1914). "The Silicic Acids" (PDF). The Constitution of the Natural Silicates. pp. 10–19.
- ^ a b W.E. 계와 W.J. 퍼디(1922): "콜로이드 실리카의 독성.I: 대용량 투여에 따른 비경구 투여의 효과"영국 실험병리학 저널 제3권 2호 75-85페이지PMC 2047780.
- ^ 고토 카츠미(1956): "규산의 중합에 대한 pH의 영향"물리화학회지 제60권 제7호 1007-1008페이지 도이:10.1021/j150541a046
- ^ 한스 램버그(Hans Ramberg, 1952): "규산염 내 양이온의 화학적 결합과 분포"지질학 저널 제60권 4호 331-355쪽 도이:10.1086/625982
- ^ 바스카 몬달, 디판위타 고쉬, 아브히짓 K.Das (2009):"규산 형성 반응을 위한 열화학: 새로운 반응 경로 예측"화학물리학 편지, 제478권, 제4-6호, 115-119쪽. 도이:10.1016/j.cplett. 2009.07.063.
- ^ a b G. B. Alexander (1953): "몰리브산에 대한 저분자량 규산의 반응"미국화학회지 제75권 제22호 5655-5657페이지 도이:10.1021/ja01118a054
- ^ Robert Schwarz; Ernst Menner (1924), "Zur Kenntnis der Kieselsäuren", Ber. Dtsch. Chem. Ges. (in German), 57 (8): 1477–1481, doi:10.1002/cber.19240570850.
- ^ a b "Silicates", Ullmann's Encyclopedia of Industrial Chemistry (7th ed.), 2007, doi:10.1002/14356007.a23_661.







