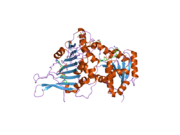포도당-6-인산염 탈수소효소
Glucose-6-phosphate dehydrogenase| 포도당-6-인산염 탈수소효소, NAD 결합 도메인 | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 레우코노스톡 메센테로이드를 통한 포도당 6-산소 탈수소효소 | |||||||||
| 식별자 | |||||||||
| 기호 | G6PD_N | ||||||||
| Pfam | PF00479 | ||||||||
| Pfam 씨 | CL0063 | ||||||||
| 인터프로 | IPR022674 | ||||||||
| 프로사이트 | PDOC00067 | ||||||||
| SCOP2 | 1dpg / SCOPe / SUPFAM | ||||||||
| |||||||||
| 포도당-6-인산염 탈수소효소 | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| 식별자 | |||||||||
| EC 번호 | 1.1.1.49 | ||||||||
| CAS 번호. | 9001-40-5 | ||||||||
| 데이터베이스 | |||||||||
| 인텐츠 | IntEnz 뷰 | ||||||||
| 브렌다 | 브렌다 입력 | ||||||||
| 엑스퍼시 | 나이스자이메 뷰 | ||||||||
| 케그 | KEG 입력 | ||||||||
| 메타사이크 | 대사통로 | ||||||||
| 프리암 | 프로필 | ||||||||
| PDB 구조 | RCSB PDB PDBe PDBsum | ||||||||
| 진 온톨로지 | 아미고 / 퀵고 | ||||||||
| |||||||||
포도당-6-인산염 탈수소효소(G6PD 또는 G6PDH) (EC 1.1.1.49)는 화학반응을 촉진하는 세포질 효소다.
- D-글루코스 6-인산 + NADP+ + H2O ⇌ 6-인산-D-글루코노-1,5-락톤 + NADPH+ + H
이 효소는 코엔자임 니코틴아미드 아데닌 디뉴클레오티드 인산염(NADPH)의 수준을 유지하여 세포에 감소 에너지를 공급하는 대사 경로인 펜토오스 인산염 경로(이미지 참조)에 참여한다. 또한 NADPH는 과산화수소 같은 화합물로부터 오는 산화적 손상으로부터 적혈구를 보호하는 데 도움을 주는 이들 세포의 글루타티온 수치를 유지한다.[1] 더 큰 양적 중요성은 간, 유선, 지방 조직, 부신 등과 같은 지방산이나 이소프로노이드의 생합성에 관련된 조직에 대한 NADPH의 생산이다. G6PD는 포도당-6-인산염을 산화시키면서 NADPH로 NADP를+ 감소시킨다.[2]
임상적으로 G6PD의 X연계 유전적 결핍으로 인해 인간은 면역성 용혈성 빈혈에 걸리기 쉽다.[3]
종 분포
G6PD는 박테리아에서 인간에 이르기까지 많은 종에 널리 분포되어 있다. 서로 다른 유기체로부터 100개 이상의 알려진 G6PD의 다중 시퀀스 정렬은 30%에서 94%[4]까지의 시퀀스 정체성을 보여준다. 인간 G6PD는 아미노산 염기서열에서 다른 종의 G6PD 염기서열에서 30% 이상의 정체성을 가지고 있다.[5] 인간은 또한 G6PD를 위한 하나의 유전자 코딩의 두 개의 등소 형태를 가지고 있다.[6] 게다가, 이 유전자에서 적어도 168개의 질병을 유발하는 돌연변이가 발견되었다.[7] 이러한 돌연변이는 주로 아미노산을 대체하게 되는 오식 돌연변이며,[8] 그 중 일부는 G6PD 결핍을 초래하지만, 다른 일부는 뚜렷한 기능적 차이를 초래하지 않는 것으로 보인다.[8] 몇몇 과학자들은 인간 G6PD의 유전적 변화 중 일부는 말라리아 감염에 대한 적응에서 비롯되었다고 제안했다.[9]
다른 종들도 G6PD의 변화를 경험한다. 상위 발전소에서는, Cytosol, 플라스티딕 스트로마, 페록시솜에 국부화된 G6PDH의 여러 가지 이소 형태가 보고되었다.[10] 변형된 F 의존성420(NADP+ 의존성과는 반대) G6PD가 마이코박테리움 결핵에서 발견되어 결핵 치료에 관심이 있다.[11] Lewconostoc 메센테로이드에서 발견된 박테리아 G6PD는 G6P 외에도 4-히드록시논에 반응하는 것으로 나타났다.[12]
효소구조

G6PD는 일반적으로 두 개의 동일한 모노머의 조광기로서 발견된다(주 썸네일 참조).[8] 이러한 조광기는 pH와 같은 조건에 따라 스스로 조광하여 테트라머를 형성할 수 있다.[5] 단지 내 각 모노머에는 G6P에 바인딩하는 기질 결합 부위와 로스만 폴드를 이용해 NADP+/NADPH에 바인딩하는 촉매 코엔자임 결합 부지가 있다.[4] 인간과 같은 일부 상위 유기체의 경우 G6PD는 G6PD가 촉매하는 반응에 직접 참여하지 않는 NADP+ 구조 사이트라고 불리는 추가 NADP+ 결합 사이트를 포함하고 있다. NADP+ 구조 현장의 진화 목적은 알려지지 않았다.[4] 크기에 관해서는, 각각의 모노머는 약 500개의 아미노산(인간의[5] 경우 514개의 아미노산)이다.
Functional and structural conservation between human G6PD and Leuconostoc mesenteroides G6PD points to 3 widely conserved regions on the enzyme: a 9 residue peptide in the substrate binding site, RIDHYLGKE (residues 198-206 on human G6PD), a nucleotide-binding fingerprint, GxxGDLA (residues 38-44 on human G6PD), and a partially conserved sequence E기질 결합 현장(인간 G6PD에 대해 170-174로 표시됨) 근처의 KPxG. 여기서 우리는 가변 아미노산을 나타내기 위해 "x"를 사용한다.[4] G6PD의 결정 구조는 G6P, 물 분자 3개, 라이신 3개, 아르기닌 1개, 히스티딘 2개, 글루타민산 2개, 기타 극성 아미노산을 포함하는 정전기 상호작용과 수소 결합의 광범위한 네트워크를 보여준다.
위치 172의 프로라인은 기질인 G6P에 관해서 Lys171을 정확하게 위치시키는 데 결정적인 역할을 한다고 생각된다. 정상 인간 G6P의 두 결정 구조에서는 Pro172가 시스 순응에서만 나타나는 반면, 돌연변이를 일으키는 한 질병의 결정 구조에서는(변수 캔턴 R459L), Pro172가 거의 배타적으로 보인다.transformation에 y.[4]
수정 구조에 접근하면서, 일부 과학자들은 다른 돌연변이들의 구조를 모형화하려고 시도했다. 예를 들어 G6PD 결핍에 의한 효소병증이 드물게 나타나는 독일의 조상에서 G6PD의 돌연변이 사이트는 G6P 결합 사이트인 NADP+ 결합 사이트 근처에, 그리고 두 모노머 사이의 인터페이스 근처에 놓여 있는 것으로 나타났다. 따라서 이러한 임계 영역에서의 돌연변이는 G6PD의 기능을 완전히 방해하지 않고서도 가능하다.[8] 실제로 G6PD 돌연변이를 일으키는 대부분의 질병은 NADP+ 구조 현장 근처에서 발생하는 것으로 나타났다.[13]
NADP+ 구조 현장
NADP+ 구조 현장은 기질 결합 현장과 촉매 코엔자임 NADP+ 결합 현장에서 20˚ 이상 떨어져 있다. 효소 촉매 반응에서의 그것의 목적은 수년 동안 명확하지 않았다. 한동안, NADP+ 결합은 효소 모노머의 조광화를 위해 필요하다고 생각되었다. 그러나 이는 잘못된 것으로 나타났다.[13] 반면 구조 현장에 NADP가+ 존재하면 다이머의 조광화를 촉진해 효소 테트라머를 형성하는 것으로 나타났다.[13] 또한 촉매 활성에는 테트라머 상태가 필요하다고 생각되었지만, 이 역시 거짓으로 밝혀졌다.[13] NADP+ 구조 부지는 NADP+ 촉매 코엔자임 결합 부위와 상당히 다르며 뉴클레오티드 결합 지문을 포함하고 있다.
NADP에+ 바인딩된 구조 현장은 그것을 단단히 바인딩하는 유리한 상호작용을 가지고 있다. 특히 정전기 전하가 4개의 물 분자와 수소 결합을 통해 여러 원자에 걸쳐 확산되는 강력한 수소 결합 네트워크가 존재한다(그림 참조). 더욱이 overlapping계통이 중복되는 극히 강한 소수성 적층 상호작용의 집합이 있다.
구조 부위는 효소의 장기적인 안정성을 유지하는 데 중요한 것으로 나타났다.[13] 40개 이상의 심각한 등급 I 돌연변이는 구조 현장 근처에서 돌연변이를 일으켜 체내에서 이러한 효소의 장기적 안정성에 영향을 미치며 궁극적으로 G6PD 결핍을 초래한다.[13] 예를 들어, 두 개의 심각한 등급 I 돌연변이 G488S와 G488V는 NADP와+ 구조 현장 사이의 분리 상수를 7 - 13배 크게 증가시킨다. 잔류물 488이 Arg487에 근접함에 따라 위치 488의 돌연변이가 NADP에+ 상대적인 Arg487의 위치에 영향을 미쳐 결합을 방해할 수 있다고 생각된다.[13]
규정
G6PD는 G6P를 6-phosphoglucono-Δ-lactone로 변환하며 펜토오스 인산염 경로의 속도제한 효소다. 그러므로 G6PD의 규제는 나머지 펜토오스 인산염 경로의 활동에 대한 다운스트림 결과를 가지고 있다.
포도당-6-인산염 탈수소효소는 기질 G6P에 의해 자극된다. 생합성에 관여하는 조직의 세포솔에서 NADPH/NADP의 통상적인 비율은 약 100/1이다. 지방산 생합성에 대한 NADPH 활용도가 높아지면 NADP+ 수준이 획기적으로 높아져 G6PD가 NADPH를 더 많이 생산하도록 자극할 것이다. 효모 G6PD는 두 개의 이전 간행물에[14][15] 따르면 긴 체인 지방산에 의해 억제되며 NADPH를 필요로 하는 지방산 합성의 제품 억제일 수 있다.
G6PD는 진화적으로 보존된 잔류물인 라이신 403(Lys403)의 아세틸화에 의해 부정적으로 조절된다. K403 아세틸레이트 G6PD는 활성 조광기를 형성할 수 없으며 완전한 활동 손실을 나타낸다. 기계학적으로 아세틸레이팅 라이스403은 NADP++ 구조 현장에 NADP가 들어가는 것을 강직하게 방해해 효소의 안정성을 떨어뜨린다. 세포는 세포외 산화 자극을 감지하여 SIRT2 의존적인 방식으로 G6PD 아세틸화를 감소시킨다. SIRT2 매개 탈산화와 G6PD 활성화는 Pentose phosphate 경로를 자극하여 세포질 NADPH를 공급하여 산화손상에 대항하고 마우스 적혈구를 보호한다.[16]
규제는 유전적 경로를 통해서도 발생할 수 있다. 이소 형식인 G6PDH는 전사 및 사후 변환 계수에 의해 규제된다.[17] 더욱이 G6PD는 전사인자 저산소 유도인자 1(HIF1)에 의해 활성화되는 다수의 당화 효소 중 하나이다.[18]
임상적 유의성
G6PD는 유전적 다양성으로 유명하다. 대부분 오식 변이로부터 생산되는 G6PD의 많은 변종들은 광범위한 효소 활성도와 관련 임상 증상으로 설명되어 왔다. 다른 ISO 양식을 인코딩하는 두 개의 대본 변형이 이 유전자에 대해 발견되었다.[19]
포도당-6-인산염 탈수소효소 결핍증은 세계적으로 매우 흔하며, 간단한 감염이나 파바콩 섭취, 특정 약품, 항생제, 항균제, 항염증 등이 있을 때 급성 용혈성 빈혈을 유발한다.[3]
세포 성장과 증식은 G6PD의 영향을 받는다.[20] 약리학적으로 감소하는 G6PD는 유방암 세포와 안트라시클린의 교차지속성을 극복하는 것으로 나타났다. [21] G6PD 억제제는 암과 다른 조건들을 치료하기 위해 조사중이다.[18] 시험관내 세포확산검사에서는 G6PD 억제제인 데히드로에피안드로스테론(DHEA)과 ANAD(6-아미노노니오틴아미드)가 AML 세포 라인의 성장을 효과적으로 감소시킨다는 것을 나타낸다.[20][22] G6PD는 급성 골수성 백혈병 K403에서 저메틸화되며, SIRT2는 G6PD를 활성화하여 NADPH 생산을 강화하고 백혈병 세포 증식을 촉진한다.[22]
참고 항목
참조
- ^ Thomas D, Cherest H, Surdin-Kerjan Y (March 1991). "Identification of the structural gene for glucose-6-phosphate dehydrogenase in yeast. Inactivation leads to a nutritional requirement for organic sulfur". The EMBO Journal. 10 (3): 547–53. doi:10.1002/j.1460-2075.1991.tb07981.x. PMC 452682. PMID 2001672.
- ^ Aster J, Kumar V, Robbins SL, Abbas AK, Fausto N, Cotran RS (2010). Robbins and Cotran Pathologic Basis of Disease. Saunders/Elsevier. pp. Kindle Locations 33340–33341. ISBN 978-1-4160-3121-5.
- ^ a b Cappellini MD, Fiorelli G (January 2008). "Glucose-6-phosphate dehydrogenase deficiency". Lancet. 371 (9606): 64–74. doi:10.1016/S0140-6736(08)60073-2. PMID 18177777. S2CID 29165746.
- ^ a b c d e Kotaka M, Gover S, Vandeputte-Rutten L, Au SW, Lam VM, Adams MJ (May 2005). "Structural studies of glucose-6-phosphate and NADP+ binding to human glucose-6-phosphate dehydrogenase" (PDF). Acta Crystallographica D. 61 (Pt 5): 495–504. doi:10.1107/S0907444905002350. PMID 15858258.
- ^ a b c Au SW, Gover S, Lam VM, Adams MJ (March 2000). "Human glucose-6-phosphate dehydrogenase: the crystal structure reveals a structural NADP(+) molecule and provides insights into enzyme deficiency". Structure. 8 (3): 293–303. doi:10.1016/S0969-2126(00)00104-0. PMID 10745013.
- ^ "G6PD glucose-6-phosphate dehydrogenase [ Homo sapiens (human) ]". NCBI. Retrieved 13 December 2015.
- ^ Šimčíková D, Heneberg P (December 2019). "Refinement of evolutionary medicine predictions based on clinical evidence for the manifestations of Mendelian diseases". Scientific Reports. 9 (1): 18577. doi:10.1038/s41598-019-54976-4. PMC 6901466. PMID 31819097.
- ^ a b c d Kiani F, Schwarzl S, Fischer S, Efferth T (July 2007). "Three-dimensional modeling of glucose-6-phosphate dehydrogenase-deficient variants from German ancestry". PLOS ONE. 2 (7): e625. Bibcode:2007PLoSO...2..625K. doi:10.1371/journal.pone.0000625. PMC 1913203. PMID 17637841.
- ^ Luzzatto L, Bienzle U (June 1979). "The malaria/G.-6-P.D. hypothesis". Lancet. 1 (8127): 1183–4. doi:10.1016/S0140-6736(79)91857-9. PMID 86896. S2CID 31214682.
- ^ Corpas FJ, Barroso JB, Sandalio LM, Distefano S, Palma JM, Lupiáñez JA, Del Río LA (March 1998). "A dehydrogenase-mediated recycling system of NADPH in plant peroxisomes". The Biochemical Journal. 330 (Pt 2): 777–84. doi:10.1042/bj3300777. PMC 1219205. PMID 9480890.
- ^ Bashiri G, Squire CJ, Moreland NJ, Baker EN (June 2008). "Crystal structures of F420-dependent glucose-6-phosphate dehydrogenase FGD1 involved in the activation of the anti-tuberculosis drug candidate PA-824 reveal the basis of coenzyme and substrate binding". The Journal of Biological Chemistry. 283 (25): 17531–41. doi:10.1074/jbc.M801854200. PMID 18434308.
- ^ Szweda LI, Uchida K, Tsai L, Stadtman ER (February 1993). "Inactivation of glucose-6-phosphate dehydrogenase by 4-hydroxy-2-nonenal. Selective modification of an active-site lysine". The Journal of Biological Chemistry. 268 (5): 3342–7. doi:10.1016/S0021-9258(18)53699-1. PMID 8429010.
- ^ a b c d e f g Wang XT, Chan TF, Lam VM, Engel PC (August 2008). "What is the role of the second "structural" NADP+-binding site in human glucose 6-phosphate dehydrogenase?". Protein Science. 17 (8): 1403–11. doi:10.1110/ps.035352.108. PMC 2492815. PMID 18493020.
- ^ Eger-Neufeldt I, Teinzer A, Weiss L, Wieland O (March 1965). "Inhibition of glucose-6-phosphate dehydrogenase by long chain acyl-coenzyme A". Biochemical and Biophysical Research Communications. 19 (1): 43–48. doi:10.1016/0006-291X(65)90116-6.
- ^ Kawaguchi A, Bloch K (September 1974). "Inhibition of glucose 6-phosphate dehydrogenase by palmitoyl coenzyme A". The Journal of Biological Chemistry. 249 (18): 5793–800. doi:10.1016/S0021-9258(20)79887-X. PMID 4153382.
- ^ Wang YP, Zhou LS, Zhao YZ, Wang SW, Chen LL, Liu LX, Ling ZQ, Hu FJ, Sun YP, Zhang JY, Yang C, Yang Y, Xiong Y, Guan KL, Ye D (June 2014). "Regulation of G6PD acetylation by SIRT2 and KAT9 modulates NADPH homeostasis and cell survival during oxidative stress". The EMBO Journal. 33 (12): 1304–20. doi:10.1002/embj.201387224. PMC 4194121. PMID 24769394.
- ^ Kletzien RF, Harris PK, Foellmi LA (February 1994). "Glucose-6-phosphate dehydrogenase: a "housekeeping" enzyme subject to tissue-specific regulation by hormones, nutrients, and oxidant stress". FASEB Journal. 8 (2): 174–81. doi:10.1096/fasebj.8.2.8119488. PMID 8119488. S2CID 38768580.
- ^ a b de Lartigue J (2012-06-12). "Cancer Research Moves Beyond the Original Hallmarks of Cancer". OncLive.
- ^ "Entrez Gene: G6PD glucose-6-phosphate dehydrogenase".
- ^ a b Tian WN, Braunstein LD, Pang J, Stuhlmeier KM, Xi QC, Tian X, Stanton RC (April 1998). "Importance of glucose-6-phosphate dehydrogenase activity for cell growth". The Journal of Biological Chemistry. 273 (17): 10609–17. doi:10.1074/jbc.273.17.10609. PMID 9553122.
- ^ Goldman A, Khiste S, Freinkman E, Dhawan A, Majumder B, Mondal J, et al. (August 2019). "Targeting tumor phenotypic plasticity and metabolic remodeling in adaptive cross-drug tolerance". Science Signaling. 12 (595). doi:10.1126/scisignal.aas8779. PMC 7261372. PMID 31431543.
- ^ a b Xu SN, Wang TS, Li X, Wang YP (September 2016). "SIRT2 activates G6PD to enhance NADPH production and promote leukaemia cell proliferation". Scientific Reports. 6: 32734. Bibcode:2016NatSR...632734X. doi:10.1038/srep32734. PMC 5009355. PMID 27586085.
추가 읽기
- Vulliamy T, Beutler E, Luzzatto L (1993). "Variants of glucose-6-phosphate dehydrogenase are due to missense mutations spread throughout the coding region of the gene". Human Mutation. 2 (3): 159–67. doi:10.1002/humu.1380020302. PMID 8364584. S2CID 46431236.
- Mason PJ (September 1996). "New insights into G6PD deficiency". British Journal of Haematology. 94 (4): 585–91. doi:10.1111/j.1365-2141.1996.tb00001.x. PMID 8826878. S2CID 221484452.
- Wajcman H, Galactéros F (August 2004). "[Glucose 6-phosphate dehydrogenase deficiency: a protection against malaria and a risk for hemolytic accidents]". Comptes Rendus Biologies (in French). 327 (8): 711–20. doi:10.1016/j.crvi.2004.07.010. PMID 15506519.