암모늄 철().II) 황산염
Ammonium iron(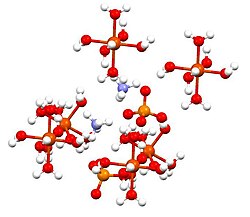 | |
 | |
| 이름 | |
|---|---|
| IUPAC 이름 암모늄 철().II) 황산염 | |
| 기타 이름 황산철암모늄 황산암모늄 모어의 소금 | |
| 식별자 | |
| |
3D 모델(JSmol) | |
| 체비 |
|
| 켐스파이더 | |
| ECHA InfoCard | 100.030.125 |
| EC 번호 |
|
펍켐 CID | |
| 유니 | |
CompTox 대시보드 (EPA) | |
| |
| |
| 특성. | |
| Fe(SO4)(NH4)(2SO4)(무수) Fe(SO4)(NH4)(2SO4)/6HO2(헥사하이드레이트) | |
| 어금질량 | 284.05 g mol−1(무수) 392.14 g mol−1(수화물) |
| 외관 | 청녹색 고체 |
| 밀도 | 1.86 g/cm3 |
| 녹는점 | 100 ~ 110 °C(212 ~ 230 °F, 373 ~ 383 K) |
| 비등점 | 해당되지 않음 |
| 269 g/L(헥사하이드레이트) | |
| 위험 | |
| GHS 라벨 표시: | |
 | |
| 경고 | |
| H315, H319, H335 | |
| P261, P264, P271, P280, P302+P352, P304+P340, P305+P351+P338, P312, P321, P332+P313, P337+P313, P362, P403+P233, P405, P501 | |
| NFPA 704(화재 다이아몬드) | |
| 안전 데이터 시트(SDS) | 피셔 MSDS |
| 관련 화합물 | |
관련 화합물 | 황산암모늄철(III) |
달리 명시된 경우를 제외하고, 표준 상태(25°C [77°F], 100 kPa)의 재료에 대한 데이터가 제공된다. | |
| Infobox 참조 자료 | |
암모늄 철().II) 황산염, 즉 모어의 소금은 (NH4)2Fe(SO4)(2HO2)라는 공식을 가진 무기 화합물이다2+. Fe와4+ NH라는 두 개의 다른 양이 함유된 황산염과 황산암모늄의 이중염으로 분류된다.6 쉽게 결정되기 때문에 흔한 실험실 시약이며, 결정체는 공기로 산화에 저항한다. 다른 철 황산염과 마찬가지로 철암모늄 황산염은 물에 녹아서 아쿠오 콤플렉스[Fe(HO2)]62+를 주는데, 이 아쿠오 콤플렉스는 팔면체 분자 기하학을 가지고 있다.[1] 그것의 광물 형태는 모하라이트다.
구조
이 화합물은 Shönites 또는 Tutton의 소금이라고 불리는 이중 황산염 그룹의 일원이다. 투튼의 염분은 단핵 결정을 형성하고 MN2(SO4)2.6HO2(M = 다양한 단핵화)라는 공식을 가지고 있다. 본딩과 관련하여 결정체는 황산염과 암모늄에 결합된 수소인 옥타헤드라[Fe(HO2)]62+ 중심부로 구성된다.[2]
모어의 소금은 독일의 화학자 칼 프리드리히 모어의 이름을 따온 것으로, 19세기에 적정화의 방법론에 있어서 많은 중요한 진보를 하였다.
적용들
분석 화학에서 이 소금은 산화 방지성이 있는 고체의 저장 수명이 길기 때문에 철 이온의 선호원이다. 이러한 안정성은 pH가 철/철분 리독스 커플에 미치는 영향을 반영하는 솔루션으로 다소 확장된다. 이 산화는 높은 pH에서 더 쉽게 발생한다. 암모늄 이온은 모어의 소금 용액을 약간 산성으로 만들어 이 산화 과정을 늦춘다.[1][3] 황산은 일반적으로 철에 대한 산화를 줄이기 위해 용액에 첨가된다.
그것은 높은 감마선량을 측정하기 위해 Fricke의 선량계에 사용된다.[4]
준비
모어의 소금은 황산을 약간 함유한 물에 수성 황산염과 황산암모늄의 등극 혼합물을 녹인 후 결정화에 영향을 주어 준비된다. 황산제철암모늄은 연한 녹색 결정체를 형성한다. 이 소금은 가열된 이온에 존재하는 모든 양이온과 음이온을 제공할 때 사용된다.
오염물질
일반적인 불순물로는 마그네슘, 니켈, 망간, 납, 아연이 있는데, 이 중 상당수는 이형성 염을 형성한다.[5]
참조
- ^ a b Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (2nd ed.). Butterworth-Heinemann. ISBN 978-0-08-037941-8.
- ^ Ephraim, Fritz (1926). Inorganic Chemistry. tr P. C. L. Thorne. London: Gurney and Jackson. pp. 484–485.
- ^ "Ammonium Ferrous Sulphate 100 g (Mohr's Salt)". 2012. Retrieved 13 June 2013.
- ^ Hickman, C.; Lorrain, S.; Barthe, J.R.; Portal, G. (1986). "Use of Mohr's Salt for High Level Gamma Dosimetry (Up to 108 Gy)". Radiation Protection Dosimetry. Oxford Journals. 17 (1–4): 255–257. doi:10.1093/oxfordjournals.rpd.a079818.
- ^ Vogel, Arthur I. (1961). A Text-book of Quantitative Inorganic Analysis Including Elementary Instrumental Analysis (3 ed.). Longmans. pp. 281–282.



