인산암모늄
Ammonium dihydrogen phosphate | |
 | |
 | |
| 이름 | |
|---|---|
| IUPAC 이름 인산암모늄 | |
| 기타 이름 모노암모늄인산 | |
| 식별자 | |
3D 모델(JSmol) | |
| 체비 | |
| 켐스파이더 | |
| ECHA InfoCard | 100.028.877 |
| EC 번호 |
|
| E 넘버 | E342(i) (대위, ...) |
펍켐 CID | |
| 유니 | |
CompTox 대시보드 (EPA) | |
| |
| |
| 특성. | |
| H6NO4P | |
| 어금질량 | 115.025 g·1911−1 |
| 외관 | 백색 결정체 |
| 냄새 | 없는 |
| 밀도 | 1.80 g/cm3 |
| 녹는점 | 190°C(374°F, 463K) |
| (g/dL) 28(10°C) 36(20°C) 44(30°C) 56(40°C) 66(50°C) 81(60°C) 99(70°C) 118(80°C) 173 (100 °C) [2][3] | |
| 용해성 | 에탄올에[2] 녹지 않는 아세톤에 녹지 않는. |
굴절률(nD) | 1.525 |
| 구조 | |
| 사방형의 | |
| 열화학 | |
의 성 엔탈피 대형화 (ΔfH⦵298) | −1445.07 kJ/mol[4] |
| 위험 | |
| GHS 라벨 표시: | |
 | |
| 경고 | |
| H319 | |
| P261, P264, P271, P280, P302+P352, P304+P340, P305+P351+P338, P312, P321, P332+P313, P337+P313, P362, P403+P233, P405, P501 | |
| NFPA 704(화재 다이아몬드) | |
| 치사량 또는 농도(LD, LC): | |
LD50(중간 선량) | 5750mg/kg(랫드, 구강) |
| 관련 화합물 | |
기타 음이온 | 인산암모늄 디아모늄 인산염 |
기타 양이온 | 모노소듐인산 이수소인산칼륨 |
달리 명시된 경우를 제외하고, 표준 상태(25°C [77°F], 100 kPa)의 재료에 대한 데이터가 제공된다. | |
| Infobox 참조 자료 | |
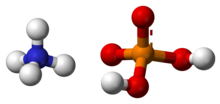
MAP(Monoammonium phosphate, Monoammonium phosphate, ADP)[5]는 화학 공식(NH4)(HPO24)을 가진 화학 화합물이다. ADP는 농업용 비료와[6] 일부 소화기의 주요 성분이다. 그것은 또한[7] 광학 및 전자공학에서도 상당한 용도를 가지고 있다.[8]
화학적 특성
모노암모늄 인산염은 물에 용해되며, 4각형 계통의 무수 염으로서, 긴 프리즘이나 바늘처럼 결정화된다.[7] 그것은 사실상 에탄올에서 불용성이다.[2]
고체 모노암모늄 인산염은 기체 암모니아 NH와
3 녹은 인산 HPO로
3
4 분해될 때 최대 200 °C의 온도에 대해 실제로 안정된 것으로 간주할 수 있다.[9] 125 °C에서 암모니아 부분 압력은 0.05 mm Hg이다.[10]
기압계 모노암모늄 인산염의 용액은 산성이다(0.1% 농도에서는 pH 4.7, 5%에서는 4.2).[11]
준비
모노암모늄 인산염은 인산과 암모니아의 발열 반응을 통해 산업적으로 준비된다.[12]
- NH
3 + HPO
3
4 → NHPO
6
4
결정 MAP가 침전한다.
사용하다
농업
무게에 의한 모노암모늄 인산염의 가장 큰 사용은 비료의 성분으로 농업에 있다. 식물이 사용할 수 있는 형태로 질소와 인 원소를 함유한 토양을 공급한다. NPK 라벨은 12-61-0(12-27-0)으로 원소 질소 중량 기준 12%, (공칭) 오산화 인의
2
5 61% 또는 원소 인의 27%를 함유하고 있다.
소화기
이 화합물은 일부 건식 화학 소화기의 ABC 분말 성분이기도 하다.
광학
모노암모늄 인산염은 광학분야에서 광학분야에서 광학특성으로 널리 사용되는 결정이다. 이 물질은 4각 결정 구조로 인해 광 파장에서 전형적인 굴절 지수 no = 1.522, ne = 1.478로 음의 단색 광학 대칭을 가진다.[7]
전자제품
모노암모늄 인산염 결정체는 압전(piezoelectric)으로, 일부 활성 음파탐지기 변환기(대안은 자기장착을 사용하는 변환기)에 필요한 성질이다. 1950년대에 ADP 결정체는 석영보다 작업하기 쉽고 로셸 소금과는 달리 조미료가 풍부하지 않기 때문에 변환기에서 석영과 로셸 소금 결정을 대체했다.[8]
장난감
비교적 독성이[citation needed] 없는 MAP는 다양한 색상의 염료가 섞인 장난감 키트로 판매되는 등 레크리에이션 크리스탈 재배에도 인기 있는 물질이다.
자연발생
이 화합물은 자연에서 희귀한 광물인 비인산염으로 나타난다. 그것은 구아노 예금에서 형성된다.[13][14] 관련 화합물인, 즉 모노수소 상대 화합물은 더욱 희박한 인산염이다[15][16].
참조
- ^ Lide, David R. (1998). Handbook of Chemistry and Physics (87 ed.). Boca Raton, Florida: CRC Press. pp. 4–40. ISBN 0-8493-0594-2.
- ^ a b c Dejun Xu, Xing Xiong, Lin Yang, Zhiye Zhang, and Xinlong Wang (2016): "Determination of the Solubility of Ammonium Dihydrogen Phosphate in Water-Ethanol System at Different Temperatures from 283.2 to 343.2 K". Journal of Chemincal Engineering Data, volume 61, issue 1, pages 78–82. doi:10.1021/acs.jced.5b00224
- ^ 화학책: "암모늄 이수소 인산염" 2018-08-14일 접속.
- ^ 국가표준국. 선택한 화학적 열역학 특성 값. 기술주 270-3. 1968 [1]
- ^ "Monoammonium Phosphate (MAP)" (PDF). www.mosaicco.com. Retrieved 5 June 2015.
- ^ IPNI. "Monoammonium Phosphate (MAP)" (PDF). www.ipni.net. International Plant Nutrition Institute. Retrieved 21 July 2014.
- ^ a b c Amnon Yariv, Pochi Yeh (1984). Optical Waves in Crystals. Wiley, Inc.
- ^ a b Willem Hackmann (1984). Seek and Strike: Sonar, Anti-Submarine Warfare and the Royal Navy, 1914–1954. Her Majesty's Stationery Office. ISBN 0-11-290423-8.
- ^ G. O. 게런트와 D. E. 브라운(196년) : "인산암모늄에 기초한 고분석 비료의 열분해" 농업 및 식품 화학 저널 13권 6, 493-497페이지. 도이:10.1021/jf60142a002
- ^ John R Van Wazer (1958). Phosphorus And Its Compounds - Volume I: Chemistry. New York: Interscience Publishers, Inc. p. 503.
- ^ 하이파 화학 주식회사: "모노암모늄 인산염 12-61-0" 2018-08-13에 액세스한 제품 현황표.
- ^ 마틴 베크만, 마틴 군나르손, 린네아 콜버그, 마틴 뮐러, 사이먼 탈르보드(2016년) : "2017년 11월 18일 야라 AB에서 모노암모늄 인산염 생산이 웨이백머신에 보관" 룬드 대학의 기술 보고서.
- ^ https://www.mindat.org/min-678.html
- ^ https://www.ima-mineralogy.org/Minlist.htm
- ^ https://www.mindat.org/min-3197.html
- ^ https://www.ima-mineralogy.org/Minlist.htm