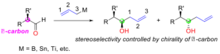비대칭유도
Asymmetric induction
입체화학에서 비대칭 유도(또한 엔티오 유발)는 기질, 시약, 촉매 또는 환경에 존재하는 치랄 특성의 영향으로 인해 다른 에반토머 또는 이산화물 유도머의 화학 반응에서 우선 형성을 설명한다.[1] 비대칭 유도는 비대칭 합성의 핵심 요소다.
비대칭 유도는 헤르만 에밀 피셔가 탄수화물에 대한 연구를 바탕으로 도입했다.[2] 몇 가지 유형의 유도가 존재한다.
내부 비대칭 유도는 공밸런트 결합을 통해 반응 중심과 결합된 치랄 중심을 사용하며 반응하는 동안에도 그렇게 유지된다. 출발 물질은 흔히 치랄 풀 합성으로부터 파생된다. 계전된 비대칭 유도에서 키랄 정보는 별도의 단계로 도입되고 별도의 화학 반응으로 다시 제거된다. 특수 신톤은 치랄 보조기라고 불린다. 외부 비대칭 유도 치랄 정보는 치랄 리간드의 촉매를 통해 전이 상태에서 도입된다. 이 비대칭 합성 방법은 경제적으로 가장 바람직하다.
카보닐 1,2 비대칭 유도
핵소독성 첨가 중 카보닐 탄화수소의 키랄 유도를 설명하기 위해 여러 모델이 존재한다. 이러한 모델은 장점과 전자적 고려사항의 조합에 기초하며 종종 서로 충돌한다. 모델은 크램(1952년), 콘포스(1959년), 펠킨(1969년) 등이 고안했다.
크램의 법칙
1952년[3] 도널드 J. 크램이 개발한 크램의 비대칭 유도 법칙은 특정 악순환 시스템의 입체화학 예측과 관련된 초기 개념이다. 일반적으로 규칙은 다음과 같다.
이염성질체가 우세할 것이라는 특정 비촉매적 반응에서, C-C 결합의 회전 순응이 인접한 비대칭 중심에 부착된 두 개의 가장 부피가 큰 그룹에 의해 이중 결합이 측면으로 배치되는 경우, C-C 결합의 가장 방해받지 않는 쪽에서 진입 집단의 접근에 의해 형성될 수 있다.
이 규칙은 분자 내 비대칭 중심이 존재하면 장력 장애에 근거하여 비대칭 중심이 그 주변에 형성되는 것을 유도한다는 것을 나타낸다.
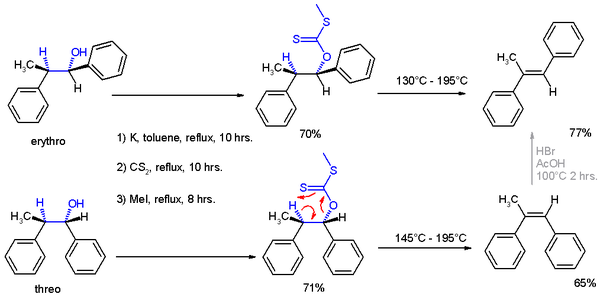
1952년 출간된 Cram은 이 규칙에 근거하여 반응 제품의 적합성을 설명할 수 있는 많은 반응을 문헌에 제시했고, 또한 자신의 주장을 뒷받침하는 정교한 실험(구성표 1)을 기술했다.
그 실험에는 두 가지 반응이 있었다. 실험에서 1개의 2페닐프로피온알데히드(1, 레이스미컬하지만 (R)-엔티오머)를 이물질 제거제의 혼합물로 브로모벤젠의 그리그나드 시약에 반응시켰으며, 주로 threo 이소머를 혼합하였다(Fischer 투영에 대한 설명은 참조).
세레오 이소체의 형성에 대한 선호도는 카보닐이 메틸 그룹과 수소 원자, 즉 두 개의 s인 수소 원자와 엇갈린 형태로 위치할 때, 이 반응의 활성 핵이 가장 방해받지 않는 쪽에서 카보닐 그룹을 공격하도록 함으로써(뉴먼 투영 A 참조) 위에서 설명한 규칙으로 설명할 수 있다.마가스트 대체물은 거슈 방향과 반순응에서 가장 부피가 큰 그룹인 페닐에서 최소의 강직성 장애를 일으킨다.
두 번째 반응은 리튬 알루미늄 하이드라이드를 사용한 1,2-디페닐-1-프로파논 2의 유기적 감소로, 위와 같은 반응 제품이 나오지만 현재는 에리트로 이소머(2a)를 선호한다. 이제 수화 음이온(H−)은 가장 방해를 적게 받는 쪽에서 공격하는 핵소포체다(종이비행기에서 수소가 들어온다고 상상한다).
1952년 초판에서는, 반응 제품의 구조적 배분에 대한 추가 증거를 추가이프 제거에 적용하여 얻었는데, 여기서 threo isomer는 -α-메틸-stilbene의 cis 이소머에 반응하고 erythro isomer는 trans 버전에 반응한다.
펠킨 모델
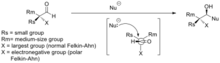
휴 펠킨의 이름을 딴 펠킨 모델(1968)도 카보닐 그룹에 대한 핵포화반응의 입체화학성을 예측한다.[4] 펠킨은 크램 모델이 큰 결점을 겪었다고 주장했다. 즉, 카보닐 대체물과 가장 큰 α-카르보닐 대체물 사이의 전환 상태에서 모호한 순응이 이루어졌다는 것이다. 그는 카보닐 대체제의 견고한 부피를 메틸에서 에틸로 이소프로필로 이소프로필로 이소부틸로 증가시킴으로써 입체감 또한 증가하였음을 증명하였는데, 이는 크램의 규칙으로는 예측되지 않는다.
Felkin 규칙은 다음과 같다.
- 과도기 상태는 반응성 같다.
- 부분 결합(전환 상태에서)을 수반하는 비틀림 변형률(피처 변형률)은 결합 정도가 상당히 낮은 경우에도 완전하게 형성된 결합 사이의 변형률의 상당 부분을 나타낸다. TS의 순응은 시차적이며 TS A에서 가장 작은 두 개의 인접한 그룹에 대해 대체 R 스큐를 포함하지 않는다.
- 주요 강직 상호 작용은 R과 핵소자를 포함하지만 카보닐 산소 원자는 포함하지 않는다.
- 핵소재의 공격은 카보닐에 수직이 아니라 수소를 에클립해 두니츠 각(107도)에 따라 발생한다.
- 극성 효과 또는 전자 효과는 핵분열체와 전자 유출 그룹 사이의 최대 분리로 전환 상태를 안정시킨다. 예를 들어 할로케톤은 크램의 법칙을 따르지 않으며, 위의 예에서 전자 인출 페닐 그룹을 사이클로헥실 그룹에 의해 대체하면 입체감이 상당히 감소한다.
펠킨-안 모델
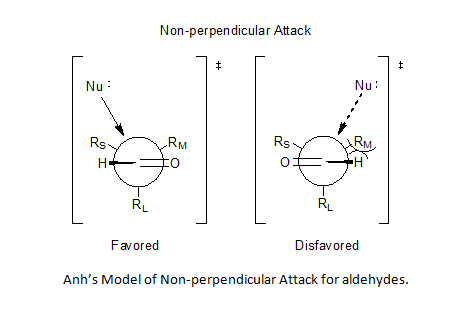
더 펠킨-Anh 모델은[5] Nguyễn Trọng Anh와 Odile Eisenstein이 Felkin 모델의 두 가지 주요 약점을 시정하기 위해 제안한 개선사항을 통합한 Felkin 모델의 확장이다. 첫 번째로 다루어진 약점은 펠킨이 왜 이러한 현상이 관찰되었는지에 대한 정당성을 제시하지 않고 S2N 반응에 의한 입체화학성의 완전한 반전을 초래하는 핵포함 전이상태에서 강한 극적 효과에 대한 진술이었다. Anh의 해결책은 비대칭 유도의 결과로 대체 효과와 궤도 효과에 의해 제어되는 항페리플라나 효과를 제공하는 것이었다.[6][7] 이 효과에서 최고의 핵 수용체 σ* 궤도 모두 카보닐의 π과 π* 궤도 둘 다에 평행하게 정렬되어 들어오는 음이온의 안정화를 제공한다.
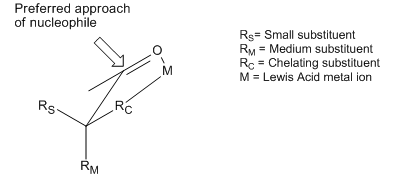
펠킨 모델의 두 번째 약점은 알데히드에는 적용할 수 없는 카보닐 R 주변의 대체적 최소화 가정이었다.
Bürgi-Dunitz angle[8][9] 사상의 통합으로 Anh는 산소-탄소 이중 결합에 비해 95° ~ 105°의 카보닐 중심에서 핵에 의한 비수직 공격을 가정할 수 있게 되었고, 더 작은 대체물에 더 가까이 접근하는 것을 선호하여 알데히드에 대한 예측 가능성 문제를 해결할 수 있었다.[6][10][11]
Anti-Felkin 선택성
크램과 펠킨은anh 모델은 고려된 컨포머와 다른 가정들에서 모두 동일한 기본 현상을 설명하려고 시도한다. 즉, 가장 강직하게 선호하는 카보닐 모이티 표면에 핵성분을 우선하는 것이다. 그러나, 크램과 펠킨-의 기본 교칙에 의해 예측되는 것과 정반대의 입체성을 보이는 반응의 많은 예들이 존재한다.안 모델. 두 모델 모두 이러한 역전을 설명하려는 시도를 포함하고 있지만, 획득한 제품은 여전히 "안티펠킨" 제품으로 언급되고 있다. 비대칭 유도 선택성의 변경의 가장 일반적인 예 중 하나는 루이스 베이스 문자(즉, O, N, S, P 대체물)로 대체된 α 탄소를 필요로 한다. 이런 상황에서 알-iPr이나2 Zn과2+ 같은 루이스산(Lewis acid)이 도입되면 바이덴테이트 첼화 효과를 관찰할 수 있다. 이렇게 하면 카보닐과 루이스 베이스 대체물이 에클립된 순응으로 잠기게 되고, 핵소재는 가장 작은 자유 α-탄소 대체물로 측면에서 공격하게 된다.[12] 킬레이트 R군이 가장 큰 것으로 확인되면 '안티펠킨(anti-Felkin)' 제품이 된다.
이러한 입체적 제어는 크래머 모델을 확립하는 첫 번째 논문에서 인정되고 논의되어 크래머가 자신의 모델이 비수축적 조건을 요구한다고 주장하게 되었다.[13] 반응에 대한 킬레이트 제어의 예를 여기서 볼 수 있는데,[14] 1987년 논문에서 그러한 "크람첼" 중간을 직접 관찰하여 모델을 정당화했다.
여기서 염화 메틸 티타늄은 크램첼을 형성한다. 그 후 메틸 그룹은 티타늄으로부터 분리되어 카보닐을 공격하여 안티펠킨 디쓰레오머로 이어진다.
또한 전자 인출 대체 효과가 없는 경우, Felkin 선택성 방지 효과를 초래할 수 있다. 만약 α 탄소의 대체물이 충분한 전자 인출이라면, 핵소피는 대체물이 α 탄소에 결합된 3개 중 가장 크지 않더라도 전자 인출 그룹에 반비례적인 것을 첨가할 것이다. 각 모델은 이 현상에 대해 약간 다른 설명을 제공한다. 극성 효과는 콘포스 모델과[15] 원래의 펠킨 모델에 의해 가정되었는데,[16] 이 모델은 전환 구조의 쌍극 모멘트를 가장 효과적으로 취소하기 위해 EWG 대체물과 들어오는 핵분열 방지제를 서로 배치했다.
이 뉴먼 투영법은 R과S R에 상대적인 강체L 부피와 관계없이 EWG를 들어오는 핵물질에 반-반-반-반-반-을 배치하는 콘포스와 펠킨 전환 상태를 보여준다.
개선된 펠킨-Anh 모델은 위에서 논의한 바와 같이 선호하는 전환 상태의 안정화에 있어 분자 궤도 상호작용을 고려함으로써 극지 효과에 대한 보다 정교한 평가를 한다. 제안된 전환 구조와 함께 이 효과의 잠재적 안티 펠킨 선택성을 보여주는 대표적인 반응이 아래에 설명되어 있다.
카보닐 1,3 비대칭 유도
의 β-탄소에서의 스테레오전자 환경도 비대칭 유도를 지시할 수 있다는 것이 관찰되었다. 그러한 반응의 입체성을 정의하기 위해 수년에 걸쳐 많은 예측 모델이 진화해 왔다.
킬레이트 모델
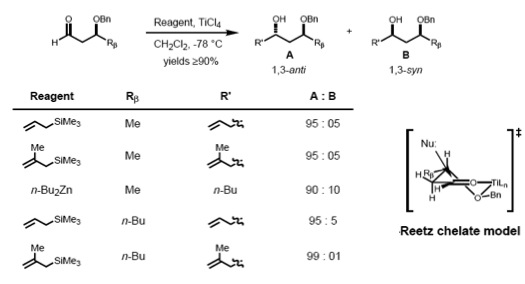
Reetz에 따르면, 1,2 유도용 Cram-chelate 모델을 확장하여 β-알톡시 알데히드와 금속의 킬레이트 콤플렉스를 예측할 수 있다. 핵소체는 강직성이 덜 방해되는 측면과 대체 R에서β 공격해 항응고제를 주요 제품으로 유도하는 것으로 보인다.[17]
그러한 첼레이트들을 만들기 위해서, 금속 센터는 적어도 두 개의 자유 조정 부위가 있어야 하고 보호 리간드는 루이스 산과 함께 바이덴테이트 콤플렉스를 형성해야 한다.
비수송모형
크램-레츠 모델
Cram and Reetz는 1,3-스테레오콘트롤이 반복적인 전환 상태를 통해 반응이 진행된다면 가능하다는 것을 증명했다. β-alkoxy 알데히드와 allimethylsilane의 반응은 크램 폴라 모델이 설명한 안티 1,3-diol의 선택성이 양호했다. 극성 벤질록시 그룹은 쌍극자 상호작용을 최소화하기 위해 카보닐에 대한 안티(anti-to-bulky)를 지향하며, 핵소피는 나머지 두 대체물의 부피(RM)에 대한 안티(anti-to-bulkier)를 공격한다.[18][19]
에반스 모델
보다 최근에 에반스는 비냉동 1,3 유도체에 대해 다른 모델을 제시했다. 제안된 전환 상태에서, β-스테레오컨터는 Felkin–에서 보이는 바와 같이 들어오는 핵물질에 대한 반향성이다.안모형 β-stereocenter의 극 X 그룹은 쌍극자 상호작용을 줄이기 위해 카보닐에 안티-프로젝트를 배치하고, rβ는 알데히드 그룹에 안티-프로젝트를 배치하여 스테레오 방해물을 최소화한다. 따라서 1,3-다이올 방지제가 주요 제품으로 예측될 것이다.[20]
카보닐 1,2,1,3 비대칭 유도
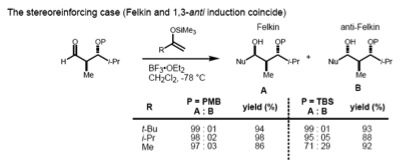
기질에 α-와 β-스테레오케터가 모두 있는 경우, Felkin–Anh 규칙(1,2 유도)과 Evans 모델(1,3 유도)을 동시에 고려해야 한다. 이 두 개의 스테레오센트가 반관계를 가질 경우, 두 모델 모두 동일한 디에스테로이스트레오머(스테레오린강압 케이스)를 예측한다.
그러나, 동침의 경우, 펠킨은-Anh와 Evans 모델은 서로 다른 제품(비스테레오린강압 케이스)을 예측한다. 들어오는 핵분열체의 크기가 입체화학에 작용하는 제어 유형을 결정하는 것으로 밝혀졌다. 큰 핵소립체의 경우, α-stereocenter와 들어오는 핵소립체의 상호작용이 지배적이 되므로, 펠킨 제품은 주요한 것이 된다. 반면에, 작은 핵소체는 비대칭성을 결정하는 1,3의 대조군을 낳는다.[21]
아세클릭 알케네스 비대칭 유도
치랄 아세안은 또한 에폭시디화, 에놀레이트 알킬화 같은 반응에 대해 이질적 퇴행성을 보인다. 알켄 주위의 대체물들은 분자의 한 면이나 다른 면으로부터 전기로의 접근을 선호할 수 있다. 이는 Kendall Houk의 이론적 연구를 바탕으로 한 Houk 모델의 기초로서, 트랜스 더블 본드보다 cis의 선택성이 더 강하다고 예측한다.[22]
표시된 예에서 시스 알켄은 표시된 순응을 가정하여 R과S 메틸 그룹 사이의 강직 충돌을 최소화한다. 전기영역 접근은 주로 보이는 이산화질소를 생산하는 큰 그룹(RL)이 아닌 중간 그룹(RM)의 같은 쪽에서 우선적으로 발생한다. Trans Alkene의 경우 R과S H 그룹 사이의 강직 방해물이 cis 케이스에 비해 크지 않기 때문에 선택성은 훨씬 낮다.
기질제어 : 순환계에서의 분자골격에 의한 비대칭 유도
Acyclic 기질 분자 프레임워크에 의한 비대칭 유도는 분자의 비대칭 강체 및 전자적 특성이 분자에 대한 후속 화학 반응의 치랄성을 결정할 수 있다는 생각이다. 이 주체는 한 개의 스테레오센트가 있고 추가 스테레오센트가 필요한 화학 합성을 설계하는 데 사용된다.
두 가지 기능 그룹이나 종들이 어떻게 반응하는지를 고려할 때, 관련된 화학 물질의 정확한 3D 구성은 그들이 서로 어떻게 접근하는지를 결정할 것이다. 이러한 종들이 서로 어떻게 접근하는지에 관한 어떤 제한사항들은 반응의 생산물의 구성을 결정할 것이다. 비대칭 유도의 경우, 우리는 분자에 대한 비대칭 중심이 분자에 대한 다른 기능 그룹의 반응도에 미치는 영향을 고려하고 있다. 이 두 사이트는 가까이 있을수록 영향력이 클 것으로 예상된다. 그러나 이러한 요인을 평가하기 위한 보다 전체적인 접근방식은 컴퓨터 모델링에 의해 이루어지지만,[23] 일부 합성 단계에서 나타나는 지배적인 경향을 설명하기 위해 단순한 질적 요인을 사용할 수도 있다. 이 정성적 접근법의 용이성과 정확성은 그것이 합성과 기질 설계에 더 일반적으로 적용된다는 것을 의미한다. 적절한 분자 체계의 예로는 알파 치랄 알데히드(chiral aldehydes)와 치랄 보조제의 사용이 있다.
알파-치랄 알데히드에서의 비대칭 유도
알데히드에서의 가능한 반응성에는 핵소독성 공격과 동맹성 추가가 포함된다. 알파-치랄 알데히드에서의 핵포함 공격의 입체성은 펠킨-에 의해 설명될 수 있다.Cram의 규칙으로 Anh 또는 Polar Felkin Anh 모델과 아치랄 동맹군의 추가가 설명될 수 있다.
펠킨-앤-폴라 펠킨-안모형
치랄 알데히드에 대한 핵포함 첨가에서의 선택성은 종종 펠킨-에 의해 설명된다.Ah 모델[24](그림 참조) 핵소체는 버기두니츠 각도로 카보닐 그룹의 탄소에 접근한다.[25] 이 궤적에서, 인접한 큰 기능 그룹의 견고한 부피 때문에 아래 얼굴로부터의 공격이 바람직하지 않다.
극지 펠킨-Anh 모델은 X가 전기 그룹인 시나리오에 적용된다. 극지 펠킨-anh 모델은 관측된 입체화학이 C-X 항균성 ** 궤도 및 성형 결합 사이의 항연계 상호작용에서 발생하는 초주형 안정화로 인해 발생한다고 가정한다.
펠킨 개선알데하이드에 유기물을 첨가하기 위한 anh 선택성은 해당 Grignard 또는 Organolisium nucleophylophiles 대신 organo-alum nucleophiles를 사용하여 얻을 수 있다. Claude Spino와 동료들은[26] 많은 치랄 알데히드가 있는 비닐그라드에서 비닐라인 시약으로 전환할 때 상당한 입체감을 보였다.
크램의 법칙
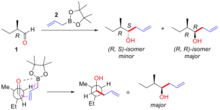
알데히드에 아질산 아릴메탈을 첨가하면 치랄 알코올이 형성되며, 이 반응의 입체화학적 결과는 알데히드 기질에 대한 α-탄소의 치랄성에 의해 결정된다(그림 "하부 제어: 아질산 아릴메탈을 α-치랄 알데히드에 추가"). 사용되는 아군용 시약에는 붕소, 주석, 티타늄이 포함된다.
Cram의 규칙은 그림 3에 묘사된 전환 상태를 고려함으로써 입체감을 설명한다. 전환 상태에서 산소 단독 쌍은 붕소 중심과 상호작용할 수 있고 앨리글 그룹은 카보닐 그룹의 탄소 끝에 추가할 수 있다. 이 전환 상태의 견고한 수요는 혼잡한 카보닐 그룹과 α-탄소 중심에서 가장 작은 그룹을 지나 접근하는 아군 그룹으로부터 가장 큰 그룹을 (전송) 멀리 유지하는 α-탄소 구성에 의해 최소화된다. 아래 예(그림 "α-치랄 알데히드에 대한 기질 제어 아릴-보론의 첨가 예)", (R)-2-메틸부타날(1)은 (R, R)-이소머가 주요 제품인 2개의 가능한 이소성분해제를 가지고 아릴보론 시약 (2)와 반응한다. 이 반응의 Cram 모델은 에틸 그룹(대그룹)에 트랜스를 배치한 카보닐 그룹과 아릴 보론이 수소 그룹(소그룹)을 지나 접근하는 것으로 나타난다. 구조물은 뉴먼 투영에 나타나 있다. 이 경우 수소(소그룹)가 있는 얼굴에서 핵포화반응이 일어나 (R, R)등분체를 주요 생산물로 생산한다.
치랄 보조기
비대칭 스테레오 유도는 키랄 보조장치를 사용하여 달성할 수 있다. 치랄 보조기는 기질에 역방향으로 부착하여 갈라지기 전에 이질회수반응을 유도하여 전체적으로 항저항 과정을 발생시킬 수 있다. 키랄 보조제의 예로는 에반스의 키랄 옥사졸리디논 보조기( 비대칭 알돌 반응용)[27] 사이언페드린 아미드 및 테르트-부타네술핀아미드이미드가 있다.
기질제어 : 순환계에서의 분자골격에 의한 비대칭 유도
순환 분자는 종종 선형 분자보다 훨씬 더 단단한 순응으로 존재한다. 에리트로마이신 같은 아주 큰 매크로 사이클도 많은 자유도를 가지고 있음에도 불구하고 정의된 기하학적 구조로 존재한다. 이러한 특성 때문에 선형 기판보다는 매크로순환 기판으로 비대칭 유도를 달성하는 것이 더 쉬운 경우가 많다. W. Clark Still과[28] 동료들이 수행한 초기 실험에서는 중-대-링 유기 분자가 운동성 에놀레이트 알킬화, 디메틸쿠프레이트 첨가, 촉매 수소화와 같은 반응에서 기판으로서 스테레오 유도의 현저한 수준을 제공할 수 있다는 것을 보여주었다. 단 하나의 메틸 그룹이라도 반응의 이질성 결과를 편향시키기에 충분한 경우가 많다. 이러한 연구들은, 무엇보다도, 큰 고리는 어떤 종류의 입체 화학적 제어도 제공하기에는 너무 유동적이라는 널리 알려진 과학적인 믿음에 도전하는 데 도움이 되었다.
다수의 토탈 합성이 원하는 반응 제품을 얻기 위해 매크로클릭 스테레오콘트롤을 사용하였다. (-----cladiella-6,11-dien-3-ol)의 합성에서는 변형된 삼분해 올레핀을 N-메틸모르폴린 N-산화물(NMO) 및 오스뮴 테트로크시드(tetroxide)와 함께 변형된 올레핀을 디히드록시드화 디아산화 디아산화 디아세테오셀렉트로셀렉티브로 처리했다.[29] (±-periplanone B)로 이동하는 동안 화학자들은 두 개의 다른 알켄이 있는 상태에서 테르트-부틸 수산화물을 사용하여 에논 중간에서 안면 선택적 에폭시드를 달성했다.[30] 가장 낮은 에너지 매크로사이클 순응을 고려한 분자 모델링 계산에 의해 예측된 대로 세스퀴터펜 유카나비놀라이드로[31] 가는 중간 10밀리미터 링의 보로무화 나트륨 감소가 수행되었다. 기질 제어 합성 계획에는 선택적 변환을 달성하기 위해 복잡한 비대칭 시약을 사용할 필요가 없기 때문에 많은 장점이 있다.
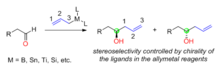
시약 조절: 아치랄 알데히드에 치랄 아일메탈 추가
유기합성에서 시약제어는 많은 것 중에서 하나의 입체체를 선택적으로 형성하는 접근법으로, 입체성은 사용된 시약의 구조와 치례성에 의해 결정된다. 키랄 아일메탈이 아킬라 알데히드에 대한 핵포함 반응에 사용될 때, 새로 생성된 알코올 탄소의 치랄성은 아일메탈 시약의 치랄성에 의해 결정된다(그림 1). 우방형의 치랄성은 보통 사용되는 비대칭 리간드에서 발생한다. 동맹금속 시약에는 붕소, 주석, 티타늄, 실리콘 등이 포함된다.
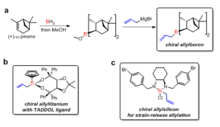
알데히드와의 반응에 대비하기 위해 다양한 치랄 리간드가 개발되었다. H. C. Brown은 알데히드와의 비대칭 동맹 반응에 대해 치랄 아일보론 시약을 가장 먼저 보고하였다.[32] 키랄 아일보론 시약은 천연물(++-a-pinene)에서 두 단계로 합성되었다. 디터 시바흐가 개발한 TADDOL 리간드는 알데하이드와의 비대칭 아라이제이션용 치랄 아일티타늄 화합물을 준비하는데 사용되어 왔다.[33] 짐 레이튼은 치알리실리콘 화합물을 개발했는데, 치알리실리콘은 링 스트레인의 방출로 입체적 아군화 반응이 촉진되었고, 아치랄 알데히드의 범위에 대해 95%에서 98%의 항정신성 과잉이 달성될 수 있었다.[34]
참고 항목
참조
- ^ IUPAC 골드 북 정의 링크
- ^ 천연물의 비대칭 합성, 아리 코스키넨 ISBN0-471-93848-3
- ^ 스테레오화학에 관한 연구. X. 도날드 J. 크램, Fathy Ahmed Abd Elhafez J. Am. Acylic Systems Synthes의 "Sterically Control of Nymmetric Inducation"의 법칙. 화학. Soc.; 1952; 74(23); 5828–5835. 추상적
- ^ 부분 결합과 관련된 비틀림 변형률. 일부 단순한 오픈체인 케톤 마크 체레스트, 휴 펠킨 및 니콜 프루덴트 테트라헤드론 레터즈 9권, 1968년호, 2199-2204 doi:10.1016/S0040-4039(00)89719-1의 리튬 알루미늄 하이드라이드 감소의 입체화학
- ^ 베트남어에서는 성이 먼저 주어지기 때문에 이것을 펠킨-응구옌 모델이라고 부르는 것이 더 낫다고 언급하고 있다.
- ^ a b 안, N. T.; 아이젠슈타인, O. 누브. J. Chim 1977, 1, 61.
- ^ 안, N. T.; 에이젠슈타인, O.; 르포, J-M.; 다우, M-E. J. Am. 화학. 1973년, 95년, 6146년
- ^ B. B. B. B. B. D. D. B. B. B. D. Shefter, E. J. Am. 화학. 1973년, 95년, 5065년
- ^ B. B.; B. B. B.; D. D. Len, J. M.; Wipff, G. Tetrahedron 1974, 30, 1563.
- ^ 안, N. T. 아이젠슈타인, O. 테트라헤드론 1976년 155년
- ^ 안, N. T. 탑. 1980년 화학 88년 146년
- ^ Mengel A, Reiser O.Chem. Rev. 1999, 99(5), 1191–1224.
- ^ Cram DJ, Elhafez FA. J. Am. Chem. Soc.; 1952; 74(23); 5828–5835.
- ^ Reetz MT, Hullmann M, Seitz T. 안젤라, 화학. 에드 장로 1987년 11월 26일, 477–480.
- ^ 콘포스 JW, 콘포스 MRH, 매튜 KK. J. 켐.Soc. 1959, 112–127.
- ^ 체레스트 M, 펠킨 H, 프루덴트 N. 테트라헤드론 레트, 1968, 18, 2199–2204.
- ^ Reetz, M.T.; Jung, A. J. Am. 화학, 1983년, 105년, 4833년
- ^ 레이트레그, TJ, Cram, D.J.J. Am. 1968년, 90년, 4011년.
- ^ Reetz. M.T.; Keseler, K.; Jung, A. 4면체 1984년, 25년, 729년
- ^ 에반스, DA.; 더피, J.L.; 다트, M.J. 테트라헤드론 레트. 1994, 35, 8537.
- ^ 에반스, DA.; 다트, M.J.; 더피, J.L.; 양, M.G.J.A. 화학. Soc. 1996, 118, 4322.
- ^ Clayden; Greeves; Warren; Wothers (2001). Organic Chemistry. Oxford University Press. p. 895. ISBN 978-0-19-850346-0.
- ^ 후크, K. N. 외, 과학, 1986, 231, 1108-1117.
- ^ a) Anh, N. T. T. T. Top. Curr. Chem. 1980, 88, 145–162; (b) Anh, N. T.; 에이젠슈타인, O. Nov. J. Chim. 1977, 1, 61–70; (c) Anh, N. T.; 에이젠슈타인, O. 테트라헤드론 1976, 26, 155–158
- ^ 버기, H. B.; 뒤니츠, J. D.; 렌, J. M.; 위프, G. 테트라헤드론. 1974. 12, 1563–1572.
- ^ 스피노, C; 그레인저, M. C.; 보이즈버트, L.; 베어리외, C. 4면체 레트, 2002, 43, 4183–4185.
- ^ 에반스, D. A.; 바트롤리, J.; 시, T. L., Am. Chem. Soc, 1981, 103, 2127-2129.
- ^ 그래도 W. C.; 갈린커. 4면체 1981, 37, 3981-3996.
- ^ Kim, Hyoungsu; Lee, Hyunjoo; Kim, Jayoung; Kim, Sanghee; Kim, Deukjoon (2006-12-01). "A General Strategy for Synthesis of Both (6Z)- and (6E)-Cladiellin Diterpenes: Total Syntheses of (−)-Cladiella-6,11-dien-3-ol, (+)-Polyanthellin A, (−)-Cladiell-11-ene-3,6,7-triol, and (−)-Deacetoxyalcyonin Acetate". Journal of the American Chemical Society. 128 (49): 15851–15855. doi:10.1021/ja065782w. ISSN 0002-7863. PMID 17147397.
- ^ Still, W. Clark (1979-04-01). "(.+-.)-Periplanone-B. Total synthesis and structure of the sex excitant pheromone of the American cockroach". Journal of the American Chemical Society. 101 (9): 2493–2495. doi:10.1021/ja00503a048. ISSN 0002-7863.
- ^ Still, W. Clark; Murata, Shizuaki; Revial, Gilbert; Yoshihara, Kazuo (1983-02-01). "Synthesis of the cytotoxic germacranolide eucannabinolide". Journal of the American Chemical Society. 105 (3): 625–627. doi:10.1021/ja00341a055. ISSN 0002-7863.
- ^ 브라운, H. C.; 자드하브, P. K. J. Am. 화학. 1983년, 105년, 2092년
- ^ Duthaler, R. O.; Hafner, A. 1992, 92, 807년 개정판
- ^ 킨네어드, J. W. A.; 응, P. Y.; 쿠보타, K.; 왕, X.; 레이튼, J. L. J. Am. 화학. 2002년 124년 7920년