알파할로케톤
Alpha-Haloketone유기화학에서 α-할로케톤은 케톤기 또는 보다 일반적으로 α-할로겐 치환기를 가진 카르보닐기로 이루어진 관능기이다.α-할로케톤은 알킬화제이다.두드러진 α-할로케톤에는 페나실 브롬화물 및 클로로아세톤이 [1]포함된다.
구조.
일반적인 구조는 RRcC(X)C(=O)R이며, 여기서 R은 알킬 또는 아릴잔기이고 X는 할로겐 중 하나이다.할로케톤의 바람직한 배치는 할로겐이 있는 시소이드이며, 카르보닐기는 일반적으로 카르보닐기와의 입체 장애물이 더 크다.[2]
할로케톤 합성
할로케톤 및 할로 카르보닐 화합물은 일반적으로 할로겐을 사용하여 제공되는 X([1]X = 할로겐) 공급원과+ 카르보닐 화합물을 반응시켜 합성됩니다.
- RC(O3)CH + X2 → RC(O)CHX2 + HX
친전자 할로겐화제의 특화된 공급원은 N-브로모스크신이미드 및 1,3-디브로모-5,5-디메틸히단토인(DBMH)을 포함한다.니에렌슈타인 반응에서 염화아실은 디아조메탄과 반응한다.
비대칭 합성
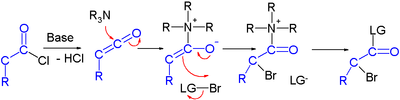
유기 촉매 분석을 통한 할로카르보닐의 비대칭 합성에 대한 노력이 보고되었다.한 연구에서 산 염화물은 강한 염기(수소화 나트륨), 브롬 공여체 및 프롤린과 [3]키닌을 기반으로 하는 유기 촉매로 α-할로 에스테르로 변환된다.
제안된 반응 메커니즘에서 염기가 먼저 염산을 케텐으로 변환한 후 유기 촉매는 키라리티를 퀴노이드 3차 아민을 통해 도입하여 케텐 부가물을 형성한다.
반응
할로케톤은 두 개의 친전자성 부위(알파 탄소와 카르보닐 탄소)와 함께 여러 가지 반응 유형에 관여합니다.이 이중성의 한 가지 징후는 헤테로사이클의 전구체이다.아미노티아졸은 클로로케톤과 티오요소 및 [4][5]티오아미드와의 반응에 의해 생성된다.할로케톤과 디카르보닐 및 암모니아를 반응시켜 피롤을 합성한다.
알킬화 활성의 예로는 아세톤 중 요오드화칼륨과의 반응이며 클로로아세톤은 1-클로로프로판보다 36,000배 빠르게 반응한다.할로케톤은 페르코우 반응에서 인산염과 반응한다.
두 개의 전자 인출 그룹(카르보닐 및 할로겐화물)이 존재하기 때문에알파-C-H 중심은 산성이다.이 성질은 염기가 먼저 산성 알파-프로톤을 추상화한 후 생성된 카르바니온이 할로겐을 치환하는 Favoreskii 재배열에서 이용된다.
할로케톤과 알데하이드 간의 교차 알돌 반응에서 초기 반응 생성물은 할로히드린이며, 할로히드린은 염기의 존재 하에서 옥시란을 형성할 수 있다.
할로겐 그룹은 할로케톤의 환원 탈할로겐화에서 제거될 수 있다.α-할로케톤은 히드라진에 의해 알케인으로 전환될 수도 있다.
케톤으로서 α-할로케톤은 아민과 반응하여 α-할로이민을 형성할 수 있으며, α-할로이민은 가수분해에 의해 친할로케톤으로 환원될 수 있으므로 할로케톤 마스크 버전으로 사용할 수 있다.이를 통해 모 할로케톤에서는 [6]직접 불가능한 일부 화학적 변환을 달성할 수 있다.
레퍼런스
- ^ a b Verhé, Roland; De Kimpe, Norbert (1983). "Synthesis and Reactivity of α-Halogenated Ketones". In Saul Patai, Zvi Rappoport (ed.). Halides, Pseudo-Halides and Azides: Vol. 1. PATAI'S Chemistry of Functional Groups. pp. 813–931. doi:10.1002/9780470771716.ch19.
- ^ Erian, Ayman W.; Sherif, Sherif M.; Gaber, Hatem M. (2003). "The Chemistry of α-Haloketones and Their Utility in Heterocyclic Synthesis" (PDF). Molecules. 8 (11): 793–865. doi:10.3390/81100793. S2CID 53951565.
- ^ Dogo-Isonagie, Cajetan; Bekele, Tefsit; France, Stefan; Wolfer, Jamison; Weatherwax, Anthony; Taggi, Andrew E.; Lectka, Thomas (2006). "Scalable Methodology for the Catalytic, Asymmetric α-Bromination of Acid Chlorides". Journal of Organic Chemistry. 71 (23): 8946–8949. doi:10.1021/jo061522l. PMID 17081026.
- ^ J. R. Byers; J. B. Dickey (1939). "2-Amino-4-methylthiazole". Organic Syntheses. 19: 10. doi:10.15227/orgsyn.019.0010.
- ^ George Schwarz (1945). "2,4-Dimethylthiazole". Organic Syntheses. 25: 35. doi:10.15227/orgsyn.025.0035.
- ^ Verhé, Roland; De Kimpe, Norbert (1983). "α-Halogenated Imines". In Saul Patai, Zvi Rappoport (ed.). Halides, Pseudo-Halides and Azides: Vol. 1. PATAI'S Chemistry of Functional Groups. pp. 813–931. doi:10.1002/9780470771716.ch13.