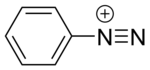
디아조늄 화합물
Diazonium compound디아조늄 화합물 또는 디아조늄염은 R이 알킬이나 아릴과 같은 어떤 유기 그룹이 될 수 있는 공통 기능 그룹 R-NX를+
2−
공유하는 유기 화합물의 그룹이며, X는 할로겐과 같은 무기물 또는 유기 음이온이다.
일반 특성 및 반응도
표로 작성된 선형 자유 에너지 관계 상수(예: Hammett σm 및 σp)에 따르면, 디아조늄군(N2+)은 가장 강한 전자-퇴출 대체 물질에 속한다. 따라서 디아조니오 대체 페놀과 벤조아산에 대한 알카니디아조늄종과 산성 양자의 α 위치는 미신성 양자에 비해 pKa 값을 크게 줄였다. 예를 들어 메탄디아조늄의 수용 pK는a <10>으로 추정되며,[1] 4-히드록시벤젠디아조늄의 페놀 양성자는 3.4로 측정되었다.[2]
반응성 측면에서 디아조늄염의 화학성분은 열역학적으로(내분학적으로, 엔트로피적으로) 이디트로겐 가스의 우호적인 배출을 통해 디디아조티즈를 하는 성향이 지배적이다. 반응(MeN2+→ Me+ + N2)은 엔탈피크 변화가 43kcal/mol이고, (EtN2+→ Et+ + N2)은 엔탈피크 변화가 11kcal/mol이다.[3] 2차종과 3차종 알카니디아조늄종의 경우, 엔탈피질 변화는 질소 배출에 대한 활성화 장벽이 최소인 0이나 음에 가까운 것으로 계산된다. 따라서 2차종과 (특히) 3차종 알카니디아조늄 종은 결합되지 않고 존재하지 않는 종이거나 기껏해야 극히 덧없는 중간자종이다.
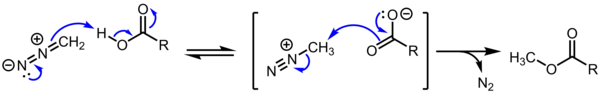
메틸디아조늄 카르복실산염은 디아조메탄에 의한 카르복실산 메틸화의 덧없는 중간으로 여겨지며, 아민의 디아조티화를 통해 생성된 알카니아디아조늄 종은 물리 유기화학 연구에서 연구되어 왔다.[4][5] 단, 알카니디아조늄염은 극단적이고 제어되지 않는 S2N/S1N/E1 반응성으로 인해 그 외에는 전체적으로 중요하지 않다.
비록 여전히 위험하게 특정한 조건에 따라 폭발적인 반면에 SN1보다 훨씬 더 어려움 alkanediazonium 종들이 높은 에너지 아릴 양이온을 형성하는 것이 까다롭고에 비해 더 강하C(sp2)–N 채권 때문에 비해 발생하면 SN2기하학적으로, 발생하지 않으면 불가능하다 대조적으로, arenediazonium 소금 더, 안정적이다. 그 알카니디아조늄 화합물에서 C(sp3)-N 결합. 염화소금은 고전적으로 아닐린과 NaNO2/aq에서 5 °C로 제조된다. HCl과 ArNCl2+– 염은 높은 온도에서 분해되는 경향이 있다(때로는 폭발적으로). 그러나 redox 비활성 및 부피가 큰 HSO4–, BF4– 또는 TsO를– 대항제로 사용함으로써 아레네디아조늄염은 0°C에서 무기한 보관하고 최대 50°C의 온도에서 단기간 안전하게 취급할 수 있게 되었다. 그들의 반응의 절대 다수의 초기 전자 이동이 이루어진 SRN1(아르곤)(해리성 급진적인 친핵성 방향족 치환 반응)에 의해,aryl 근본적인 형성에 대한 허용보다는 ca. 일어나Arenediazonium 소금 때문이라고 몇몇의 경우에는 SN1(아르곤)(해리 일분자 친핵성 방향족 치환 반응)을 받다t이온의
아레네디아조늄염은 화학 합성을 위한 예외적으로 다용도 시약이다. 아릴산염과 양이온들은 전기생성성이 높고 거의 모든 핵물질 시약과 반응하기 때문에 아레네디아조늄염은 거의 모든 다른 방향족 유도체가 준비될 수 있는 아레네 화학에 대한 "트랜싯 허브"를 형성한다. 더욱이 이 효용은 그 즉시 이용가능성에 의해 강조된다: 아레네디아조늄염은 아리아민(아일린과 헤테로아릴아민)의 디아조트화로부터 쉽게 접근할 수 있다. 아레네디아조늄염은 다시 아레네에서 전기 질화, 금속 매개 또는 -염화 감소에 의해 모체 아레네에서 파생된다.[6] 전기영양 방향족 치환 후 방향족 화합물을 준비하기 위해 가장 많이 적용되는 전략은 디아조늄 화학이다.
산업적으로 아네디아조늄염은 아조 염료의 유기적 합성에 중요한 매개물이다.[7] 상대적으로 안정된 디아조늄 염을 위한 효율적인 방법이 개발되었고, 그들의 토실레이트 대항제에 의해 안정화되었다. 화합물을 분리하여 선택한 아조 염료 합성에 사용하였다.[8]
준비
디아조늄 화합물을 형성하는 과정을 "다이아조화", "다이아조화" 또는 "다이아조화"라고 부른다. 이 반응은 1858년 피터 그리스에 의해 처음 보고되었고, 그는 이후 이 새로운 종류의 화합물에 대한 몇 가지 반응을 발견했다. 가장 일반적으로 디아조늄염은 아질산 및 추가산을 함유한 방향족 처리로 제조된다. 보통 질산은 아질산나트륨과 초과 미네랄산(보통 수용성 HCl, HSO24, p-HCHSOH3643 또는 HBF4)으로부터 (같은 플라스크에서) 현장에서 생성된다.
전통적으로 아닐린, 아질산나트륨, 염산염으로부터 제조된 디아조늄 염화염의 수용액은 상온에서 불안정하며 0~5°C에서 고전적으로 제조된다. 다만 실온에서 안정 고형분인 [9]디아조늄 화합물을 테트라플루오보화 또는 토실레이트 염으로 분리할 수 있다. 종종 디아조늄 소금이 용액에 남아 있는 것이 선호되지만, 그것들은 과포화되는 경향이 있다. 운영자들은 예상치 못한 소금의 결정화에 따른 폭발로 부상을 입거나 심지어 목숨을 잃었다.[10]
이러한 위험 때문에 디아조늄 화합물은 보통 격리되지 않는다. 대신에 그것들은 현장에서 사용된다. 이러한 접근방식은 아레네설포닐 화합물의 준비에서 설명된다.[11]
디아조 커플링 반응
디아조늄염의 가장 널리 행해지는 반응은 아조 커플링이다. 이 과정에서 디아조늄 화합물은 전자가 풍부한 기질에 의해 공격받는다. 결합 파트너가 아닐린 및 페놀과 같은 영역인 경우 이 프로세스는 전기영양 방향족 치환 예시로서 다음과 같다.
상업적으로 중요한 또 다른 연결 파트너 등급은 아세트아미노산 아미드인데, 이는 다이어리라이드 색소인 피그먼트 옐로우 12의 준비에서 알 수 있다.[12]
그 결과로 생기는 아조 화합물은 종종 유용한 염료로서 사실 아조 염료라고 불린다.[13] 염료의 깊은 색은 그들의 확대된 결합을 반영한다. 예를 들어 아닐린 옐로라고 불리는 염료는 아닐린과 디아조늄 소금의 차가운 용액을 섞은 다음 힘차게 흔들어 만들어진다. 아닐린 황색은 황색 고체로 얻는다.[14] 마찬가지로 나프탈렌-2-올(베타납톨)의 차가운 기본 용액은 강렬한 오렌지빛 붉은 침전물을 준다.[14] 메틸 오렌지(Methyl orange)는 실험실에서 pH 표시기로 사용하는 아조 염료의 예다.
N군2 변위
아레네디아조늄 양이온은 N군이2 다른 집단이나 이온으로 대체되는 여러 반응을 겪는다. 주요 내용 중 일부는 다음과 같다.[15][16]
바이알 커플링
한 쌍의 디아조늄 양이온을 결합하여 바이알을 제공할 수 있다. 이 변환은 안트라닐산에서 추출한 디아조늄 소금이 디페닉산(CHCOH642)을 투여하기 위한 결합에 의해 설명된다.2[17] 이와 관련된 반응에서, 같은 디아조늄 소금은 벤지네를 주기 위해 N과2 CO의2 손실을 겪는다.[18]
Halides에 의한 교체
샌드마이어 반응
각각 HCl 또는 HBr에 용해된 큐알 염화물 또는 큐알 브롬화물로 가열된 벤젠디아조늄은 각각 클로로벤젠 또는 브로모벤젠을 산출한다.
개터만 반응
가터만 반응에서는 구리 가루로 벤젠디아조늄 염화물을 데우고 HCl 또는 HBr로 데워 클로로벤젠과 브로모벤젠을 각각 생산한다. 독일의 화학자 루드비히 개터만의 이름을 따서 지은 것이다.[19]
요오드화물에 의한 대체
아레네디아조늄 양이온이 요오드화칼륨과 반응하여 아릴 요오드화물을 만든다.[20]
플루오르화물에 의한 교체
플루오벤젠은 벤젠디아조늄 플루오보화물의 열분해로 생성된다. 그 전환은 발츠-시만 반응이라고 불린다.[21]
전통적인 발즈-시만 반응은 많은 동기의 대상이 되어왔다. 예를 들어, 헥사플루오로인산염(PF)6−과 헥사플루오로안티모네이트(SBF6−)를 테트라플루오로보르산염 대신 사용하는 것이다. diazotization은 [NO]SbF와6 같은 니트로소늄 염으로 효과를 얻을 수 있다.[22]
기타 교체
수소에 의한 대체
저인산,[23] 에탄올 또는 나트륨 스탠나이트에 의해 감소된 아레네디아조늄 양이 벤젠을 제공한다.
히드록실 그룹에 의한 교체
페놀은 아레네디아조늄염의 수용액을 가열하여 생성된다.[24][25][26][27]
이러한 반응은 독일 이름인 페놀베르코충("페놀을 생산하기 위해 조리")에 의해 나타난다. 형성된 페놀은 디아조늄 소금과 반응할 수 있으며 따라서 그 반응은 산과 함께 운반되어 이 추가 반응을 억제한다.[28] 물속 CuO와2 Cu를2+ 이용하여 샌드마이어형 히드록실화도 가능하다.
니트로 그룹에 의한 교체
니트로벤젠은 벤젠디아조늄 플루오보화물을 구리가 있는 곳에서 아질산나트륨과 함께 처리하면 얻을 수 있다. 또는 아닐린의 디아조트화(diazotization)는 다음과 같은 상황에서 아질산컵을 생성하는 아산화질소가 있는 곳에서 수행할 수 있다.
cyano 그룹에 의한 교체
시아노 그룹은 보통 할로아레네를 핵으로 대체하여 도입할 수 없지만, 디아조늄 염으로부터 그러한 화합물을 쉽게 준비할 수 있다. 예시는 시약 큐폴로 시안을 사용한 벤조니트릴의 준비물이다.
이 반응은 샌드마이어 반응의 특별한 유형이다.
트리플루오로메틸 그룹에 의한 교체
두 연구 그룹은 2013년에 디아조늄 염의 트리플루오메틸화를 보고하였다. 구센은 CuSCN, TMSCF3, CsCO23 등으로부터 CuCF단지3 조성을 보고했다. 이에 비해 푸는 우메모토의 시약(S-트리플루오메틸디벤조티오페늄 테트라플루오르오베늄)과 Cu 파우더(게터만 타입의 조건)를 이용해 트리플루오메틸화를 보고하였다. 이 값은 다음과 같은 방정식으로 설명할 수식:
브래킷은 구리의 다른 리간드가 존재할 가능성이 있지만 생략되었음을 나타낸다.
티올 그룹에 의한 교체
디아조늄염은 2단계 시술로 티올로 변환할 수 있다. 에틸산탄산트 칼륨으로 염화 벤젠디아조늄을 처리한 후 중간 크산트 에스테르를 가수분해하면 티오페놀:
아릴 그룹에 의한 교체
아릴 그룹은 아레네디아조늄 소금을 사용하여 다른 그룹과 결합될 수 있다. 예를 들어, 수산화나트륨이 존재하는 곳에서 벤젠(향기 화합물)으로 염화 벤젠디아조늄을 처리하면 디페닐이 발생한다.
이 반응은 곰버그-바흐만 반응으로 알려져 있다. 비슷한 변환은 에탄올과 구리 가루로 염화 벤젠디아조늄을 처리함으로써 이루어진다.
붕소산염 에스테르 그룹에 의한 교체
스즈키-미야우라 교차 커플링 반응에 사용되는 Bpin(피나콜라토보론) 그룹은 과산화 벤조일(2 mol)이 있는 상태에서 bis(피나콜라토) 디보론과 디아조늄 소금의 반응으로 설치할 수 있다.[29] 그 대신에 디망간 데카르보닐을 포함한 전이 금속 카보닐 복합체를 사용하여 유사한 보릴화를 달성할 수 있다.[30]
- CHNX652+– + 핀B–Bpin → CHBpin65 + X2–Bpin + N
포밀 그룹별 교체
아릴 디아조늄 소금은 아릴 디아조늄소금을 포름독심(HC2=NOh)으로 처리한 후 아릴알데히드를 주기 위해 아릴알독심을 가수분해하는 방식으로 도입할 수 있다.[31] 이 반응은 벡 반응이라고 알려져 있다.[32]
미어웨인 반응
염화 벤젠디아조늄은 활성 이중 결합을 포함한 화합물과 반응하여 페닐화 제품을 생산한다. 이 반응은 미어웨인 아릴레이션이라고 불린다.
금속복합체
금속 복합체와의 반응에서 디아조늄 양이온은 NO와+ 유사하게 작용한다. 예를 들어, 낮은 가치의 금속 복합체는 디아조늄 염을 첨가한다. 예시 단지는 [Fe(CO)(2PPH3)(2NPh2)]+와 치랄-at-metal 복합체 Fe(CO)(NO)(PPH3)(NPh2)이다.[33]
다른 dediazotization 방법
- 전극에서의 유기적 감소에 의해.
- 아스코르브산(비타민 C)[34]과 같은 순한 환원제에 의해
- 물에서 생성된 용해 전자로부터 감마선에 의해
- 광 유도 전자전달
- 금속 양이온에 의한 감소, 가장 일반적으로는 큐빅 소금.
- 음이온 유도 디디아존화: 요오드와 같은 반작용은 아릴 라디칼과 요오드 라디칼을 형성하는 디아조늄 양이온에 전자전자를 전달한다.
- 전자 기증자 역할을 하는 용매를 이용한 용매 유도 디디아존화
접목반응
나노기술의 잠재적인 응용에서 디아조늄염 4-클로로벤젠디아조늄 테트라플루오르보전은 단일벽 나노튜브를 매우 효율적으로 기능한다.[35] 나노튜브의 각질을 제거하기 위해 박격포와 페스틀에 이온성 액체와 섞는다. 디아조늄 소금은 탄산칼륨과 함께 첨가되며, 실온에서 혼합물을 분쇄한 후 나노튜브의 표면은 44개의 탄소 원자 중 1개의 효율을 가진 클로로페닐 그룹으로 덮여 있다. 이렇게 첨가된 자급제는 나노튜브 기술의 반복적인 문제인 이들 사이에 응집력이 크기 때문에 튜브들이 친밀한 다발을 형성하는 것을 막는다.
아릴 모놀레이어를 형성하는 디아조늄 염으로 실리콘 웨이퍼를 기능화하는 것도 가능하다. 한 연구에서는 실리콘 표면을 불화수소 암모늄으로 세척하여 실리콘-수소 결합(수소수 통과)으로 덮는다.[36] 어둠 속에서 2시간 동안 아세토나이트릴에 있는 디아조늄 소금의 용액으로 표면의 반응은 자유 급진적 메커니즘을 통한 자발적 과정이다.[37]
지금까지 금속의 디아조늄 염을 철, 코발트, 니켈, 백금, 팔라듐, 아연, 구리, 금 표면에 접목하는 작업이 이루어졌다.[38] 다이아몬드 표면으로의 접목도 보고되었다.[39] 한 가지 흥미로운 질문이 제기되는 것은 표면에 있는 아릴 그룹의 실제 위치 설정이다. 실리코 내 연구는 티타늄에서 구리까지의 4주기 원소가 d전자의 수가 증가하기 때문에 결합 에너지가 왼쪽에서 오른쪽으로 감소한다는 것을 보여준다. 철의 왼쪽에 있는 금속은 탄소 파이 결합 형성에 유리하도록 표면에 기울어지거나 평평하게 배치되고 철의 오른쪽에 있는 금속은 직립 위치에 배치되어 금속과 탄소 시그마 결합 형성에 유리하게 배치된다. 이것은 또한 왜 지금까지 디아조늄 소금이 주기율표에서 철의 오른쪽에 있는 금속들로 이식이 가능했는지를 설명해준다.
하이드라진 그룹으로 감소
디아조늄염은 해당 하이드라진 유도체에 스탠성 염화물(SnCl2)을 사용하여 줄일 수 있다. 이 반응은 특히 삼프탄 화합물과 인도메타신의 피셔의 합성에서 유용하다. 디티오나이트 나트륨은 환경문제가 적은 저렴한 환원제여서 염화물보다 개선된 것이다.
생화학
유기화학에서는 드물게 볼 수 있는 알카네디아조늄 이온이 발암물질의 원인 물질로 사용된다. 구체적으로 니트로사민들은 알카니아디아조늄종을 생산하기 위해 신진대사 활동을 하는 것으로 생각된다.

적용들
디아조늄염의 첫 사용법은 원단을 디아조늄 화합물의 수용액에 담가 물속 염색을 한 원단을 만든 다음, 커플러 용액(전기생성 치환 과정을 거치는 전자가 풍부한 고리)에 담근다. 디아조늄 화합물의 주요 용도는 염료와 색소 산업에 남아 있다.[13]
기타 용도
디아조늄 화합물은 유기 화합물, 특히 아릴 유도체의 합성에 사용되는 표준 시약이다.
디아조늄염은 빛에 민감하며 자외선이나 보라색 빛에 가까운 곳에서 분해된다. 이 재산은 문서 복제에 그들을 이용하게 했다. 이 과정에서 종이나 필름에 디아조늄 소금이 코팅된다. 조명 아래에서 접촉 노출 후 잔여 디아조는 연결기의 수용액과 함께 안정적인 아조 염료로 전환된다. 보다 일반적인 공정은 결합을 억제하기 위해 디아조, 커플러 및 산으로 코팅된 종이를 사용한다. 노출 후 이미지는 결합을 강요하는 암모니아와 물의 증기 혼합물에 의해 개발된다.
안전
고체 디아조늄 할로겐화물은 종종 위험할 정도로 폭발성이 높으며, 사망자와 부상자가 보고되었다.[10]
음이온의 성질은 소금의 안정성에 영향을 미친다. 아레네디아조늄 과염소산염(Nitrobenzenediazonium perclorate)과 같은 아레네디아조늄 과염소산염이 폭발물을 일으키는데 사용되었다.
참고 항목
참조
- ^ Fei, Na; Sauter, Basilius; Gillingham, Dennis (2016). "The pK a of Brønsted acids controls their reactivity with diazo compounds". Chemical Communications. 52 (47): 7501–7504. doi:10.1039/C6CC03561B. PMID 27212133.
- ^ D. Bravo-Díaz, Carlos (2010-10-15), "Diazohydroxides, Diazoethers and Related Species", in Rappoport, Zvi (ed.), PATai's Chemistry of Functional Groups, John Wiley & Sons, Ltd, doi:10.1002/9780470682531.pat0511, ISBN 9780470682531
- ^ Carey, Francis A. (2007). Advanced organic chemistry. Sundberg, Richard J. (5th ed.). New York: Springer. ISBN 9780387448978. OCLC 154040953.
- ^ Streitwieser, Andrew; Schaeffer, William D. (June 1957). "Stereochemistry of the Primary Carbon. VI. The Reaction of Optically Active 1-Aminobutane-1-d with Nitrous Acid. Mechanism of the Amine-Nitrous Acid Reaction1". Journal of the American Chemical Society. 79 (11): 2888–2893. doi:10.1021/ja01568a054.
- ^ Friedman, Lester; Jurewicz, Anthony T.; Bayless, John H. (March 1969). "Influence of solvent on diazoalkane-alkanediazonium ion equilibriums in amine deaminations". Journal of the American Chemical Society. 91 (7): 1795–1799. doi:10.1021/ja01035a032.
- ^ Norman, R. O. C. (Richard Oswald Chandler) (2017). Principles of Organic Synthesis (3rd ed.). CRC Press. ISBN 9780203742068. OCLC 1032029494.
- ^ 디아조늄과 디아조 그룹의 화학: Part 1. S. Patai, Ed. 1978 Wiley-Blackwell. ISBN 0-471-99492-8 디아조늄과 디아조 그룹의 화학: Part 2. S. Patai, Ed. 1978 Wiley-Blackwell. ISBN 0-471-99493-6
- ^ Mihelač, M.; )Siljanovska, A.; Košmrlj, J. (2021). "A convenient approach to arenediazonium tosylates". Dyes Pigm. 184: 108726. doi:10.1016/j.dyepig.2020.108726.
- ^ Filimonov, Victor D.; Trusova, Marina; Postnikov, Pavel; Krasnokutskaya, Elena A.; Lee, Young Min; Hwang, Ho Yun; Kim, Hyunuk; Chi, Ki-Whan (2008-09-18). "Unusually Stable, Versatile, and Pure Arenediazonium Tosylates: Their Preparation, Structures, and Synthetic Applicability". Organic Letters. 10 (18): 3961–3964. doi:10.1021/ol8013528. ISSN 1523-7060. PMID 18722457.
- ^ a b "UK CRHF Incident Report – Supersaturated Diazonium salt causes Fatality". UK Chemical Reaction Hazards Forum. Archived from the original on 6 October 2018. Retrieved 13 May 2010.
- ^ R. V. Hoffman (1981). "m-Trifluoromethylbenzenesulfonyl Chloride". Org. Synth. 60: 121. doi:10.15227/orgsyn.060.0121.
- ^ K. 배고픔. W. Herbst "Pigments, Organic" Wily-VCH, Weinheim, 2012. doi:10.1002/14356007.a20_371
- ^ a b 클라우스 헝거, 피터 오드리케, 볼프강 리퍼 등 2005년 Wiley-VCH, Weinheim의 Ulmann 산업 화학 백과사전 "Azo Dyes". doi:10.1002/14356007.a03_message.
- ^ a b Clark, Jim. "chemguide". Retrieved 28 September 2011.
- ^ 3월 J. "Advanced Organic Chemical" 4번째 Ed. J. Wiley and Sons, 1992: 뉴욕 ISBN 978-0-471-60180-7
- ^ Marye Anne Fox; James K. Whitesell (2004). Organic Chemistry (3, illustrated ed.). Jones & Bartlett Learning. pp. 535–538. ISBN 978-0-7637-2197-8.
- ^ Atkinson, E. R.; Lawler, H. J. (1927). "Diphenic Acid". Org. Synth. 7: 30. doi:10.15227/orgsyn.007.0030.
- ^ Logullo, F. M.; Seitz, A. H.; Friedman, L. (1968). "Benzenediazonium-2-carboxy- and Biphenylene". Org. Synth. 48: 12. doi:10.15227/orgsyn.048.0012.
- ^ L. Gattermann (1894). "Untersuchungen über Diazoverbindungen". Berichte der Deutschen Chemischen Gesellschaft. 23 (1): 1218–1228. doi:10.1002/cber.189002301199.
- ^ Lucas, H. J.; Kennedy, E. R. (1939). "Iodobenzene". Org. Synth. 19: 55. doi:10.15227/orgsyn.019.0055.
- ^ Flood, D. T. (1933). "Fluorobenzene". Org. Synth. 13: 46. doi:10.15227/orgsyn.013.0046..
- ^ Furuya, Takeru; Klein, Johannes E. M. N.; Ritter, Tobias (2010). "C–F Bond Formation for the Synthesis of Aryl Fluorides". Synthesis. 2010 (11): 1804–1821. doi:10.1055/s-0029-1218742. PMC 2953275. PMID 20953341.
- ^ 라인하르트 브루크너, 에드 Michael Harmata; 유기 메커니즘 반응, 입체화학 및 합성 3차 Ed, 페이지 246, ISBN 978-3-8274-1579-0
- ^ H. E. Ungnade, E. F. Orwoll (1943). "3-Bromo-4-hydroxytoluene". Org. Synth. 23: 11. doi:10.15227/orgsyn.023.0011.
- ^ Kazem-Rostami, Masoud (2017). "Facile Preparation of Phenol". Synlett. 28 (13): 1641–1645. doi:10.1055/s-0036-1588180.
- ^ Carey, F. A.; Sundberg, R. J. (2007). Advanced Organic Chemistry. Vol. B, Chapter 11: Springer. pp. 1028.
{{cite book}}: CS1 maint : 위치(링크) - ^ Khazaei, Ardeshir; Kazem-Rostami, Masoud; Zare, Abdolkarim; Moosavi-Zare, Ahmad Reza; Sadeghpour, Mahdieh; Afkhami, Abbas (2013). "Synthesis, characterization, and application of a triazene-based polysulfone as a dye adsorbent". Journal of Applied Polymer Science. 129 (6): 3439–3446. doi:10.1002/app.39069.
- ^ R. H. F. Manske (1928). "m-Nitrophenol". Org. Synth. 8: 80. doi:10.15227/orgsyn.008.0080.
- ^ Wu, Jie; Gao, Yueqiu; Qiu, Guanyinsheng; He, Linman (2014-08-20). "Removal of amino groups from anilines through diazonium salt-based reactions". Organic & Biomolecular Chemistry. 12 (36): 6965–6971. doi:10.1039/C4OB01286K. ISSN 1477-0539. PMID 25093920.
- ^ Fairlamb, Ian; Firth, James D.; Hammarback, L. Anders; Burden, Thomas J.; Eastwood, Jonathan B.; Donald, James R.; Horbaczewskyj, Chris S.; McRobie, Matthew T.; Tramaseur, Adam; Clark, Ian P.; Towrie, Michael; Robinson, Alan; Krieger, Jean-Philippe; Lynam, Jason M. (2020). "Light‐ and Manganese‐Initiated Borylation of Aryl Diazonium Salts: Mechanistic Insight on the Ultrafast Time‐Scale Revealed by Time‐Resolved Spectroscopic Analysis". Chemistry – A European Journal. 27 (12): 3979–3985. doi:10.1002/chem.202004568. PMID 33135818. S2CID 226232322.
- ^ "Organic Syntheses Procedure". 2-bromo-4-methylbenzaldehyde. Retrieved 2021-05-04.
{{cite web}}: CS1 maint : url-status (링크) - ^ Beech, W. F. (1954-01-01). "Preparation of aromatic aldehydes and ketones from diazonium salts". Journal of the Chemical Society (Resumed): 1297–1302. doi:10.1039/JR9540001297. ISSN 0368-1769.
- ^ Sutton, D (1993). "Organometallic Diazo Compounds". Chem. Rev. 93 (3): 905–1022. doi:10.1021/cr00019a008.
- ^ Pinacho Crisóstomo Fernando (2014). "Ascorbic Acid as an Initiator for the Direct C-H Arylation of (Hetero)arenes with Anilines Nitrosated In Situ". Angewandte Chemie International Edition. 53 (8): 2181–2185. doi:10.1002/anie.201309761. PMID 24453180.
- ^ Price, B. Katherine (2005). "Green Chemical Functionalization of Single-Walled Carbon Nanotubes in Ionic Liquids". Journal of the American Chemical Society. 127 (42): 14867–14870. doi:10.1021/ja053998c. PMID 16231941.
- ^ Michael P. Stewart; Francisco Maya; Dmitry V. Kosynkin; et al. (2004). "Direct Covalent Grafting of Conjugated Molecules onto Si, GaAs, and Pd Surfaces from Arenediazonium Salts". J. Am. Chem. Soc. 126 (1): 370–8. doi:10.1021/ja0383120. PMID 14709104.
- ^ 반응 순서: 실리콘 표면과 불화수소 암모늄의 반응으로 수화층이 생성된다. 전자는 개방 회로 전위 감소로 실리콘 표면에서 디아조늄 소금으로 전달되어 실리콘 래디컬 큐션과 디아조늄 래디컬을 남긴다. 다음 단계에서는 양성자와 질소 분자가 배출되고 두 개의 급진적인 잔여물은 표면 실리콘과 탄소 결합을 형성하는 재조합된다.
- ^ Bélanger, Daniel; Pinson, Jean (2011). "Electrografting: a powerful method for surface modification". Chemical Society Reviews. 40 (7): 3995–4048. doi:10.1039/c0cs00149j. ISSN 0306-0012. PMID 21503288.
- ^ S.Q. Lud; M. Steenackers; P. Bruno; et al. (2006). "Chemical Grafting of Biphenyl Self-Assembled Monolayers on Ultrananocrystalline Diamond". J. Am. Chem. Soc. 128 (51): 16884–91. doi:10.1021/ja0657049. PMID 17177439.
- ^ De-en Jiang; Bobby G. Sumpter; Sheng Dai (2006). "Structure and Bonding between an Aryl Group and Metal Surfaces". J. Am. Chem. Soc. 128 (18): 6030–1. doi:10.1021/ja061439f. PMID 16669660.
- ^ Tricker, A.R.; Preussmann, R. (1991). "Carcinogenic N-Nitrosamines in the Diet: Occurrence, Formation, Mechanisms and Carcinogenic Potential". Mutation Research/Genetic Toxicology. 259 (3–4): 277–289. doi:10.1016/0165-1218(91)90123-4. PMID 2017213.
디아조 커플링 반응
외부 링크
- W. Reusch. "Reactions of Amines". VirtualText of Organic Chemistry. Michigan State University. Archived from the original on 2012-12-12.











![{\displaystyle {\ce {[C6H5N+2]BF4- -> C6H5F + BF3 + N2}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/98854fdc1405b490fdd0d68f060887ff90168c5b)
![{\displaystyle {\ce {[C6H5N2+]Cl- + H3PO2 + H2O -> C6H6 + N2 + H3PO3 + HCl}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/ae4fe80352442662e0e0ea86f444c2e7e154a36a)
![{\displaystyle {\ce {[C6H5N2+]Cl- + CH3CH2OH -> C6H6 + N2 + CH3CHO + HCl}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/1fd6aff8b1cca4b87fa0f2eb030d2df4b7521ff8)



![{\displaystyle {\ce {C6H5N2+ + [CuCF3] -> C6H5CF3 + [Cu]+ + N2}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/186b334438ab68ac9d7c76d6da6d2c60b3bbf50d)


![{\displaystyle {\ce {[C6H5N2+]Cl- + C6H6 -> C6H5-C6H5 + N2 + HCl}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/62f872781ba025ad2794380235783323c9a464c9)
![{\displaystyle {\ce {[C6H5N+2]Cl- + ArCH=CHCOOH -> ArC=C-C6H5 + N2 + CO2 + HCl}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/c56c56d4d1da0b2573f3464b3f344c9c72cbf35e)


