란비에르 노드
Node of Ranvier| 란비에르 노드 | |
|---|---|
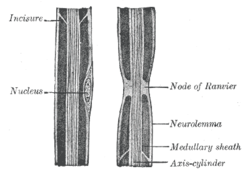 주변 신경 액손("축 실린더"라고 라벨이 표시됨)의 그림, 다른 특징과 함께 란비에의 노드가 표시됨 | |
 란비에르의 노드 | |
| 세부 사항 | |
| 시스템 | 신경계 |
| 위치 | 신경의 골수액손 |
| 식별자 | |
| 라틴어 | 인시수라 미엘리니 |
| 메슈 | D011901 |
| TH | H2.00.06.2.03015 |
| 미세조영술의 해부학적 용어 | |
골격차(Myelin-shheat 갭)라고도 알려진 [1][2]란비에(/ˈrɑnvieɪ/RAHN-vee-ay)의 노드는 축소마마가 세포외 공간에 노출되는 골수화 축소를 따라 발생한다. 란비에르 노드는 이온 채널에서 절연되지 않고 고농축되어 작용 전위를 재생하는 데 필요한 이온 교환에 참여할 수 있다. 몰리닝된 액손의 신경전도는 액손을 따라 한 노드에서 다음 노드로 "점프"하는 것처럼 보이는 방식으로 인해 염분 전도(라틴 솔투스 'leap, jump'에서)라고 한다. 이것은 행동 전위의 전도를 더 빠르게 한다.
개요
| 란비에르 노드 |
|---|
많은 척추동물 도끼들은 미엘린 피복에 둘러싸여 있어 행동 전위의 빠르고 효율적인 염분("점프") 전파를 가능하게 한다. 뉴런과 글라이알 세포의 접촉은 골수성 섬유에서 매우 높은 수준의 공간적, 시간적 조직을 보여준다. 골수성 글루알 세포 - 중추신경계(CNS), 말초신경계(PNS)에 있는 슈완세포(Schwann cells)는 액손에 감싸여 있어 정기적으로 간격을 두고 있는 란비에의 노드에서 액솔마마가 비교적 잘 드러나지 않게 된다.
세포내 활엽막은 결합되어 콤팩트한 미엘린을 형성하는 반면, 세포질 내에 가득 찬 미엘린 세포의 편집성 루프는 노드의 양쪽에 있는 액손 둘레에 나선형으로 감겨 있다. 이 조직은 엄격한 개발 통제와 골수화 세포막의 서로 다른 영역들 사이에 다양한 전문 접촉 구역의 형성을 요구한다. 랑비에의 각 노드는 나선형으로 포장된 글라이알 루프가 파열성 접합부에 의해 축 막에 부착되는 편집성 부위의 측면에 있다.
란비에르 노드 사이의 구간을 내노드(internode)라고 하며, 편집증과 접촉하는 가장 바깥쪽 부분을 헥스타파라나노달(juxtaparanodal) 영역이라고 한다. 이 노드는 PNS의 슈완 세포막의 외측에서 비롯된 마이크로빌리 또는 CNS의 아스트로사이테스로부터의 근막 확장에 의해 캡슐화된다.
구조
내부 노드는 골수 부분이며, 그 사이의 간격을 노드라고 한다. 인터노드의 크기와 간격은 최대 전도 속도에 최적화된 곡선 관계에서 섬유 직경에 따라 다양하다.[3] 노드의 크기는 1~2μm까지이며, 인터노드는 액손 지름과 섬유 유형에 따라 최대 1.5 밀리미터(그리고 때로는 이보다 더 길 수도 있다)까지 될 수 있다.
노드의 구조와 옆구리 편집증적 영역은 콤팩트 미엘린 피복 아래의 인터노드와 구별되지만, CNS와 PNS에서는 매우 유사하다. 액손은 노드의 외세포 환경에 노출되어 직경에서 수축된다. 축사 크기가 줄어든 것은 이 지역에서 더 높은 포장 밀도의 신경 필라멘트를 반영하는데, 이는 인광성이 덜하고 더 느리게 운반된다.[4] 노드에서 Vesicles와 다른 Organells도 증가하는데, 이는 국부 축-광선 신호뿐만 아니라 양방향의 축 이송의 병목현상이 있음을 시사한다.
노드에서 골수성 슈완 셀을 통해 종단면을 만들 때, 정형화된 내부 형태, 편집성 영역, 노드 자체의 세 가지 독특한 세그먼트가 나타난다. 내부 영역에서 슈완 세포는 세포질의 외측 칼라, 콤팩트 미엘린 피스, 세포질의 내측 칼라, 그리고 액솔레마마(Axolema)를 가지고 있다. 편집증적 영역에서는 편집성 세포질 루프가 액솔레마의 접촉 농도를 두껍게 하여 패혈증 같은 결합을 형성한다. 노드에서만 여러 슈완 마이크로빌리(Schwann microvilli)가 액솔레마(Axolema)와 접촉하며 촘촘한 시토골격 하부코팅이 들어 있다.
중추신경계와 말초신경계의 차이
동결파괴 연구 결과 CNS와 PNS의 노달악솔레마(nodal axolema)가 내부 노드에 비해 내장입자(IMP)에서 농축되어 있는 것으로 밝혀졌지만, 세포 성분을 반영하는 구조적 차이가 있다.[4] PNS에서는 슈완 세포의 외측 칼라로부터 전문화된 마이크로빌리 프로젝트로서, 큰 섬유의 노달 액솔레마에 매우 근접한다. Schwann 셀의 투영은 노드에 수직이며 중심 축에서 방사된다. 그러나 CNS에서는 하나 이상의 아스트로시틱 프로세스가 노드 근처에 온다. 연구자들은 이러한 과정이 노드와 접촉하는 데 전념하는 아스트로사이테의 모집단이 아니라 다기능 아스트로사이테에서 비롯된다고 선언한다. 한편, PNS에서는, 슈완 세포들을 둘러싸고 있는 기저 라미나가 노드를 가로질러 계속된다.
구성
Ranvier Na+/Ca2+ 교환기의 노드 및 작용 전위를 생성하는 전압 게이트 Na+ 채널의 고밀도. 나트륨 채널은 모공성형 α 서브유닛과 2개의 부속품 β 서브유닛으로 구성되며, 이는 채널을 외세포 및 세포내 구성요소에 고정시킨다. 중추신경계와 말초신경계의 란비에르 노드는 대부분 αNaV1.6과 β1 서브유닛으로 구성된다.[5] β 서브유닛의 세포외 부위는 자신 및 다른 단백질과 연관될 수 있다. 테나신 R과 세포접착분자 신경파신 및 컨택틴과 같은 세포접착분자. CNS의 노드에도 콘택틴이 존재하며, 이 분자와의 상호작용은 Na+ 채널의 표면표현을 강화한다.
앤키린은 랑비에르와 액손 초기 세그먼트의 노드에서 농축된 분광형인 βIV 스펙트린에 경계가 있는 것으로 밝혀졌다. PNS 노드는 액틴 마이크로필름에 연결될 수 있는 ERM과 EBP50을 포함하는 Schwann 셀 마이크로빌리로 둘러싸여 있다. 몇몇 세포외 매트릭스 단백질은 테나신-R, 브랄-1, 프로테오글리칸 NG2와 인산염, 베르시칸 V2를 포함한 란비에르 노드에서 농축된다. CNS 노드에서, 축 단백질은 또한 컨택틴을 포함한다. 그러나, Schwann 세포 마이크로빌리는 아스트로사이테 근막연장으로 대체된다.
분자 조직
노드의 분자 조직은 충동 전파에 있어서 그들의 특화된 기능에 해당한다. 노드의 나트륨 채널과 내부 노드의 수준은 IMM 수가 나트륨 채널에 해당함을 나타낸다. 칼륨 채널은 노드의 편집성 액솔레마와 슈완 세포막에 고도로 집중되어 있는 반면, 노드의 노드에 있는 칼륨 채널은 기본적으로 존재하지 않는다.[4] 칼륨 채널의 정확한 기능은 아직 밝혀지지 않았지만, 작용 전위의 급속한 재분극화에 기여하거나 노드에서 칼륨 이온을 완충하는 데 중요한 역할을 할 가능성이 있는 것으로 알려져 있다. 이러한 전압 게이트 나트륨과 칼륨 채널의 고도로 비대칭적인 분포는 비염기성 섬유에서의 분산 분포와 현저한 대조를 이룬다.[4][6]
결막과 인접한 필라멘트 네트워크는 분광과 앤키린이라는 세포골격 단백질을 포함하고 있다. 노드에 채워진 몇몇 단백질은 극도로 높은 친화력으로 앤키린과 결합하는 능력을 공유하기 때문에 노드에서 앤키린의 높은 밀도는 기능적으로 중요할 수 있다. 앙키린을 포함한 이 모든 단백질은 기능적 관계를 암시하는 액손의 초기 부분에서 농축된다. 이제 이러한 분자 성분의 관계는 노드에서 나트륨 채널의 군집화와 여전히 알려져 있지 않다. 비록 일부 세포 부착 분자가 노드에 일관되지 않게 존재한다고 보고되었지만, 다양한 다른 분자들은 그들이 조직과 구조적인 무결성에 기여하는 편집성 지역의 활엽막에 고도로 밀집되어 있는 것으로 알려져 있다.
개발
신경섬유의 몰리닝
슈완세포가 말초신경섬유의 몰링 과정에서 겪는 복잡한 변화는 많은 사람들에 의해 관찰되고 연구되어 왔다. 액손의 초기 포락은 슈완 셀의 전체 범위를 따라 중단 없이 발생한다. 이 과정은 Schwann 세포 표면의 인폴딩에 의해 시퀀싱되어 인폴딩된 Schwann 세포 표면의 반대 면의 이중 막이 형성된다. 이 막은 슈완 세포 표면의 인폴딩이 계속되면서 팽창하고 나선형으로 몸을 감싸고 있다. 그 결과 단면직경에서 미엘린 피복의 연장두께가 증가하는 것을 쉽게 확인할 수 있다. 나선형의 연속 회전을 할 때마다 회전의 횟수가 증가함에 따라 축의 길이를 따라 크기가 커지는 것도 분명하다. 단, 앞에서 설명한 바와 같이 나선형의 연속 턴에 의해 덮인 축의 길이 증가만으로 미엘린 피복의 길이 증가를 설명할 수 있을지는 명확하지 않다. 축선을 따라 두 개의 슈완 세포가 만나는 지점에서, 미엘린 종말의 성층 오버행의 방향은 정반대다.[7] 슈완 세포와 인접한 이 접합부는 란비에의 노드로 지정된 지역을 구성한다.
초기 단계
연구자들은 개발 중인 CNS에서 Nav1.2가 처음에는 랑비에의 모든 형성 노드에서 표현된다는 것을 증명한다.[8] 성숙과 동시에, Nodal Nav1.3은 하향 조절되고 Nav1.6으로 대체된다. Naz1.2는 또한 PNS 노드 형성 중에 표현된다. Nav-channel 하위 유형의 전환은 CNS와 PNS에서 일반적인 현상임을 시사한다. 이 같은 조사에서는 초기 몰리닝 동안 랑비에의 많은 노드에서 Nav1.6과 Nav1.2가 콜로컬라이징되는 것으로 나타났다. 이것은 또한 초기 Nav1.2 채널과 Nav1.6 채널 클러스터가 나중에 Ranvier의 노드가 될 것이라는 제안으로 이어졌다. 뉴로파신 역시 새롭게 형성된 란비에르 노드에 축적된 최초의 단백질 중 하나라고 보고되고 있다. 그들은 또한 Ankyrin G, Nav 채널, 그리고 다른 단백질의 부착을 위한 핵 부지를 제공하는 것으로 밝혀졌다.[9] 최근 슈완 세포 마이크로빌리 단백질 글리오메딘이 축 신경파신(Axonal Neurofascin)의 결합 파트너로 확인됨에 따라 랑비에르 노드에 Nav 채널을 모집하는 데 있어 이 단백질의 중요성에 대한 실질적인 증거를 제시하게 되었다. 더욱이 램버트 외 연구진 및 에시드 외 연구진도 Nav 채널보다 먼저 신경파시신이 축적되고 란비에 형성 노드와 관련된 초기 사건에서 중요한 역할을 할 가능성이 있음을 나타낸다. 따라서, 여러 메커니즘이 존재하며 랑비에의 노드에서 Nav 채널의 클러스터링을 용이하게 하기 위해 시너지 효과를 낼 수 있다.
노달형성
첫 번째 사건은 NF186이나 NrCAM과 같은 세포 접착 분자의 축적인 것으로 보인다. 이러한 세포접착 분자의 세포내 영역은 나트륨 채널의 닻 역할을 하는 앤키린 G와 상호작용한다. 동시에 활엽세포의 경막연장이 액손 주위를 감싸면서 편집증적 부위가 생겨난다. 액손에 따른 이러한 움직임은 이웃한 글라이알 셀의 가장자리에 형성된 헤미노드가 완전한 노드로 융합되도록 허용함으로써 란비에르 노드의 전체적인 형성에 크게 기여한다. 황색 루프에 NF155가 농축되면서 황색에서 퇴화성 같은 결합이 형성된다. 목덜미와 편집성 부위의 초기 분화 직후 칼륨 채널, Caspr2와 TAG1이 헥타-파라노달 지방에 축적된다. 이러한 축적은 콤팩트 미엘린의 형성과 직접적으로 일치한다. 성숙한 결절 부위에서 세포내 단백질과의 상호작용은 모든 결절 부위의 안정성을 위해 필수적으로 보인다. CNS에서 과두정도는 마이크로빌리를 가지고 있지 않지만, 분비된 인자를 통해 일부 축 단백질의 군집을 시작할 수 있는 것으로 보인다. 그러한 요인의 결합 효과와 과두덴드로시테 경연장의 포장에 의해 생성된 후속 움직임의 결합은 랑비에의 CNS 노드 조직을 설명할 수 있다.
함수
액션 포텐셜
작용 전위는 세포막을 따라 이동하는 양과 음의 이온 방출의 스파이크다.[10] 행동 전위의 생성과 전도는 신경계의 근본적인 의사소통 수단을 나타낸다. 작용 전위는 액손의 혈장 막 전체에 걸쳐 전압의 급속한 역전을 나타낸다. 이러한 빠른 역전은 플라즈마 막에서 발견되는 전압 게이트 이온 채널에 의해 매개된다. 작용 전위는 세포의 한 위치에서 다른 위치로 이동하지만, 막을 가로지르는 이온 흐름은 란비에의 노드에서만 발생한다. 그 결과, 미엘린 피스가 없는 액손에서처럼 부드럽게 전파되기보다는 노드에서 노드로 동작 전위 신호가 차축을 따라 점프한다. 노드에서 전압 게이트 나트륨과 칼륨 이온 채널의 클러스터링은 이러한 동작을 허용한다.
염분 전도
액손은 무광택 또는 미광택이 가능하므로 액손 아래로 이동하는 두 가지 방법이 있다. 이러한 방법을 무염화축에 대한 연속전도와 염화축에 대한 염화전도로 칭한다. 염전도는 몰리닝된 액손에서 이산 점프를 하는 작용 전위로 정의된다.
이 프로세스는 전하가 수동적으로 란비에의 다음 노드로 확산되어 임계치로 역분화되며, 이는 이 지역에서 활동 잠재력을 촉발하고, 그 다음 노드로 수동적으로 확산되는 방식으로 요약된다.
염분 전도는 골수 피복 없이 축사를 따라 발생하는 전도에 비해 한 가지 장점을 제공한다. 이것은 이러한 전도 방식이 제공하는 증가된 속도가 뉴런들 사이의 상호작용을 더 빠르게 보장한다는 것이다. 한편, 뉴런의 평균 발화율에 따라, 과두정체의 휴식 잠재력을 유지하는 에너지 비용이 행동 잠재력의 에너지 절약량을 능가할 수 있다는 계산이 나온다.[11] 그러므로 액손 몰리닝이 반드시 에너지를 절약하는 것은 아니다.
형성규정
미토콘드리아 축적을 통한 편집증적 규제
미토콘드리아와 다른 막조직 유기체는 일반적으로 주변 골수축의 PNP 영역, 특히 큰 구경 축에서 농축된다.[12] 이러한 축적의 실제 생리학적 역할과 그것을 조절하는 요인은 이해되지 않지만, 미토콘드리아는 대개 높은 에너지 수요를 나타내는 세포의 영역에 존재하는 것으로 알려져 있다. 이러한 동일한 지역에서, 그것들은 또한 Ranvier의 노드와 같이 성장 원뿔, 시냅스 단자, 행동의 잠재적 개시 및 재생의 현장을 포함하는 것으로 이해된다. 시냅스 단자에서 미토콘드리아는 신경 전달을 위해 베실체를 동원하는 데 필요한 ATP를 생산한다. 란비에르 노드에서 미토콘드리아는 에너지를 필요로 하는 이온펌프의 활동을 유지하는 데 필수적인 ATP를 생산함으로써 임펄스 전도에 중요한 역할을 한다. 이러한 사실을 뒷받침하여, 이러한 섬유질의 해당 내부 영역보다 큰 말초 축의 PNP 축소체에 약 5배 더 많은 미토콘드리아가 존재한다.[12]
노달 규제
비아 αII-스펙트린
골수화축소의 염전도는 랑비에르 노드의 조직을 필요로 하는 반면, 전압화 나트륨 채널은 인구밀도가 높다. 연구 결과 사이토스켈레톤 성분인 αII-스펙트린이 초기 단계에서 노드에서 농축되고 편집이 되며 노드가 성숙할수록 이 분자의 발현이 사라진다고 한다.[13] 또한 나트륨 채널 군집을 안정화하고 란비에의 성숙한 노드를 조직하기 위해서는 축방향 시토스켈레톤 내 αII-스펙트린이 절대적으로 필수적이라는 것이 입증되었다.
인식 분자 OMgp를 통한 가능한 조절
이전에 랑비에르 노드에 OMgp(올리겐드로시테 미엘린 당단백질) 클러스터가 있고 편집증적 아키텍처, 노드 길이, 노드의 축새싹을 규제할 수 있다는 것이 밝혀졌다.[14] 그러나 후속 연구에서는 노드에서의 OMgp를 식별하기 위해 이전에 사용된 항체가 노드 부자성분인 V2와 상호 작용하며, 이전에 보고된 노드의 국산화 및 제안된 노드 OMgp 기능에 대해 주장하면서 노드 및 편집의 무결성에 OMgp가 필요하지 않다는 것을 보여주었다.[15]
임상적 유의성
부상을 입었을 때 이러한 흥분하기 쉬운 뉴런 영역 내의 단백질은 인지 장애와 다양한 신경병 질환을 일으킬 수 있다.
역사
긴 신경의 골격은 1854년 독일의 병리학 해부학자 루돌프 비르초[16](Rudolf Virchow)에 의해 발견되어 명명되었다.[17] 프랑스의 병리학자 겸 해부학자 루이 앙투안 란비에르는 후에 현재 그의 이름이 새겨진 미엘린 피복의 마디, 즉 틈새를 발견했다. 리옹에서 태어난 란비에르는 19세기 후반의 가장 유명한 역사학자 중 한 명이었다. 란비에르는 1867년 병리학 연구를 포기하고 생리학자 클로드 버나드의 조수가 되었다. 그는 1875년 프랑스 Collége de France에서 General Anatomy 의장을 맡았다.
그의 세련된 역사학 기법과 부상과 정상적인 신경섬유에 대한 그의 연구는 세계적으로 유명해졌다. 그의 섬유 노드에 대한 관찰과 절단 섬유의 퇴화와 재생은 살페트리에르 파리의 신경학에도 큰 영향을 미쳤다. 곧이어 그는 신경섬유의 피복에서 틈새를 발견했는데, 이 틈은 후에 '란비에르의 노드'라고 불렸다. 이 발견은 후에 란비에르로 하여금 미엘린 피복과 슈완 세포에 대한 세심한 역사학적 검사를 하게 했다.[18]
추가 이미지
참고 항목
참조
- ^ "node of Ranvier". Lexico UK English Dictionary. Oxford University Press. n.d.
- ^ "node of Ranvier". Merriam-Webster Dictionary.
- ^ gxnSalzer J. L. (1997). "Clustering sodium channels at the node of Ranvier: close encounters of the axon-glia kind". Neuron. 18 (6): 843–846. doi:10.1016/S0896-6273(00)80323-2. PMID 9208851. S2CID 6743084. Archived from the original on 2007-12-18. Retrieved 2007-12-07.
- ^ a b c d Salzer J. L. (1997). "Clustering sodium channels at the node of Ranvier: close encounters of the axon-glia kind". Neuron. 18 (6): 843–846. doi:10.1016/S0896-6273(00)80323-2. PMID 9208851. S2CID 6743084. Archived from the original on 2007-12-18. Retrieved 2007-12-07.
- ^ Kaplan M.R.; Cho M.H.; Ullian E.M.; Isom L.L.; Levinson S.R.; Barres B.A. (2001). "Differential control of clustering of the sodium channels Na(v)1.2 and Na(v)1.6 at developing CNS nodes of Ranvier". Neuron. 30 (1): 105–119. doi:10.1016/S0896-6273(01)00266-5. PMID 11343648. S2CID 10252129.
- ^ 블랙, J.A., 손티머, H., 오, Y., 그리고 S.G. 왁스맨(1995). The Axon, S. Waxman, J. Kocsis, P에서. Stys, Eds. 뉴욕 옥스퍼드 대학 출판부, 116-143페이지.
- ^ Uzmman B. G.; Nogueira-Graf G. (1957). "Electron microscope studies of the formation of nodes of Ranvier in mouse sciatic nerves". Journal of Biophysical and Biochemical Cytology. 3 (4): 589–597. doi:10.1083/jcb.3.4.589. PMC 2224104. PMID 13449102.
- ^ Boiko T, Rasband MN, Levinson SR, Caldwell JH, Mandel G, Trimmer JS, et al. (2001). "Compact myelin dictates the differential targeting of two sodium channel isoforms in the same axon". Neuron. 30 (1): 91–104. doi:10.1016/S0896-6273(01)00265-3. PMID 11343647. S2CID 7168889.
- ^ Lambert S, Davis JQ, Bennett V (1997). "Morphogenesis of the node of Ranvier: co-clusters of ankyrin and ankyrin-binding integral proteins define early developmental intermediates". Journal of Neuroscience. 17 (18): 7025–7036. doi:10.1523/JNEUROSCI.17-18-07025.1997. PMC 6573274. PMID 9278538.
- ^ Fry, C (2007). "Cell physiology I". Surgery (Oxford). 25 (10): 425–429. doi:10.1016/j.mpsur.2007.07.007.
- ^ Harris; Atwood (2012). "The Energetics of CNS White Matter". Journal of Neuroscience. 32 (1): 356–371. doi:10.1523/JNEUROSCI.3430-11.2012. PMC 3272449. PMID 22219296.
- ^ a b Einheber S, Bhat MA, Salzer JL (Aug 2006). "Disrupted Axo-Glial Junctions Result in Accumulation of Abnormal Mitochondria at Nodes of Ranvier". Neuron Glia Biology. 2 (3): 165–174. doi:10.1017/S1740925X06000275. PMC 1855224. PMID 17460780.
- ^ Voas MG, Lyons DA, Naylor SG, Arana N, Rasband MN, Talbot WS (Mar 2007). "alphaII-spectrin is essential for assembly of the nodes of Ranvier in myelinated axons". Current Biology. 17 (6): 562–8. doi:10.1016/j.cub.2007.01.071. PMID 17331725. S2CID 14537696.
- ^ Huang, JK; Phillips, GR; Roth, AD; Pedraza, L; Shan, W; Belkaid, W; Mi, S; Fex-Svenningsen, A; Florens, L; Yates III, JR; Colman, DR (2005). "Glial membranes at the node of Ranvier prevent neurite outgrowth". Science. 310 (5755): 1813–17. Bibcode:2005Sci...310.1813H. doi:10.1126/science.1118313. PMID 16293723. S2CID 17410200.
- ^ Chang, KJ; Susuki, K; Dours-Zimmermann, MT; Zimmermann, DR; Rasband, MN (2010). "Oligodendrocyte myelin glycoprotein does not influence node of Ranvier structure or assembly". J Neurosci. 30 (43): 14476–81. doi:10.1523/JNEUROSCI.1698-10.2010. PMC 2976578. PMID 20980605.
- ^ 누가 이름을 지었는가?
- ^ Virchow R (1854). "Über das ausgebreitete Vorkommen einer dem Nervenmark analogen Substanz in den tierischen Geweben". Archiv für pathologische Anatomie und Physiologie und für klinische Medicin. 6 (4): 562–572. doi:10.1007/BF02116709. S2CID 20120269.
- ^ Barbara J.G. (2005). "Les étranglements annulaires de Louis Ranvier (1871)" (PDF). Lettre des Neurosciences. 28: 3–5.
외부 링크
- 셀 중심 데이터베이스 – 란비에르 노드
- 해부 사진: 신경/pns/신경2/신경5 - 데이비스 캘리포니아 대학교의 비교 기관학 – "PNS, 신경(LM, Medium)"






