헥사메틸렌테트라민
Hexamethylenetetramine| | |||
| 이름 | |||
|---|---|---|---|
| 우선 IUPAC 이름 1,3,5,7-테트라자다만탄 | |||
| 기타 이름 헥사민, 메테나민, 우로트로핀;포르민, 아미노포름 | |||
| 식별자 | |||
3D 모델(JSmol) | |||
| 2018 | |||
| 체비 | |||
| 첸블 | |||
| 켐스파이더 | |||
| 드러그뱅크 | |||
| ECHA 정보 카드 | 100.002.642 | ||
| EC 번호 |
| ||
| E번호 | E239(방부제) | ||
| 26964 | |||
| 케그 | |||
| 메쉬 | 메테나민 | ||
PubChem CID | |||
| RTECS 번호 |
| ||
| 유니 | |||
| UN 번호 | 1328 | ||
CompTox 대시보드 (EPA ) | |||
| |||
| |||
| 특성. | |||
| 채널6124 | |||
| 몰 질량 | 140.150g/140g | ||
| 외모 | 백색 결정성 고체 | ||
| 냄새 | 비린내 나는 암모니아 같은 것 | ||
| 밀도 | 1.33 g/cm3 (20 °C에서) | ||
| 녹는점 | 280 °C (536 °F, 553 K) (하위 시간) | ||
| 85.3 g/100 mL | |||
| 용해성 | 클로로포름, 메탄올, 에탄올, 아세톤, 벤젠, 자일렌, 에테르에 가용 | ||
| 클로로포름의 용해성 | 13.4g/100g(20°C) | ||
| 메탄올의 용해성 | 7.25g/100g(20°C) | ||
| 에탄올의 용해성 | 2.89g/100g(20°C) | ||
| 아세톤의 용해성 | 0.65g/100g(20°C) | ||
| 벤젠의 용해성 | 0.23g/100g(20°C) | ||
| 산도(pKa) | 4.89[1] | ||
| 약리학 | |||
| J01XX05 (WHO) | |||
| 위험 요소 | |||
| 산업안전보건(OHS/OSH): | |||
주요 위험 요소 | 가연성이 높고 유해함 | ||
| GHS 라벨링: | |||
  | |||
| 경고 | |||
| H228, H317 | |||
| P210, , , , , , , , , | |||
| NFPA 704(파이어 다이아몬드) | |||
| 플래시 포인트 | 250 °C (482 °F, 523 K) | ||
| 410 °C (770 °F, 683 K) | |||
달리 명시되지 않은 한 표준 상태(25°C[77°F], 100kPa)의 재료에 대한 데이터가 제공됩니다. | |||
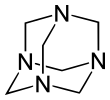
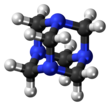
헥사메틸렌테트라민(메테나민, 헥사민 또는 우로트로핀)은 식(6CH2)N의4 복소환 유기 화합물이다.이 하얀 결정성 화합물은 물과 극성 유기 용제에 매우 잘 용해됩니다.그것은 아다만탄과 비슷한 케이지 같은 구조를 가지고 있다.플라스틱, 의약품 및 고무 첨가물을 포함한 다른 유기 화합물의 합성에 유용합니다.280°C의 진공 상태에서 승화됩니다.
합성, 구조, 반응성
헥사메틸렌테트라민은 [2][3]1859년 알렉산드르 버틀로프에 의해 발견되었다.포름알데히드와 [4]암모니아를 결합하여 공업적으로 제조됩니다.
반응은 기체상 및 용액에서 수행될 수 있습니다.
그 분자는 아다만탄과 비슷한 사면체 케이지 같은 구조를 가지고 있다.네 개의 정점은 메틸렌기로 연결된 질소 원자에 의해 점유된다.분자 형상이 케이지라고 정의되어 있지만 크라운에테르나 더 큰 크립탄 구조와는 달리 내부에는 다른 원자나 분자를 결합하기 위한 보이드 공간이 없습니다.
분자는 양성자화 및 N-알킬화(예: 4분위 15)를 거치며 아민 염기처럼 행동한다.
적용들
헥사메틸렌테트라민의 주요 용도는 페놀수지 및 페놀수지 몰딩 화합물의 분말 또는 액체 제제 생산에 있으며, 여기에서 경화 성분으로 첨가된다.이러한 제품은 예를 들어 브레이크 및 클러치 라이닝, 연마 제품, 부직포, 성형 공정으로 생산된 성형 부품 및 내화 [4]재료 등에 바인더로 사용됩니다.
의료 용도
만델산염(메테나민만델레이트) 또는 히푸르산염(메테나민히푸레이트)[5]으로 요로감염 치료에 사용된다.산성 환경에서는 메테나민이 포름알데히드로 [5][6]변환됨으로써 항균제 역할을 하는 것으로 생각된다.성인 여성에 대한 이러한 목적을 위한 사용을 체계적으로 검토한 결과 유익성의 증거가 불충분했으며 추가 연구가 필요한 [7]것으로 나타났다.
메테나민은 포름알데히드의 [8]떫은 성질로 인해 처방전 없이 살 수 있는 해열제 역할을 한다.
조직학적 얼룩
메테나민 은색 얼룩은 다음 유형을 포함하여 조직학에서 염색에 사용됩니다.
- 그로콧의 메테나민 은색 얼룩으로 곰팡이균의 차단제로 널리 사용되었습니다.
- 기저막을 위해 염색하는 메테나민 은-주기산-시프인 존스 얼룩은 막성 사구체신염과 관련된 "스파이크" 사구체 기저막을 볼 수 있습니다.
고체 연료
1,3,5-트리옥산과 함께, 헥사메틸렌테트라민은 야영객, 취미생활자, 군대 및 구호단체에서 캠핑 음식이나 군용 식량을 가열하기 위해 사용하는 헥사민 연료 정제 성분이다.무연소, 1kg당 30.0메가줄(MJ/kg)의 높은 에너지 밀도, 연소 중 액화되지 않으며 연소가 독성이 있지만 재를 남기지 않습니다.
표준화된 0.149g의 메테나민(헥사민)은 카펫과 [9]카펫의 가연성을 테스트하기 위해 깨끗하고 재현 가능한 화재원으로 방화 연구소에서 사용됩니다.
식품첨가물
식품첨가물로서도 방부제로서 헥사메틸렌테트라민 또는 헥사민을 사용한다(INS 번호 239).E [10]번호 E239에 기재되어 있는 EU에서는 이 목적으로 사용이 승인되어 있습니다만, 미국, 러시아, 호주,[11] 뉴질랜드에서는 승인되어 있지 않습니다.
유기화학 시약
헥사메틸렌테트라민은 유기합성의 [12]다용도 시약이다.Duff 반응(아렌의 [13]포름화),[15] Sommelet 반응(할로겐화벤질에서 알데하이드로 [14]변환) 및 Delepine 반응(알킬할로겐화물로부터 아민의 합성)에 사용된다.
폭발물
헥사메틸렌테트라민은 RDX를 생성하는 염기성분이며, 결과적으로 C-4와[4] 옥토겐, 헥사민 디니트레이트, 헥사민 디퍼클로르산 및 HMTD를 생성한다.
과거의 용도
헥사메틸렌테트라민은 1895년 소변 [16]방부제로 의료 환경에 처음 도입되었다.그러나, 붕산은 알칼리성 [17]소변에 의한 요로 감염을 치료하는데 사용된 반면, 산성 소변의 경우에만 사용되었다.과학자 De Eds는 헥사메틸렌테트라민 환경의 산도와 분해 [18]속도 사이에 직접적인 상관관계가 있다는 것을 발견했다.따라서 [17]약물의 투여량보다는 소변의 산도에 따라 약효가 크게 좌우되었다.알칼리 환경에서 헥사메틸렌테트라민은 거의 완전히 [17]비활성화된 것으로 밝혀졌다.
헥사메틸렌테트라민은 제1차 세계대전 당시 포스겐에 피폭된 병사들의 치료 방법으로 사용되기도 했다. 후속 연구에 따르면 헥사메틸렌테트라민의 다용량은 포스겐 피폭 전에 복용하면 어느 정도 보호를 제공하지만 이후에는 [19]복용하지 않는 것으로 나타났다.
프로듀서
1990년 이후 유럽 생산자 수는 감소하고 있다.프랑스 SNPE 공장은 1990년에 문을 닫았고, 1993년에 독일 Leuna에 있는 헥사메틸렌테트라민의 생산이 중단되었다. 1996년에 이탈리아 아그롤린츠 공장은 문을 닫았고, 2001년에 영국 생산업체인 보든은 문을 닫았고, 2006년에는 슬로바키아 켐코에서의 생산이 중단되었다.나머지 생산업체로는 독일의 IEOS, 네덜란드의 칼딕, 이탈리아의 헥시온이 있다.미국에서는 Eli Lilly와 Company가 2002년에 [9]메테나민 태블릿 생산을 중단했습니다.호주에서 연료용 헥사민 태블릿은 Thales Australia Ltd.에 의해 제조된다.멕시코에서 헥사민은 아비야가 생산한다.
레퍼런스
- ^ Cooney, A. P.; Crampton, M. R.; Golding, P. (1986). "The acid-base behaviour of hexamine and its N-acetyl derivatives". J. Chem. Soc., Perkin Trans. 2 (6): 835–839. doi:10.1039/P29860000835.
- ^ Butlerow,은(1859년)."Ueber einige Derivate 데 Jodmethylens"[요오드화 메틸렌의 일부 파생 상품에].앤. 화학.약품.(독일어로).111(2):242–252. doi:10.1002/jlac.18591110219.이 기사에서, 부틀레로프기 때문에 그의 실험식은 잘못된(C4H4O4)그는"dioxymethylen"(메틸렌 탄소)[페이지 247]로 불리는 포름 알데히드를 발견했다.249-250페이지에서 그는 포름알데히드를 암모니아 가스로 처리하여 헥사민을 생성한다고 설명합니다.
- ^ Butlerow, A. (1860). "Ueber ein neues Methylenderivat" [On a new methylene derivative]. Ann. Chem. Pharm. (in German). 115 (3): 322–327. doi:10.1002/jlac.18601150325.
- ^ a b c Eller, K.; Henkes, E.; Rossbacher, R.; Höke, H. (2000). "Amines, Aliphatic". Ullmann's Encyclopedia of Industrial Chemistry. Wiley-VCH Verlag GmbH. doi:10.1002/14356007.a02_001. ISBN 9783527306732.
- ^ a b Lo, Tze Shien; Hammer, Kimberly DP; Zegarra, Milagros; Cho, William CS (2014). "Methenamine: A forgotten drug for preventing recurrent urinary tract infection in a multidrug resistance era". Expert Review of Anti-Infective Therapy. 12 (5): 549–554. doi:10.1586/14787210.2014.904202. PMID 24689705. S2CID 207199202.
- ^ Chwa, A; Kavanagh, K; Linnebur, SA; Fixen, DR (2019). "Evaluation of methenamine for urinary tract infection prevention in older adults: a review of the evidence". Therapeutic Advances in Drug Safety. 10: 2042098619876749. doi:10.1177/2042098619876749. PMC 6759703. PMID 31579504.
- ^ Bakhit M, Krzyzaniak N, Hilder J, Clark J, Scott AM, Mar CD (January 2021). "Use of methenamine hippurate to prevent urinary tract infections in community adult women: a systematic review and meta-analysis". Br J Gen Pract (Systematic review). 71 (708): e528–e537. doi:10.3399/BJGP.2020.0833. PMC 8136580. PMID 34001538.
- ^ Susak, Z.; Minkov, R.; Isakov, E. (1996). "The use of Methenamine as an antiperspirant for amputees". Prosthetics and Orthotics International. 20 (3): 172–5. doi:10.3109/03093649609164439. PMID 8985996. S2CID 24088433.
- ^ a b Alan H. Schoen(2004), Wayback Machine에서 2008-10-05년에 아카이브된 카펫과 러그의 가연성을 위한 Methenamine 태블릿의 동등성 규격.미국 소비자 제품 안전 위원회, 워싱턴 DC, 2004년7월 29일아직도 이것을 생산하는 많은 다른 나라들에는 러시아, 사우디아라비아, 중국, 호주가 있다.
- ^ 영국 식품 표준 기관:
- ^ 오스트레일리아 뉴질랜드 식품 표준"Standard 1.2.4 - Labelling of ingredients". Retrieved 2011-10-27. 코드
- ^ Blažzević, N.; Kolbah, D.; Belin, B.; Šunjić, V.; Kajfež, F. (1979). "Hexamethylenetetramine, A Versatile Reagent in Organic Synthesis". Synthesis. 1979 (3): 161–176. doi:10.1055/s-1979-28602.
- ^ Allen, C. F. H.; Leubne, G. W. (1951). "Syringic Aldehyde". Organic Syntheses. 31: 92. doi:10.15227/orgsyn.031.0092.
- ^ Wiberg, K. B. (1963). "2-Thiophenaldehyde". Organic Syntheses. doi:10.15227/orgsyn.000.0000.; Collective Volume, vol. 3, p. 811
- ^ Bottini, A. T.; Dev, V.; Klinck, J. (1963). "2-Bromoallylamine". Organic Syntheses. 43: 6. doi:10.15227/orgsyn.043.0006.
- ^ Hinman, Frank (1913). "An Experimental Study of the Antiseptic Value in the Urine of the Internal Use of Hexamethylenamin". JAMA: The Journal of the American Medical Association. 61 (18): 1601. doi:10.1001/jama.1913.04350190019006.
- ^ a b c Elliot (1913). "On Urinary Antiseptics". British Medical Journal. 98: 685–686.
- ^ Heathcote, Reginald St. A. (1935). "Hexamine as an Urinary Antiseptic: I. Its Rate of Hydrolysis at Different Hydrogen Ion Concentrations. II. Its Antiseptic Power Against Various Bacteria in Urine". British Journal of Urology. 7 (1): 9–32. doi:10.1111/j.1464-410X.1935.tb11265.x. ISSN 0007-1331.
- ^ Diller, Werner F. (1980). "The methenamine misunderstanding in the therapy of phosgene poisoning (review article)". Archives of Toxicology. 46 (3–4): 199–206. doi:10.1007/BF00310435. ISSN 0340-5761. PMID 7016075. S2CID 2423812.