막전위
Membrane potential
막전위(막전위 또는 막전압)는 생체전지의 내부와 외부 사이의 전위차이다.즉, 운동 에너지를 획득하거나 방사선을 생성하지 않는 한 전하가 내부 셀 환경에서 외부 셀 환경으로 이동하는 데 필요한 에너지에는 차이가 있다.전하의 농도 구배에 따라 이 에너지 요구 사항이 직접 결정됩니다.전지 외관의 경우 일반적으로 밀리볼트 단위로 주어지고 mV로 표시되는 멤브레인 전위의 일반적인 값은 –80mV에서 –40mV 사이이다.
모든 동물 세포는 단백질이 내장된 지질 이중층으로 구성된 막에 둘러싸여 있다.막은 절연체이자 이온 이동에 대한 확산 장벽 역할을 합니다.이온수송체 또는 이온펌프 단백질로도 알려진 트랜스막 단백질은 적극적으로 이온을 막에 밀어넣고 막에 걸쳐 농도 구배를 설정하며 이온 채널은 이온이 그 농도 구배를 따라 막을 가로질러 이동하도록 합니다.이온 펌프와 이온 채널은 전기적으로 막에 삽입된 배터리 및 저항 세트와 동등하므로 막의 양쪽 사이에 전압을 생성합니다.
거의 모든 플라즈마 막은 전위를 가지고 있으며,[1] 내부는 외부와 관련하여 일반적으로 음의 전위를 가지고 있습니다.막전위에는 두 가지 기본적인 기능이 있습니다.첫째, 그것은 세포들이 배터리로 기능할 수 있게 하고,[2] 막에 내장된 다양한 "분자 소자"를 작동시킬 수 있는 전원을 제공한다.둘째, 뉴런과 근육 세포와 같은 전기적으로 흥분하기 쉬운 세포에서, 그것은 세포의 다른 부분들 사이에 신호를 전달하는데 사용된다.신호는 막의 한 지점에서 이온 채널을 열거나 닫음으로써 막 전위의 국소적인 변화를 일으킨다.이 전계의 변화는 멤브레인 내의 인접 이온 채널 또는 더 먼 이온 채널에 의해 빠르게 감지될 수 있습니다.그런 다음 이러한 이온 채널은 잠재적 변화의 결과로 열리거나 닫힐 수 있으며 신호를 재생합니다.
비흥분성 세포와 베이스라인 상태의 흥분성 세포에서 막 전위는 휴식 전위라고 불리는 비교적 안정된 값으로 유지된다.뉴런의 경우 휴지 전위는 –80 ~ –70 밀리볼트 범위로 정의됩니다. 즉, 세포 내부는 1/10 볼트의 음의 기준 전압을 가집니다.이온 채널의 개폐는 휴지 전위로부터의 이탈을 유도할 수 있다.내부 전압이 음전압(-70mV~-60mV)이 낮아지면 탈분극, 내부 전압이 음전압(-70mV~-80mV)이 되면 과분극이라고 합니다.흥분성 세포에서 충분히 큰 탈분극은 활동전위를 일으킬 수 있으며, 이 활동전위는 단시간(1~100밀리초) 동안 빠르게 현저하게 변화하며 종종 극성을 반전시킨다.활동전위는 특정 전압게이트 이온채널의 활성화에 의해 발생한다.
뉴런에서 막 전위에 영향을 미치는 인자는 다양하다.여기에는 화학적으로 게이트된 이온 채널과 전압 게이트된 이온 채널이 다수 포함되어 있습니다.전압 게이트 이온 채널은 멤브레인 전위에 의해 제어되며 멤브레인 전위 자체는 이러한 동일한 이온 채널에 의해 영향을 받기 때문에 진동 및 활동 전위와 같은 재생 이벤트를 포함한 복잡한 시간적 역학을 허용하는 피드백 루프가 발생합니다.
물리 베이스
세포 내의 막 전위는 궁극적으로 두 가지 요인, 즉 전기력과 확산으로부터 얻어진다.전기력은 전하가 반대인 입자(양전하와 음전하) 간의 상호 흡인력과 전하가 같은 입자(양전하 또는 음전하 모두) 간의 상호 반발력에서 발생합니다.확산은 입자가 고농축 지역에서 저농축 지역으로 재배포되는 통계적 경향에서 발생한다.
전압
전압은 전위의 차이에 동의어이며 저항을 가로질러 전류를 구동하는 능력입니다.실제로 전압의 가장 간단한 정의는 옴의 법칙인 V=IR(V는 전압, I는 전류, R은 저항)에 의해 제공됩니다.배터리와 같은 전압 소스가 전기 회로에 배치된 경우, 전압이 높을수록 사용 가능한 저항을 가로질러 구동되는 전류량이 증가합니다.전압의 기능적 중요성은 회로 내 두 지점 간의 전위차에만 있습니다.단일 지점의 전압에 대한 생각은 무의미합니다.전자제품에서는 임의로 선택한 회로 소자에 전압을 0으로 할당하고 그 0점에 대해 측정된 다른 소자에 전압을 할당하는 것이 일반적입니다.어떤 소자가 제로 포인트로 선택되는지는 중요하지 않습니다.회로의 기능은 전압 그 자체에 의존하지 않는 차이에만 의존합니다.그러나 대부분의 경우 및 관례상 제로 레벨은 접지와 접촉하는 회로 부분에 할당되는 경우가 많습니다.
세포생물학의 전압에도 같은 원리가 적용된다.전기활성조직에서는 예를 들어 셀 내부와 외부에 전극을 각각 삽입하고 두 전극을 본질적으로 특수 전압계인 리드에 접속함으로써 두 점 사이의 전위차를 측정할 수 있다.관례상 셀 외부에 제로 전위값을 할당하고 외부 0에 대한 내부 전위에 따라 외부와 내부의 전위차의 부호를 결정한다.
수학적 용어로 전압의 정의는 공간의 각 점에 크기와 방향을 할당하는 벡터 필드인 전계 E의 개념에서 시작됩니다.많은 상황에서, 전기장은 보수적인 필드이며, 이는 전장이 스칼라 함수의 기울기, 즉 E = V–diag로 표현될 수 있다는 것을 의미한다.이 스칼라 필드는 전압 분포라고 불립니다.이 정의에서는 임의의 적분 상수가 허용되므로 전압의 절대값이 의미가 없습니다.일반적으로 전기장은 자기장이 전기장에 큰 영향을 미치지 않는 경우에만 보수적인 것으로 취급할 수 있지만, 이 조건은 일반적으로 생체 조직에 잘 적용된다.
전계는 전압 분포의 경사이기 때문에 작은 영역 내에서 전압의 급격한 변화는 강한 전계를 의미하며, 반대로 넓은 영역에서 전압이 거의 동일하게 유지되면 해당 영역의 전계가 약해야 합니다.강한 전압 구배에 해당하는 강한 전기장은 영역 내에 존재하는 모든 하전 입자에 강한 힘이 가해진다는 것을 의미합니다.
이온과 그 움직임을 움직이는 힘

생물학적 유기체 내의 전기 신호는 일반적으로 [4]이온에 의해 구동된다.활동 전위의 가장 중요한 양이온은 나트륨(Na+)과 칼륨(K+)[5]입니다.둘 다 1개의 양전하를 전달하는 1가의 양이온입니다.활동 전위에는 칼슘(Ca2+)[6]도 포함될 수 있는데, 칼슘은 2개의 양전하를 띠는 2가 양이온입니다.염화 음이온(Cl−)은 일부 [7]조류의 활동 전위에는 중요한 역할을 하지만 대부분의 [8]동물들의 활동 전위에는 무시할 수 있는 역할을 한다.
이온은 확산과 전기장의 두 가지 영향을 받아 세포막을 통과합니다.A와 B라는 두 솔루션이 다공질 장벽에 의해 분리된 단순한 예는 확산이 최종적으로 동일한 용액으로 혼합된다는 것을 보여준다.이러한 혼합은 농도의 차이로 인해 발생합니다.농도가 높은 지역은 농도가 낮은 지역으로 확산될 것이다.예를 들어, 용액 A에 나트륨 이온 30개와 염화 이온 30개가 있다고 가정합니다.또한 용액 B에는 나트륨 이온 20개와 염화 이온 20개만 존재하게 한다.장벽이 두 종류의 이온을 통과하도록 허용한다고 가정하면, 두 용액 모두 25개의 나트륨 이온과 25개의 염화 이온을 갖는 안정된 상태에 도달하게 됩니다.그러나 다공질 장벽이 어떤 이온을 통과시키는지에 대해 선택적인 경우, 확산만으로는 결과 용액을 결정할 수 없습니다.앞의 예시로 돌아가서 나트륨 이온에만 투과하는 장벽을 구축해 봅시다.이제 나트륨만이 용액 A의 높은 농도에서 용액 B의 낮은 농도로 장벽을 가로질러 확산될 수 있습니다.따라서 용액 B의 염화 이온보다 나트륨 이온이 더 많이 축적되고 용액 A의 염화 이온보다 나트륨 이온의 수가 더 적게 축적됩니다.
즉, 음전하를 띤 염화물 이온보다 양전하를 띤 나트륨 이온의 농도가 높기 때문에 용액 B에 순양전하가 있다는 것을 의미합니다.마찬가지로, 용액 A에는 양의 나트륨 이온보다 음의 염화 이온 농도가 높기 때문에 순 음전하가 존재한다.반대되는 전하가 끌어당기고 같은 전하가 밀어내기 때문에, 이온은 이제 확산력뿐만 아니라 전기장의 영향도 받습니다.따라서, 양의 나트륨 이온은 현재 더 많은 양의 B 용액으로 이동할 가능성이 낮아지고 더 많은 양의 A 용액에 남아 있게 됩니다.전기장의 힘이 확산에 의한 힘에 완전히 대항하는 지점을 평형 퍼텐셜이라고 합니다.이 시점에서 특정 이온(이 경우 나트륨)의 순 흐름은 0입니다.
플라즈마막

모든 세포는 많은 종류의 큰 분자가 포함된 지질 이중층 구조를 가진 플라즈마 막에 둘러싸여 있다.지질 분자로 구성되어 있기 때문에 플라즈마 막은 본질적으로 높은 전기 저항률, 즉 이온에 대한 낮은 고유 투과율을 가지고 있습니다.그러나 막에 내장된 분자의 일부는 막의 한쪽에서 다른 쪽으로 이온을 능동적으로 운반하거나 이온이 [9]이동할 수 있는 채널을 제공할 수 있다.
전기용어로 플라즈마막은 저항기와 콘덴서의 결합으로 기능합니다.저항은 막이 전하의 이동을 방해하기 때문에 발생합니다.정전용량은 지질양층층이 얇아 한쪽 하전입자가 축적되면 반대쪽 하전입자가 반대쪽 하전입자를 끌어당기는 전기력이 발생한다는 점에서 발생한다.막의 캐패시턴스는 그 안에 포함된 분자의 영향을 상대적으로 받지 않기 때문에 2μF2/cm로 추정된 다소 불변한 값을 가진다(막의 전체 캐패시턴스는 면적에 비례한다).반면에 순수한 지질 이중층의 전도율은 너무 낮아서 생물학적 상황에서는 내장된 분자에 의해 제공되는 대체 경로의 전도도에 의해 항상 지배됩니다.따라서 막의 캐패시턴스는 어느 정도 고정되어 있지만 저항은 매우 가변적입니다.
플라즈마 막 두께는 약 7~8나노미터로 추정된다.막이 매우 얇기 때문에 막 안에 강한 전장을 만드는 데 매우 큰 막 통과 전압이 필요하지 않습니다.동물 세포의 일반적인 막 전위는 약 100밀리볼트(즉, 10분의 1볼트)이지만, 계산 결과 막이 유지할 수 있는 최대치에 가까운 전계가 생성됩니다. 즉, 200밀리볼트보다 훨씬 큰 전압 차이는 유전체 파괴를 일으킬 수 있는 것으로 계산되었습니다.즉, 아크입니다.막에 스며들게 됩니다.
확산 및 수송 촉진

이온의 통과에 대한 순수한 지질 이중층의 저항은 매우 높지만, 막에 내장된 구조는 촉진된 운송과 촉진된 확산이라는 메커니즘을 통해 능동적이든 수동적이든 이온의 움직임을 크게 향상시킬 수 있습니다.가장 큰 역할을 하는 두 가지 유형의 구조는 이온 채널과 이온 펌프이며, 둘 다 보통 단백질 분자의 집합으로 형성됩니다.이온 채널은 이온이 이동할 수 있는 통로를 제공합니다.대부분의 경우 이온 채널은 특정 유형의 이온에만 투과되며(예를 들어 나트륨과 칼륨, 염화나칼슘은 투과되지 않음), 때로는 이온 이동 방향에 따라 투과성이 달라집니다.이온 전달체 또는 운반 단백질로도 알려진 이온 펌프는 막의 한 쪽에서 다른 쪽으로 특정한 유형의 이온을 활발하게 운반하며, 때로는 대사 과정에서 파생된 에너지를 사용합니다.
이온 펌프
이온 펌프는 활성 운반을 수행하는 일체형 막 단백질입니다. 즉, 세포 에너지(ATP)를 사용하여 이온을 농도 [10]구배에 대해 "펌프"합니다.이러한 이온 펌프는 멤브레인 한쪽에서 이온을 흡수하여(그쪽에서 이온 농도가 감소) 다른 쪽으로 방출합니다(그쪽에서 이온 농도가 증가).
활동 전위와 가장 관련이 있는 이온 펌프는 나트륨-칼륨 펌프입니다. 나트륨-칼륨 펌프는 3개의 나트륨 이온을 세포 밖으로 운반하고 [11]2개의 칼륨 이온을 안으로 운반합니다.그 결과, 뉴런 내부의 칼륨 이온+ K의 농도는 외부 농도의 약 20배이며, 외부의 나트륨 농도는 [12][13]내부보다 약 9배 크다.비슷한 방법으로, 다른 이온들은 칼슘, 염화물,[13] 마그네슘과 같은 뉴런 내부와 외부의 다른 농도를 가지고 있다.
각 이온 유형이 같으면 나트륨-칼륨 펌프는 전기적으로 중성이지만, 3대 2 교환으로 인해 각 사이클마다 세포 내에서 세포 외로 1개의 양의 전하가 순이동하여 양의 전압차에 기여한다.펌프는 (1) 세포외 공간에서 나트륨 농도를 높게, (2) 세포외 공간에서 칼륨 농도를 낮게, (3) 세포외 공간에 대해 음전압을 부여한다.
나트륨-칼륨 펌프의 작동 속도는 비교적 느립니다.만약 세포에 나트륨과 칼륨이 같은 농도로 모든 곳에 초기화가 된다면, 펌프가 평형을 이루는데 몇 시간이 걸릴 것이다.펌프는 지속적으로 작동하지만 펌핑에 사용할 수 있는 나트륨과 칼륨의 농도가 감소함에 따라 점차 효율이 떨어집니다.
이온 펌프는 세포 내 이온 농도와 세포 외 이온 농도의 상대적 비율을 설정함으로써만 활동 전위에 영향을 미칩니다.활동 전위는 주로 이온 펌프가 아닌 이온 채널의 개폐를 포함한다.에너지원을 제거하거나 와베인과 같은 억제제를 추가하여 이온 펌프를 끄면 축삭은 여전히 수십만 개의 활동 전위를 방출할 수 있습니다.[10]특히 이온 펌프는 활동 [5]전위 후 막의 재분극에 중요한 역할을 하지 않는다.
또 다른 기능적으로 중요한 이온 펌프는 나트륨-칼슘 교환기입니다.이 펌프는 각 사이클에서 세포외+ 공간에서 3Na를 세포내 공간에서 1Ca로++ 교환한다는 점을 제외하고는 나트륨칼륨 펌프와 개념적으로 유사한 방식으로 작동한다.전하 흐름은 내부이기 때문에 이 펌프는 사실상 "다운힐"로 작동하므로 막 전압을 제외한 에너지원은 필요하지 않습니다.가장 중요한 효과는 칼슘을 외부로 내보내는 것입니다. 나트륨의 내부 흐름을 허용하여 나트륨-칼륨 펌프에 대항하지만, 전체적인 나트륨 및 칼륨 농도가 칼슘 농도보다 훨씬 높기 때문에 이 효과는 상대적으로 중요하지 않습니다.나트륨-칼슘 교환기의 최종 결과는 정지 상태에서 세포 내 칼슘 농도가 매우 낮아지는 것입니다.
이온 채널

이온 채널은 이온이 세포 외 공간과 세포 내부 사이를 이동할 수 있는 모공을 가진 일체형 막 단백질입니다.대부분의 채널은 1개의 이온에 대해 특이(선택적)합니다. 예를 들어, 대부분의 칼륨 채널은 나트륨에 대한 칼륨의 선택비율이 1000:1인 것이 특징입니다. 단, 칼륨과 나트륨 이온은 전하가 같고 반지름이 약간 다릅니다.채널 기공은 일반적으로 너무 작기 때문에 이온은 그것을 한 줄로 순서대로 [15]통과해야 합니다.채널 기공은 이온 통로를 위해 열리거나 닫힐 수 있지만, 다수의 채널이 다양한 서브 컨덕턴스 레벨을 나타냅니다.채널이 열리면 이온은 채널 구멍을 통해 특정 이온의 막 통과 농도 구배를 따라 침투합니다.채널을 통과하는 이온 흐름의 속도, 즉 단일 채널 전류 진폭은 그 이온에 대한 최대 채널 컨덕턴스와 전기화학적 구동력에 의해 결정되며, 이는 막 전위의 순간값과 반전 [16]전위의 값 사이의 차이이다.
채널은 몇 가지 다른 상태(단백질의 다른 형태에 대응)를 가질 수 있지만, 각각의 상태는 개방 또는 폐쇄입니다.일반적으로 폐쇄 상태는 모공의 수축(이온에 전달되지 않음) 또는 단백질의 분리된 부분(모공을 막음)에 해당합니다.예를 들어 전압의존성 나트륨 채널은 단백질의 일부가 모공에 들어가 [17]봉인되는 불활성화를 겪는다.이 비활성화는 나트륨 전류를 차단하고 활동 전위에 중요한 역할을 합니다.
이온 채널은 환경에 [18]어떻게 반응하는가에 따라 분류할 수 있습니다.예를 들어, 활동 전위에 관여하는 이온 채널은 전압에 민감한 채널이며, 막 전체의 전압에 따라 개폐됩니다.리간드 게이트 채널은 또 다른 중요한 클래스를 형성합니다; 이러한 이온 채널은 신경 전달 물질과 같은 리간드 분자의 결합에 반응하여 열리고 닫힙니다.다른 이온 채널은 기계적 힘으로 개폐됩니다.감각 뉴런과 같은 다른 이온 채널은 빛, 온도 또는 압력과 같은 다른 자극에 반응하여 열리고 닫힙니다.
누출 채널
누출 채널은 투과율이 다소 일정하다는 점에서 가장 단순한 유형의 이온 채널입니다.뉴런에서 가장 중요한 누출 경로의 종류는 칼륨과 염화물 채널이다.이러한 특성도 완전히 일정하지는 않습니다.첫째, 이들 중 대부분은 한쪽 방향으로 더 잘 전도한다는 점에서 전압의존적이다(즉 정류기이다). 둘째, 일부 리간드는 작동하기 위해 리간드를 필요로 하지 않더라도 화학적 리간드에 의해 차단될 수 있다.
리간드 게이트 채널
배위자 게이트 이온 채널은 단백질 구조에 화학 배위자가 결합할 때 투과성이 크게 증가하는 채널이다.동물 세포는 수천은 아니더라도 수백 가지의 이런 종류의 세포들을 가지고 있다.큰 서브셋은 신경전달물질 수용체로서 기능한다.시냅스 후 부위에서 발생하며, 시냅스 전 축삭 말단에 의해 결합되는 화학적 배위자가 방출된다.이러한 유형의 한 가지 예는 AMPA 수용체이며, AMPA 수용체는 신경전달물질 글루탐산 수용체로 활성화되면 나트륨과 칼륨 이온의 통과를 허용한다.다른 예로는 GABAA 수용체가 있는데, GABA 수용체는 신경전달물질 GABA 수용체로 활성화되면 염화물 이온의 통과가 허용된다.
신경전달물질 수용체는 세포 외 영역에 나타나는 리간드에 의해 활성화되지만, 세포 내에서의 상호작용에 의해 제어되는 다른 형태의 리간드 게이트 채널이 있다.
전압 의존형 채널
전압 의존형 이온 채널이라고도 하는 전압 개폐 이온 채널은 막 전위의 영향을 받는 채널입니다.각 구성원은 특정 이온 선택성과 특정 전압 의존성을 갖는 또 다른 매우 큰 그룹을 형성합니다.또한 많은 수가 시간에 의존합니다.즉, 전압 변화에 즉시 반응하지 않고 지연 후에만 반응합니다.
이 그룹의 가장 중요한 구성원 중 하나는 활동 전위의 기초가 되는 전압 게이트 나트륨 채널의 한 종류이다. 활동 전위의 생리학에 대한 노벨상 수상 연구에서 Alan Lloyd Hodgkin과 Andrew Huxley가 초기에 특징지었기 때문에 이러한 채널은 때때로 Hodgkin-Huxley 나트륨 채널이라고 불린다.채널은 휴지 전압 수준에서 닫히지만 전압이 특정 임계값을 초과하면 갑자기 열리며, 이로 인해 막 전위에 매우 빠른 변화를 일으키는 나트륨 이온이 대량 유입됩니다.활동전위로부터의 회복은 휴지전압레벨에서 닫히지만 활동전위 중에 발생하는 큰 전압변화의 결과로 열리는 전압게이트 칼륨채널의 종류에 따라 부분적으로 좌우된다.
반전 가능성
이온의 반전전위(또는 평형전위)는 확산력과 전기력이 평형을 이루는 막간전압값으로, 막 전체에 순이온흐름이 없다.이는 막간전압이 이온의 확산력에 정확히 반대한다는 것을 의미하기 때문에 막을 가로지르는 이온의 순전류는 0이고 변하지 않습니다.반전 전위는 이온에 투과할 수 있는 채널에 작용하는 전압을 제공하기 때문에 중요합니다. 즉, 이온 농도 구배가 배터리로 작동할 때 발생하는 전압을 제공합니다.
특정 이온의 평형 전위는 보통 E 표기로ion 지정됩니다.이온의 평형 전위는 네른스트 [19]방정식을 사용하여 계산할 수 있습니다.예를 들어 칼륨 이온의 반전 전위는 다음과 같습니다.
어디에
- E는eq,K+ 칼륨의 평형 전위이며, 볼트로 측정된다.
- R은 범용 가스 상수이며, 8−1.314줄−1·K·mol과 같다.
- T는 켈빈(= K = 섭씨 + 273) 단위로 측정한 절대 온도입니다.15)
- z는 반응과 관련된 이온의 기본 전하 수입니다.
- F는 패러데이 상수로 96,485쿨롬브/mol−1 또는 J·V−1·mol과−1 같다.
- [K+]o는 칼륨의 세포외 농도로 mol·m−3 또는 mmol·l−1 단위로 측정한다.
- [K+]i는 칼륨의 세포내 농도이다.
서로 다른 두 이온이 같은 전하(즉, K와++ Na)를 가지더라도 외부 및/또는 내부 농도가 다르다면 여전히 매우 다른 평형 전위를 가질 수 있다.예를 들어, 뉴런에 있는 칼륨과 나트륨의 평형 전위를 예로 들어보자.칼륨 평형 전위K E는 -84 mV이며, 칼륨은 외부 5 mM, 내부 140 mM이다.한편 나트륨 평형 전위 E는Na 내부에 약 12 mM, 외부에 [note 1]약 140 mM의 나트륨이 있을 때 약 +66 mV이다.
현상 중 막 전위 변화
뉴런의 휴식막 전위는 실제로 유기체의 발달 과정에서 변화한다.뉴런이 결국 완전한 성체 기능을 채택하기 위해서는, 그 잠재력이 발달하는 동안 엄격하게 조절되어야 한다.생물이 발달하면서 휴지막 전위는 더욱 [20]부정적으로 변한다.신경교세포는 또한 뇌의 발달이 진행됨에 따라 [21]분화 및 증식한다.이러한 아교세포의 첨가는 세포외 칼륨을 조절하는 유기체의 능력을 증가시킨다.세포외 칼륨의 감소는 막 전위 35mV의 [22]감소로 이어질 수 있다.
세포 흥분성
세포 흥분성은 다양한 조직의 세포 반응에 필요한 막 전위의 변화이다.세포 흥분성은 초기 색전 [23]형성 중에 유도되는 특성이다.셀의 흥분성은 응답을 [24]트리거하기 쉬운 것으로도 정의되어 있습니다.휴지 전위와 역치 전위는 세포 흥분성의 기초를 형성하며, 이러한 과정은 등급화된 전위와 활동 전위의 생성에 기초적이다.
세포 흥분성의 가장 중요한 조절 인자는 세포 외 전해질 농도(Na+, K+, Ca2+, Cl−, Mg2+)와 관련 단백질이다.세포 흥분성을 조절하는 중요한 단백질은 전압 게이트 이온 채널, 이온 전달체(예: Na+/K+-ATPase, 마그네슘 전달체, 산 베이스 전달체), 막 수용체 및 과분극 활성화 순환 뉴클레오티드 게이트 [25]채널이다.예를 들어, 칼륨 채널과 칼슘 감지 수용체는 뉴런, 심장근구 및 성세포와 [26]같은 다른 많은 흥분성 세포에서 흥분성의 중요한 조절제이다.칼슘 이온은 또한 흥분성 세포 신호 전달에서 가장 중요한 두 번째 전달자입니다.시냅스 수용체의 활성화는 신경 흥분성의 [27]장기적인 변화를 일으킨다.갑상선, 부신 및 기타 호르몬은 세포의 흥분성을 조절하는데, 예를 들어 프로게스테론과 에스트로겐은 근막 평활근 세포의 흥분성을 조절한다.
많은 종류의 세포들은 흥분성 막을 가지고 있는 것으로 여겨진다.흥분성 세포는 뉴런, 근세포(심장, 골격, 평활), 혈관내피세포, 주변세포, 병설세포, 카잘의 간질세포, 많은 종류의 상피세포(예: 베타세포, 알파세포, 델타세포, 장내분비세포, 폐신경내분비세포, 송과세포), 아교세포(성체세포)이다.세포(예: 머리카락 세포 및 메르켈 세포), 화학 수용체 세포(예: 글로머스 세포, 미각 수용체), 일부 식물 세포 및 가능한 면역 세포.[28]성상세포는 시냅스 신호를 검출할 수 있는 여러 수용체의 발현과 관련된 세포 내 칼슘 변화에 기초한 비전기적 흥분성의 형태를 나타낸다.뉴런에서는 세포의 일부 부분에 다른 막 특성이 있는데, 예를 들어 수지상 흥분성은 공간적으로 분리된 [29]입력의 일치 검출 능력을 가진 뉴런을 가능하게 한다.
등가 회로
전기생리학자는 이온 농도 차이, 이온 채널 및 멤브레인 캐패시턴스의 영향을 등가 회로의 관점에서 모델링합니다.이것은 작은 멤브레인 패치의 전기적 특성을 나타내기 위한 것입니다.등가 회로는 각각 가변 전도성을 가진 직렬 배터리로 구성된 4개의 경로와 병렬로 된 콘덴서로 구성됩니다.커패시턴스는 지질 이중층의 특성에 따라 결정되며 고정되는 것으로 간주됩니다.네 개의 평행 경로 각각은 주요 이온, 나트륨, 칼륨, 염화물, 칼슘 중 하나에서 나옵니다.각 이온 경로의 전압은 막의 각 측면에 있는 이온 농도에 의해 결정됩니다. 위의 반전 전위 섹션을 참조하십시오.임의의 시점에서 각 이온 경로의 컨덕턴스는 누출 채널, 리간드 게이트 채널 및 전압 게이트 이온 채널을 포함하여 해당 이온에 잠재적으로 투과 가능한 모든 이온 채널의 상태에 의해 결정됩니다.

고정 이온 농도 및 이온 채널 컨덕턴스의 고정치에 대해서는, 이하와 같은 골드만 방정식을 이용해, 배터리 및 컨덕턴스와 병렬로 캐패시턴스를 포함한 회로에 대해서, 등가 회로를 한층 더 저감 할 수 있다.전기적 측면에서 이것은 일종의 RC 회로(저항-용량 회로)이며 전기적 특성은 매우 단순합니다.초기 상태에서 시작하여 전도성 또는 캐패시턴스를 통과하는 전류는 δ = RC의 시간 상수로 감소합니다. 여기서 C는 멤브레인 패치의 캐패시턴스이고 R = 1/g은net 순 저항입니다.실제 상황에서 시간 상수는 보통 1 ~100 밀리초 범위에 있습니다.대부분의 경우 이온 채널의 컨덕턴스 변화는 더 빠른 시간 척도로 발생하기 때문에 RC 회로는 좋은 근사치가 아닙니다.그러나 멤브레인 패치를 모델링하기 위해 사용되는 미분 방정식은 일반적으로 RC 회로 방정식의 수정 버전입니다.
휴식 전위
세포의 막전위가 큰 변화 없이 장기간 지속되는 것을 정지전위 또는 정지전압이라고 한다.이 용어는 비 들뜸성 세포의 막 전위뿐만 아니라 들뜸이 없는 경우의 들뜸성 세포의 막 전위에도 사용된다.흥분성 세포에서 다른 가능한 상태는 등급화된 막 전위(가변 진폭의)와 활동 전위(action potentials)로 보통 일정한 시간 경로를 따르는 막 전위가 크게 상승하거나 전혀 상승하지 않습니다.흥분하기 쉬운 세포는 신경세포, 근육세포, 그리고 분비선의 분비세포를 포함한다.그러나 다른 유형의 세포에서도 막전압은 환경적 또는 세포내 자극에 반응하여 변화할 수 있다.예를 들어, 혈장막의 탈분극은 프로그램된 [30]세포사망에서 중요한 단계로 보인다.
휴식 전위를 생성하는 상호작용은 골드만 [31]방정식으로 모델링됩니다.이는 위의 네른스트 방정식과 형태가 유사하며, 이온의 전하와 내부 및 외부 농도 차이를 기반으로 한다.단, 각 이온에 대한 혈장막의 상대적 투과성도 고려합니다.
이 식에서 나타나는 이온은 칼륨(K+), 나트륨(Na+), 염화물(Cl−)이다.칼슘은 생략되지만 중요한 역할을 [32]하는 상황에 대처하기 위해 첨가될 수 있다.음이온이기 때문에 염화물 항은 양이온 항과 다르게 취급되며, 세포 내 농도는 분자에 있고, 분모 내 세포 외 농도는 양이온 항과 반대이다.P는i 이온 타입 i의 상대적인 투과성을 나타낸다.
본질적으로 골드만식은 막전위를 투과성에 의해 가중된 개별 이온형 반전전위의 가중평균으로 나타낸다.(막전위는 활동전위 중 약 100mV 변화하지만 세포 내외 이온농도는 크게 변화하지 않는다.)그들은 막이 정지 전위에 있을 때 각각의 농도에 근접해 있다.)대부분의 동물 세포에서 칼륨에 대한 투과성은 나트륨에 대한 투과성보다 정지 상태에서 훨씬 더 높다.그 결과 정지 전위는 보통 칼륨 반전 [33][34]전위에 가깝다.염화물에 대한 투과성은 유의할 정도로 높을 수 있지만, 다른 이온과 달리 염화물은 활발하게 펌핑되지 않기 때문에 다른 이온에 의해 결정되는 정지 전위에 매우 가까운 반전 전위로 평형화된다.
대부분의 동물 세포에서 휴식막 전위의 값은 일반적으로 칼륨 반전 전위(대개 -80mV)와 약 -40mV 사이에서 변화한다.(활동 전위를 생성할 수 있는) 흥분성 셀의 휴지 전위는 보통 -60mV에 가깝다. 탈분극 전압이 증가하면 활동 전위가 자발적으로 생성된다.미성숙 세포 또는 미분화 세포는 일반적으로 분화 [35]세포보다 훨씬 더 많은 양의 휴지 전압의 매우 가변적인 값을 나타낸다.이러한 셀에서 휴지 전위값은 분화의 정도와 상관된다.분화되지 않은 셀은 어떤 경우에는 전혀 막간전압차를 보이지 않을 수 있다.
누출 채널로 인한 손실을 상쇄하기 위해 이온의 능동적인 펌핑이 필요하기 때문에 휴지 전위의 유지에는 대사 비용이 들 수 있습니다.셀 기능이 특히 탈분극된 멤브레인 전압 값을 필요로 할 때 비용이 가장 높습니다.예를 들어, 일광 적응 블로우플라이(Calliphora vicina) 광수용체의 휴지 전위는 -30 mV까지 [36]높을 수 있습니다.이 높아진 막 전위는 세포가 시각 입력에 매우 빠르게 반응할 수 있게 한다; 비용은 휴식 전위의 유지에 전체 세포 [37]ATP의 20% 이상을 소비할 수 있다는 것이다.
한편, 미분화 세포의 높은 휴지 잠재력이 반드시 높은 대사 비용을 발생시키는 것은 아니다.이 명백한 역설은 휴식 전위의 기원을 조사함으로써 해결된다.거의 구별되지 않은 셀은 매우 높은 입력 [35]저항으로 특징지어지는데, 이는 셀 수명의 이 단계에서 누출 채널이 거의 존재하지 않음을 의미합니다.그 결과 칼륨 투과율은 앞에서 설명한 바와 같이 나트륨과 칼륨의 반전 전위 사이에 휴지 전위를 두는 나트륨 이온과 유사해진다.또한 누출 전류가 감소함에 따라 이를 보상하기 위해 능동 펌핑이 거의 필요하지 않으므로 대사 비용이 절감됩니다.
평가된 잠재력
앞에서 설명한 바와 같이 세포막의 전위는 세포내 영역과 세포외 영역의 이온 농도 차이 및 각 이온 유형에 대한 막의 투과성에 의해 결정된다.이온 농도는 일반적으로 매우 빠르게 변화하지 않지만(기선 세포 내 농도가 너무 낮아서 작은 유입량도 크기만큼 증가할 수 있음2+), 리간드 게이트 이온 채널의 활성화의 결과로 이온의 투과성은 밀리초 단위로 변화할 수 있다.막 전위의 변화는 활성화되는 이온 채널의 수와 유형에 따라 크거나 작을 수 있으며 채널이 열린 상태로 유지되는 시간에 따라 길거나 짧을 수 있습니다.이 유형의 변화는 일정한 진폭과 시간 경로를 갖는 활동 전위와 대조적으로 등급화된 전위라고 합니다.
위의 골드만 방정식에서 도출할 수 있듯이, 특정 유형의 이온에 대한 막의 투과성을 높이는 효과는 막 전위를 해당 이온에 대한 반전 전위로 이동시킨다.따라서 Na 채널을 열면+ 막 전위가 Na 반전+ 전위로 이동하며, 이는 보통 +100mV 정도이다.마찬가지로 K채널을 열면+ 막전위가 약 -90mV로 이동하고 Cl채널을 열면− 약 -70mV(대부분 막의 정지전위)로 이동한다.따라서 Na채널은+ 막전위를 양의 방향으로 이동시키고+ K채널은 막전위를 음의 방향으로 이동시키며−(막전위가 K반전위보다+ 음의 값으로 과분극되는 경우는 제외), Cl채널은 막전위를 휴지전위로 이동하는 경향이 있다.
등급화된 막 전위는 시냅스에 의해 생성되는 뉴런에서 특히 중요합니다. 즉, 단일 등급화된 시냅스의 활성화에 의해 생성된 막 전위의 일시적인 변화를 시냅스 후 전위라고 합니다.Na 채널을 여는+ 역할을 하는 신경전달물질은 일반적으로 막 전위가 더 양성이 되도록 하는 반면, K 채널을+ 활성화하는 신경전달물질은 전형적으로 더 음성이 되도록 한다; 이러한 채널을 억제하는 신경전달물질은 반대 효과를 갖는 경향이 있다.
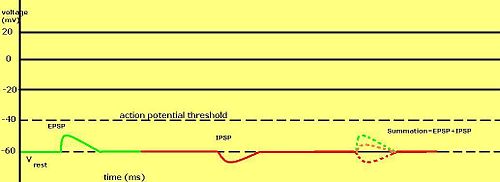
시냅스 후 전위가 흥분성 또는 억제성으로 간주되는지 여부는 해당 전류의 이온에 대한 반전 전위와 세포가 활동 전위를 발사하는 역치에 따라 달라진다(약 –50mV).전형적인+ Na 전류와 같이 역치 이상의 반전 전위를 가진 시냅스 후 전류는 흥분성 전류로 간주된다.일반적인+ K 전류와 같이 역치 미만의 반전 전위를 가진 전류는 억제성 전류로 간주된다.반전 전위가 휴지 전위보다 크지만 역치 이하인 전류는 그 자체로 활동 전위를 유도하는 것이 아니라 역치 이하의 막 전위 진동을 일으킨다.따라서 Na 채널을 여는+ 역할을 하는 신경전달물질은 흥분성 시냅스 후 전위(EPSP)를 생성하는 반면 K 또는− Cl 채널을 여는+ 역할을 하는 신경전달물질은 일반적으로 억제성 시냅스 후 전위(IPSP)를 생성한다.같은 시간 내에 여러 유형의 채널이 열려 있는 경우, 그 채널들의 시냅스 후 전위는 합계됩니다(더해져 있습니다).
기타 값
생물물리학의 관점에서 휴식막 전위는 세포가 휴식할 때 우세한 막 투과성으로부터 발생하는 막 전위일 뿐이다.위의 가중 평균 방정식이 항상 적용되지만 다음과 같은 접근방식은 더 쉽게 시각화될 수 있다.어느 순간에도 이온이 세포막 전위에 미치는 영향을 결정하는 두 가지 요인이 있습니다.
- 그 이온의 원동력은
- 그 이온의 투과성은
구동력이 높으면 이온이 막에 "밀려" 있는 것입니다.투과율이 높으면 이온이 막 전체에 퍼지기 쉬워진다.
- 구동력은 이온을 막을 가로질러 이동시키는 데 사용할 수 있는 순 전기력입니다.이 값은 이온이 "원하는" 전압(평형 전위)과 실제 막 전위(Em) 사이의 차이로 계산됩니다.따라서, 공식 용어로 이온의 원동력은m = E - E입니다ion.
- 예를 들어, 이전에 계산한 휴지 전위 -73mV에서 칼륨에 대한 구동력은 7mV :(-73mV) -(-80mV) = 7mV입니다.나트륨의 구동력은 (-73mV) - (60mV) = -160mV입니다.
- 투과성은 이온이 얼마나 쉽게 막을 통과할 수 있는지를 나타내는 척도이다.일반적으로 (전기) 전도도로 측정되며, 단위인 지멘스는 1C·s−1−1·V에 해당하며, 이는 전위 볼트당 초당 1쿨롱입니다.
즉, 휴지막에서는 칼륨의 추진력은 낮은 반면 투과성은 매우 높습니다.나트륨은 큰 추진력을 가지고 있지만 휴면 투과성은 거의 없다.이 경우 칼륨은 나트륨보다 약 20배 더 많은 전류를 전달하므로 나트륨보다 E에 20배m 더 많은 영향을 미칩니다.
그러나 다른 경우, 즉 실행 가능성의 피크에 대해 생각해 보십시오.여기서 Na에 대한 투과율은 높고 K투과율은 비교적 낮다.따라서 막은 E 근처와Na E에서 멀리K 이동한다.
이온이 더 많이 투과될수록 막 전위를 예측하는 것이 더 복잡해진다.그러나 이것은 Goldman-Hodgkin-Katz 방정식 또는 가중 평균 방정식을 사용하여 수행할 수 있습니다.이온의 농도 구배와 투과율을 언제든지 꽂으면 그 순간의 막전위를 결정할 수 있다.GHK 방정식이 의미하는 것은 막 전위의 값이 언제든지 모든 투과성 이온의 평형 전위의 가중 평균이 된다는 것입니다."무게 부여"는 막을 가로지르는 이온의 상대적인 투과율입니다.
효과와 시사점
세포는 이온을 운반하고 막 통과 전위를 확립하기 위해 에너지를 소비하는 반면, 그들은 이 전위를 설탕과 같은 다른 이온과 대사물을 운반하는 데 사용한다.미토콘드리아의 막 통과 전위는 생물학적 에너지의 공통 통화인 ATP의 생산을 촉진합니다.
세포는 활동 전위나 다른 형태의 들뜸을 일으키기 위해 휴식 전위에 저장된 에너지를 사용할 수 있다.막 전위의 이러한 변화는 다른 세포들과 통신할 수 있게 하거나 세포 내부의 변화를 시작하는데, 이것은 정자에 의해 수정될 때 난자에서 일어납니다.
신경 세포에서 활동 전위는 나트륨 이온이 나트륨 채널을 통해 세포로 밀려드는 것으로 시작하여 탈분극화를 초래하는 반면, 회복은 칼륨 채널을 통해 칼륨이 바깥쪽으로 밀려오는 것을 포함합니다.이 두 가지 플럭스는 모두 수동 확산에 의해 발생합니다.
「 」를 참조해 주세요.
메모들
- ^ E와NaK E의 부호는 반대입니다.이는 칼륨의 농도 구배는 세포 밖으로 향하고 나트륨의 농도 구배는 세포 안으로 향하기 때문이다.막 전위는 셀의 외부를 기준으로 정의되므로 -70mV의 전위는 셀 내부가 외부를 기준으로 음의 전위를 나타냅니다.
레퍼런스
- ^ Bruce, Alberts (2014-11-18). Molecular biology of the cell (Sixth ed.). New York, NY. ISBN 9780815344322. OCLC 887605755.
- ^ Abdul Kadir, Lina; Stacey, Michael; Barrett-Jolley, Richard (2018). "Emerging Roles of the Membrane Potential: Action Beyond the Action Potential". Frontiers in Physiology. 9. doi:10.3389/fphys.2018.01661. ISSN 1664-042X. PMID 30519193.
- ^ 캠벨 생물학, 제6판
- ^ 존스턴과 우, 9페이지
- ^ a b 블록, 오칸드, 그리넬, 140-41페이지.
- ^ 블록, 오칸드, 그리넬, 페이지 153-54.
- ^ Mummert H, Gradmann D (1991). "Action potentials in Acetabularia: measurement and simulation of voltage-gated fluxes". Journal of Membrane Biology. 124 (3): 265–73. doi:10.1007/BF01994359. PMID 1664861. S2CID 22063907.
- ^ 슈미트 닐슨, 페이지 483
- ^ Lieb WR, Stein WD (1986). "Chapter 2. Simple Diffusion across the Membrane Barrier". Transport and Diffusion across Cell Membranes. San Diego: Academic Press. pp. 69–112. ISBN 978-0-12-664661-0.
- ^ a b Hodgkin AL, Keynes RD (1955). "Active transport of cations in giant axons from Sepia and Loligo". J. Physiol. 128 (1): 28–60. doi:10.1113/jphysiol.1955.sp005290. PMC 1365754. PMID 14368574.
- ^ Caldwell PC, Hodgkin AL, Keynes RD, Shaw TI (1960). "The effects of injecting energy-rich phosphate compounds on the active transport of ions in the giant axons of Loligo". J. Physiol. 152 (3): 561–90. doi:10.1113/jphysiol.1960.sp006509. PMC 1363339. PMID 13806926.
- ^ Steinbach HB, Spiegelman S (1943). "The sodium and potassium balance in squid nerve axoplasm". J. Cell. Comp. Physiol. 22 (2): 187–96. doi:10.1002/jcp.1030220209.
- ^ a b Hodgkin AL (1951). "The ionic basis of electrical activity in nerve and muscle". Biol. Rev. 26 (4): 339–409. doi:10.1111/j.1469-185X.1951.tb01204.x. S2CID 86282580.
- ^ CRC 화학 및 물리 핸드북, 83판, ISBN 0-8493-0483-0, 페이지 12-14~12-16.
- ^ Eisenman G (1961). "On the elementary atomic origin of equilibrium ionic specificity". In A Kleinzeller; A Kotyk (eds.). Symposium on Membrane Transport and Metabolism. New York: Academic Press. pp. 163–79.Eisenman G (1965). "Some elementary factors involved in specific ion permeation". Proc. 23rd Int. Congr. Physiol. Sci., Tokyo. Amsterdam: Excerta Med. Found. pp. 489–506.
* Diamond JM, Wright EM (1969). "Biological membranes: the physical basis of ion and nonekectrolyte selectivity". Annual Review of Physiology. 31: 581–646. doi:10.1146/annurev.ph.31.030169.003053. PMID 4885777. - ^ Junge, 페이지 33-37
- ^ Cai SQ, Li W, Sesti F (2007). "Multiple modes of a-type potassium current regulation". Curr. Pharm. Des. 13 (31): 3178–84. doi:10.2174/138161207782341286. PMID 18045167.
- ^ Goldin AL (2007). "Neuronal Channels and Receptors". In Waxman SG (ed.). Molecular Neurology. Burlington, MA: Elsevier Academic Press. pp. 43–58. ISBN 978-0-12-369509-3.
- ^ Purves et al., 페이지 28–32; Block, Orkand, Greennell, 페이지 133–134; Schmidt-Nielsen, 페이지 478–480, 596–597; Jungge, 페이지 33–35
- ^ Sanes, Dan H.; Takács, Catherine (1993-06-01). "Activity-dependent Refinement of Inhibitory Connections". European Journal of Neuroscience. 5 (6): 570–574. doi:10.1111/j.1460-9568.1993.tb00522.x. ISSN 1460-9568. PMID 8261131. S2CID 30714579.
- ^ KOFUJI, P.; NEWMAN, E. A. (2004-01-01). "Potassium buffering in the central nervous system". Neuroscience. 129 (4): 1045–1056. doi:10.1016/j.neuroscience.2004.06.008. ISSN 0306-4522. PMC 2322935. PMID 15561419.
- ^ Sanes, Dan H.; Reh, Thomas A (2012-01-01). Development of the nervous system (Third ed.). Elsevier Academic Press. pp. 211–214. ISBN 9780080923208. OCLC 762720374.
- ^ Tosti, Elisabetta (2010-06-28). "Dynamic roles of ion currents in early development". Molecular Reproduction and Development. 77 (10): 856–867. doi:10.1002/mrd.21215. ISSN 1040-452X. PMID 20586098. S2CID 38314187.
- ^ Boyet, M.R.; Jewell, B.R. (1981). "Analysis of the effects of changes in rate and rhythm upon electrical activity in the heart". Progress in Biophysics and Molecular Biology. 36 (1): 1–52. doi:10.1016/0079-6107(81)90003-1. ISSN 0079-6107. PMID 7001542.
- ^ Spinelli, Valentina; Sartiani, Laura; Mugelli, Alessandro; Romanelli, Maria Novella; Cerbai, Elisabetta (2018). "Hyperpolarization-activated cyclic-nucleotide-gated channels: pathophysiological, developmental, and pharmacological insights into their function in cellular excitability". Canadian Journal of Physiology and Pharmacology. 96 (10): 977–984. doi:10.1139/cjpp-2018-0115. hdl:1807/90084. ISSN 0008-4212. PMID 29969572.
- ^ Jones, Brian L.; Smith, Stephen M. (2016-03-30). "Calcium-Sensing Receptor: A Key Target for Extracellular Calcium Signaling in Neurons". Frontiers in Physiology. 7: 116. doi:10.3389/fphys.2016.00116. ISSN 1664-042X. PMC 4811949. PMID 27065884.
- ^ Debanne, Dominique; Inglebert, Yanis; Russier, Michaël (2019). "Plasticity of intrinsic neuronal excitability" (PDF). Current Opinion in Neurobiology. 54: 73–82. doi:10.1016/j.conb.2018.09.001. PMID 30243042. S2CID 52812190.
- ^ Davenport, Bennett; Li, Yuan; Heizer, Justin W.; Schmitz, Carsten; Perraud, Anne-Laure (2015-07-23). "Signature Channels of Excitability no More: L-Type Channels in Immune Cells". Frontiers in Immunology. 6: 375. doi:10.3389/fimmu.2015.00375. ISSN 1664-3224. PMC 4512153. PMID 26257741.
- ^ Sakmann, Bert (2017-04-21). "From single cells and single columns to cortical networks: dendritic excitability, coincidence detection and synaptic transmission in brain slices and brains". Experimental Physiology. 102 (5): 489–521. doi:10.1113/ep085776. ISSN 0958-0670. PMC 5435930. PMID 28139019.
- ^ Franco R, Bortner CD, Cidlowski JA (January 2006). "Potential roles of electrogenic ion transport and plasma membrane depolarization in apoptosis". J. Membr. Biol. 209 (1): 43–58. doi:10.1007/s00232-005-0837-5. PMID 16685600. S2CID 849895.
- ^ Purves et al., 32–33; Block, Orkand, Greennell, 138–140; Schmidt-Nielsen, 480; Jungge, 35–37.
- ^ Spangler SG (1972). "Expansion of the constant field equation to include both divalent and monovalent ions". Alabama Journal of Medical Sciences. 9 (2): 218–23. PMID 5045041.
- ^ Purves et al., 페이지 34; Block, Orkand, Greennell, 페이지 134; Schmidt-Nielsen, 페이지 478–480.
- ^ Purves et al., 페이지 33–36; Block, Orkand, Greennell, 페이지 131.
- ^ a b Magnuson DS, Morassutti DJ, Staines WA, McBurney MW, Marshall KC (Jan 14, 1995). "In vivo electrophysiological maturation of neurons derived from a multipotent precursor (embryonal carcinoma) cell line". Developmental Brain Research. 84 (1): 130–41. doi:10.1016/0165-3806(94)00166-W. PMID 7720212.
- ^ Juusola M, Kouvalainen E, Järvilehto M, Weckström M (Sep 1994). "Contrast gain, signal-to-noise ratio, and linearity in light-adapted blowfly photoreceptors". J Gen Physiol. 104 (3): 593–621. doi:10.1085/jgp.104.3.593. PMC 2229225. PMID 7807062.
- ^ Laughlin SB, de Ruyter van Steveninck RR, Anderson JC (May 1998). "The metabolic cost of neural information". Nat. Neurosci. 1 (1): 36–41. doi:10.1038/236. PMID 10195106. S2CID 204995437.
추가 정보
- 알베르트 외세포의 분자생물학.Garland Publishing; 제4회 Bk&Cdr판(2002년 3월).ISBN 0-8153-3218-1.학부 레벨.
- 가이튼, 아서 C, 존 E.홀, 의학 생리학 교과서예요W.B. 손더스 컴퍼니, 제10호(2000년 8월 15일).ISBN 0-7216-8677-X.학부 레벨.
- Hille, B이오니아식 채널 Excitable 세포막의 변화 Sinauer 어소시에이츠의 선더랜드, MA, 미국, 1판, 1984년.아이 에스비엔 0-87893-322-0
- Nicholls, J.G. 마틴은 A와 월리스, 비지 신경 세포 뇌 Sinauer 협회까지, Inc.선덜랜드, MA, 미국 3편, 1992년.아이 에스비엔 0-87893-580-0
- Ove-Sten 크누센.생물학적 Membranes:교통, 센서스와 전기 Impulses의 이론.캠브리지 대학 출판소(9월 26일 2002년).아이 에스비엔 0-521-81018-3.대학원 수준이다.
- 국립 의료 시리즈 독립 연구소.생리학.Lippincott 윌리엄스&윌킨스.필라델피아, 펜실베니아 주 미국 4판, 2001년.ISBN 0-683-30603-0
외부 링크
- 세포막의 기능
- Nernst/Goldman 방정식 시뮬레이터
- 네른스트 방정식 계산기
- Goldman-Hodgkin-Katz 방정식
- 전기화학적 구동력 계산기
- 휴식막 전위의 기원 - 온라인 인터랙티브 튜토리얼 (플래시)




![E_{eq,K^+} = \frac{RT}{zF} \ln \frac{[K^+]_{o}}{[K^+]_{i}} ,](https://wikimedia.org/api/rest_v1/media/math/render/svg/b7eb1afcc5d7a5032ff24be5c403b43b1307b01e)

![E_{m} = \frac{RT}{F} \ln{ \left( \frac{ P_{\mathrm{K}}[\mathrm{K}^{+}]_\mathrm{out} + P_{\mathrm{Na}}[\mathrm{Na}^{+}]_\mathrm{out} + P_{\mathrm{Cl}}[\mathrm{Cl}^{-}]_\mathrm{in}}{ P_{\mathrm{K}}[\mathrm{K}^{+}]_\mathrm{in} + P_{\mathrm{Na}}[\mathrm{Na}^{+}]_\mathrm{in} + P_{\mathrm{Cl}}[\mathrm{Cl}^{-}]_\mathrm{out}} \right) }](https://wikimedia.org/api/rest_v1/media/math/render/svg/4b29151571b6fb807674bf342d01f178908a1a98)