전기 시냅스
Electrical synapse| 전기 시냅스 | |
|---|---|
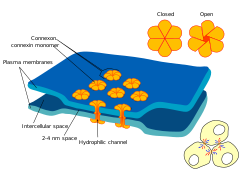 갭 접점 다이어그램 | |
| 식별자 | |
| 메슈 | D054351 |
| TH | H1.00.01.1.02024 |
| FMA | 67130 |
| 해부학적 용어 | |
전기 시냅스(Electrical Synapse)는 갭 접점이라고 알려진 시냅스 이전 뉴런과 후기 뉴런 사이의 좁은 틈새에서 형성되는 두 이웃한 뉴런 사이의 기계적, 전기적으로 전도성 연결이다. 간격 접점에서 그러한 세포는 화학 시냅스에서 세포를 분리하는 20~40나노미터 거리보다 훨씬 짧은 약 3.8nm 이내에 접근한다.[1][2] 많은[specify] 동물에서 전기 시냅스 기반 시스템은 화학 시냅스와 공존한다.
화학 시냅스에 비해 전기 시냅스는 신경 자극을 더 빨리 수행하지만 화학 시냅스와 달리 이득이 부족하다. 시냅스 후 뉴런의 신호는 원래 뉴런과 같거나 작다. 전기 시냅스를 지각하는 근본적인 기초는 두 뉴런 사이의 갭 접합부에 위치한 커넥넥슨으로 내려온다. 전기 시냅스는 방어 반사 작용과 같이 가능한 한 가장 빠른 반응이 필요한 신경 계통에서 발견되는 경우가 많다. 전기 시냅스의 중요한 특징은 대부분 양방향(양방향의 임펄스 전송 허용)이라는 점이다.[3][4]
구조
각 갭 접속점(일명 넥서스 접속점)은 두 세포의 플라즈마 막을 가로지르는 수많은 갭 접속 채널을 포함하고 있다.[5] 루멘 직경이 약 1.2~2.0nm인 갭 접합 채널의 모공은 이온과 신호 분자와 같은 중형 분자가 한 세포에서 다음 세포로 흐를 수 있을 정도로 넓어 두 세포의 세포질을 연결한다.[2][6][2][7] 따라서 한 세포의 멤브레인 전위가 변화할 때, 이온은 한 세포에서 다음 세포로 이동하여 양전하를 운반하고 시냅스 후 세포를 탈분극화할 수 있다.
갭 접합 깔때기는 척추동물의 코넥슨이라고 불리는 두 개의 헤미 채널로 구성되는데, 시냅스의 각 세포가 한 채널을 기여한다.[2][6][8] 코넥슨은 코넥신이라고 불리는 길이 7.5nm의 4패스 멤브레인 스패닝 단백질 서브유닛 6개로 형성되는데, 코넥신은 서로 동일하거나 약간 다를 수 있다.[6]
자동증식이란 하나의 뉴런의 축이 자신의 덴드라이트와 시냅스할 때 형성되는 전기적(또는 화학적) 시냅스를 말한다.
영향들
뚜렷한 소수지만 시상하부와 같은 인체 내 특정 지역에서 발견된다. 전기 시냅스의 단순성으로 인해 시냅스는 빠르지만 더 복잡한 화학 시냅스에 비해 단순한 동작만 만들어낼 수 있다.[9]
- 수용체가 화학적 메신저를 인식할 필요가 없다면, 전기 시냅스에서의 신호 전달은 뉴런들 사이의 주요 결합 종류인 화학 시냅스 간에 일어나는 것보다 더 빠르다. 화학적 전송은 시냅스 지연을 나타낸다. 즉, 개구리의 오징어 시냅스와 신경근접합에서 기록된 기록은 0.5~4.0밀리초의 지연을 나타낸다. 이때 전기 전송은 거의 지체 없이 일어난다. 그러나, 화학 시냅스와 전기 시냅스의 속도 차이는 포유류에서처럼 냉혈동물에서 두드러지지는 않는다.[6]
- 전기 시냅스는 신경전달물질을 수반하지 않기 때문에 전기 신경전달은 화학적 신경전달보다 수정이 덜 된다.
- 반응은 항상 소스와 같은 부호다. 예를 들어 사전합성막의 탈극화는 항상 사후합성막에서 탈극화를 유도하며, 그 반대의 경우 초극화를 유도한다.
- 시냅스 후 뉴런의 반응은 일반적으로 소스보다 진폭이 작다. 신호의 감쇠량은 전시냅스 뉴런과 후시냅스 뉴런의 막 저항력 때문이다.
- 전기 시냅스에서 장기적인 변화를 볼 수 있다. 예를 들어, 망막의 전기 시냅스의 변화는 망막의 빛과 어둠의 적응 동안에 나타난다.[10]
전기 시냅스의 상대적인 속도는 또한 많은 뉴런들이 동시에 발화하도록 한다.[5][6][11] 전송 속도 때문에 탈출 메커니즘이나 바다 토끼 아플리시아의 위험에 대한 대응 등 빠른 대응이 필요한 다른 프로세스에서 전기 시냅스가 발견되는데, 이는 적들의 시야를 흐리게 하기 위해 많은 양의 잉크를 빠르게 방출한다.[1]
일반적으로 이온에 의해 전달되는 전류는 이러한 유형의 시냅스를 통해 어느 방향으로든 이동할 수 있다.[2] 그러나 때때로 접합부는 액손의 혈장막의 탈극화에 대응하여 개방되는 전압 게이트 이온 채널을 포함하고,[2] 전류가 두 방향 중 하나로 이동하는 것을 방지하는 시냅스를 정류하고 있다.[11] 칼슘(Ca)이나2+
수소(H+
) 이온 농도의 증가에 대응하여 닫히는 채널도 있어 한 세포에서 다른 세포로 피해가 확산되지 않도록 할 수 있다.[11]
이러한 시냅스들 중 일부에서 "플라스틱성(plasticity)"에 대한 증거도 있다. 즉, 시냅스가 설정하는 전기적 연결은 활동 또는 [12]마그네슘 세포내 농도의 변화 동안에 강화되거나 약화될 수 있다는 것이다.[13]
전기 시냅스는 중추신경계 전반에 걸쳐 존재하며 특히 신피질, 해마, 탈라믹 망막핵, 로쿠스 코에룰루스, 하열 올리브핵, 삼차신경 중뇌핵, 후각구, 망막, 척추동물의 척수 등에서 연구되어 왔다.[14] 체내에서 검출된 기능적 갭 접합의 다른 예는 선조체, 소뇌 및 초경련핵에 있다.[15][16]
역사
직접 연결된 세포들의 망막의 모델은 20세기 초 신경계의 구성을 위한 초기 가설의 하나였다. 이 망막 가설은 현재 지배적인 뉴런 교리와 직접적으로 충돌하는 것으로 간주되었는데, 이는 격리된 개별 뉴런들이 시냅스 틈새에 걸쳐 화학적으로 서로 신호를 보내는 모델이다. 이 두 모델은 1906년 노벨 생리의학상 수상식에서 첨예한 대조를 이루었는데, 이 상은 망상학자로 널리 인정받는 세포생물학자 카밀로 골기와 뉴런 교리의 챔피언이자 현대 신경과학의 아버지인 산티아고 라몬 이 카잘에게 공동으로 수여되었다. 골기는 먼저 그의 노벨상 강의를 했고, 부분적으로는 신경계의 망상 모델을 위한 증거들을 상세히 설명했다. 이어 라몬 이 카잘이 단상에 올라 골기의 결론을 강의에서 반박했다. 그러나 화학 시냅스와 전기 시냅스의 공존에 대한 현대적인 이해는 두 모델 모두 생리학적으로 의미가 있다는 것을 시사한다; 노벨 위원회가 공동으로 상을 수여하는 데 큰 선견지명을 가지고 행동했다고 말할 수 있다.
뉴런들 사이의 정보 전달이 20세기 초에는 화학적이었는지 전기적이었는지에 대한 실질적인 논쟁이 있었지만, 화학 시냅스 전달은 오토 뢰위의 뉴런과 심장 근육 사이의 화학적 의사소통을 실증한 이후 유일한 해답으로 여겨졌다. 따라서 전기통신의 발견은 놀라운 일이었다.
전기 시냅스는 1950년대 후반 가재의 탈출 관련 거대 뉴런 사이에서 처음 시연되었고, 이후 척추동물에서 발견되었다.[3]
참고 항목
참조
- ^ a b Kandel, ER; Schwartz, JH; Jessell, TM (2000). Principles of Neural Science (4th ed.). New York: McGraw-Hill. ISBN 978-0-8385-7701-1.
- ^ a b c d e f Hormuzdi SG, Filippov MA, Mitropoulou G, Monyer H, Bruzzone R (March 2004). "Electrical synapses: a dynamic signaling system that shapes the activity of neuronal networks". Biochim. Biophys. Acta. 1662 (1–2): 113–37. doi:10.1016/j.bbamem.2003.10.023. PMID 15033583.
- ^ a b Purves, Dale; George J. Augustine; David Fitzpatrick; William C. Hall; Anthony-Samuel LaMantia; James O. McNamara & Leonard E. White (2008). Neuroscience (4th ed.). Sinauer Associates. pp. 85–88. ISBN 978-0-87893-697-7.
- ^ Purves, Dale; George J. Augustine; David Fitzpatrick; William C. Hall; Anthony-Samuel LaMantia; Richard D. Mooney; Leonard E. White & Michael L. Platt (2018). Neuroscience (6th ed.). Oxford University Press. pp. 86–87. ISBN 978-1605353807.
- ^ a b Gibson JR, Beierlein M, Connors BW (January 2005). "Functional properties of electrical synapses between inhibitory interneurons of neocortical layer 4". J. Neurophysiol. 93 (1): 467–80. doi:10.1152/jn.00520.2004. PMID 15317837.
- ^ a b c d e Bennett MV, Zukin RS (February 2004). "Electrical coupling and neuronal synchronization in the Mammalian brain". Neuron. 41 (4): 495–511. doi:10.1016/S0896-6273(04)00043-1. PMID 14980200. S2CID 18566176.
- ^ 칸델, 슈워츠 & 제셀 2000, 페이지 178–180
- ^ 칸델, 슈워츠 & 제셀 2000, 페이지 178
- ^ 칸달 외, 10장
- ^ 휴스턴 텍사스 의과대학 안과 시각과학부 존 오브라이언 교수 전기
- ^ a b c 칸델, 슈워츠 & 제셀 2000 페이지 180
- ^ Activity-Dependent; Synapses, Electrical; Haas, Julie S.; et al. (2011). "Activity-dependent long-term depression of electrical synapses". Science. 334 (6054): 389–93. Bibcode:2011Sci...334..389H. doi:10.1126/science.1207502. PMID 22021860. S2CID 35398480.
- ^ Palacios-Prado, Nicolas; et al. (Mar 2013). "Intracellular magnesium-dependent modulation of gap junction channels formed by neuronal connexin36". Journal of Neuroscience. 33 (11): 4741–53. doi:10.1523/JNEUROSCI.2825-12.2013. PMC 3635812. PMID 23486946.
- ^ 포유류 뇌의 전기 시냅스, 코너스 & 롱, "안누 레브 노이로시" 2004;27:393-418
- ^ Eugenin, Eliseo A.; Basilio, Daniel; Sáez, Juan C.; Orellana, Juan A.; Raine, Cedric S.; Bukauskas, Feliksas; Bennett, Michael V. L.; Berman, Joan W. (2012-09-01). "The role of gap junction channels during physiologic and pathologic conditions of the human central nervous system". Journal of Neuroimmune Pharmacology. 7 (3): 499–518. doi:10.1007/s11481-012-9352-5. ISSN 1557-1904. PMC 3638201. PMID 22438035.
- ^ Pereda, Alberto E.; Curti, Sebastian; Hoge, Gregory; Cachope, Roger; Flores, Carmen E.; Rash, John E. (2013-01-01). "Gap junction-mediated electrical transmission: regulatory mechanisms and plasticity". Biochimica et Biophysica Acta (BBA) - Biomembranes. 1828 (1): 134–146. doi:10.1016/j.bbamem.2012.05.026. ISSN 0006-3002. PMC 3437247. PMID 22659675.
추가 읽기
- Andrew L. Harris; Darren Locke (2009). Connexins, a guide. New York: Springer. p. 574. ISBN 978-1-934115-46-6.
- Haas, Julie S.; Baltazar Zavala; Carole E. Landisman (2011). "Activity-dependent long-term depression of electrical synapses". Science. 334 (6054): 389–393. Bibcode:2011Sci...334..389H. doi:10.1126/science.1207502. PMID 22021860. S2CID 35398480.
- Hestrin, Shaul (2011). "The strength of electrical synapses". Science. 334 (6054): 315–316. Bibcode:2011Sci...334..315H. doi:10.1126/science.1213894. PMC 4458844. PMID 22021844.


