이수소인산염
Dihydrogen phosphate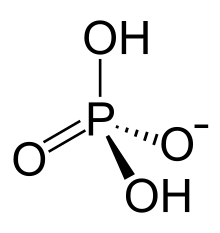 | |
| 이름 | |
|---|---|
| IUPAC 이름 이수소 인산염 | |
| 체계적 IUPAC 이름 인산, 이온(1-) | |
| 기타 이름 인산, 이온(1-) 디히드롭인산(1-) | |
| 식별자 | |
3D 모델(JSmol) | |
| 체비 | |
| 켐스파이더 | |
펍켐 CID | |
| |
| |
| 특성. | |
| H2O4P−1 | |
| 어금질량 | 96.986 g·19986−1 |
| 콘게이트산 | 인산 |
| 관련 화합물 | |
관련 화합물 | 인산염, 모노수소 인산염 |
달리 명시된 경우를 제외하고, 표준 상태(25°C [77°F], 100 kPa)의 재료에 대한 데이터가 제공된다. | |
| Infobox 참조 자료 | |
이수소 인산염 또는 이수소 인산염 이온은 [HPO24]−라는 공식을 가진 무기물 이온이다. 인산염은 자연계에서 광범위하게 발생한다.[1]
이러한 인산나트륨은 식품 가공과 포장에 유화제, 중화제, 표면 활성제, 인간에게 혜택을 제공하는 발효제로 인위적으로 사용된다. 유화제는 가공식품에서 자연상태에서 분리되는 두 가지 성분의 분리를 방지하는 동시에 중화제는 가공식품의 신선함을 더 오래 느끼게 하고 유통기한을 늘리게 한다.[1] 표면 활성제는 액체가 함유된 가공식품에 표면 텐션 형성을 방지하고 마지막으로 발효제는 가공식품에 사용되어 구운 제품에 효모가 확대되는 것을 돕는다.[1]
이수소 인산염은 위내과 전문의와 일반적으로 인간에게 중요한 의약품 생산에 사용된다. 이 의학 분야에서는 인산나트륨이 천연 방만제로 사용된다.[1] 다른 의료 애플리케이션에는 치료 효과를 높이기 위해 나트륨과 인산칼륨을 다른 약과 함께 사용하는 것이 포함된다. 염증, 특정 암, 궤양은 나트륨과 칼륨인산염과의 결합요법을 사용하면 유익할 수 있다.[1]
소금의 칼륨인 이수소 인산칼륨은 살충제의 형태로 인간에게 유용하다. 이수소 인산칼륨은 많은 과일에서 가루 곰팡이를 예방하기 위해 사용되는 살균제다.[2] 이수소인산칼륨을 첨가해 이득을 볼 수 있는 과일은 흔한 과일, 고추, 장미 등이 있다.[2]
구조
이수소 인산염 음이온은 2개의 등가 산소 원자와 2개의 히드록시 그룹으로 둘러싸인 중앙 인 원자로 구성된다.[3] 이수소 인산염은 음이온으로, 이수소 인산염은 음이온으로, 이수소 인산염은 음이온으로 식별할 수 있다.[3] 이수소 인산염에는 4H 본드 수용기와 2H 본드 기증자가 들어 있으며,[3] 0회 회전 가능한 본드가 있다.[4]
산-기초 평형증
이수소 인산염은 폴리프로틱 인산염을 인산염으로 다단계 변환하는 중간 물질이다.[5]
이 다단계 변환은 이수소 인산염 이온이 인산염에 대한 결합 기반인 동시에 인산염 이온에 대한 결합산 역할도 하는 것을 예시한다.[3] 이것은 이수소 인산염이 수소 기증자와 수용자가 될 수 있다는 것을 의미한다.
| 평형 | 분리 상수, pKa[6] |
|---|---|
| H3PO4 ⇌ H 2PO− 4 + H+ | pKa1 = 2.14[a] |
| H 2PO− 4 ⇌ HPO2− 4 + H+ | pKa2 = 7.20 |
| HPO2− 4 ⇌ PO3− 4 + H+ | pKa3 = 12.37 |
예
안전
우유, 달걀, 가금류, 견과류를 포함한 많은 식품은 이러한 인산나트륨을 함유하고 있다.[1]
메모들
- ^ 값은 25 °C와 0 이온 강도에 있다.
참조
- ^ a b c d e f Tech, Noah. "Sodium Phosphates: From Food to Pharmacology Noah Technologies". info.noahtech.com. Retrieved 2021-03-23.
- ^ a b "Document Display NEPIS US EPA". nepis.epa.gov. Retrieved 2021-03-23.
- ^ a b c d PubChem. "Dihydrogen phosphate". pubchem.ncbi.nlm.nih.gov. Retrieved 2021-03-23.
- ^ "dihydrogenphosphate H2O4P ChemSpider". www.chemspider.com. Retrieved 2021-03-23.
- ^ "Phosphoric Acid H3PO4". www.aqion.de. Retrieved 2021-03-23.
- ^ Powell, Kipton J.; Brown, Paul L.; Byrne, Robert H.; Gajda, Tamás; Hefter, Glenn; Sjöberg, Staffan; Wanner, Hans (2005). "Chemical speciation of environmentally significant heavy metals with inorganic ligands. Part 1: The Hg2+, Cl−, OH−, CO2−
3, SO2−
4, and PO3−
4 aqueous systems". Pure Appl. Chem. 77 (4): 739–800. doi:10.1351/pac200577040739.


