연소
Combustion

연소 [1]또는 연소는 연료(환원제)와 산화제(일반적으로 대기 산소) 사이의 고온 발열 산화 환원 화학 반응으로 연기라고 불리는 혼합물에서 산화, 종종 가스 생성물을 생성합니다.연소가 항상 화재로 이어지는 것은 아닙니다. 왜냐하면 불꽃은 연소를 받는 물질이 기화할 때만 볼 수 있기 때문입니다. 하지만 불꽃이 기화할 때는 반응의 특징적인 지표가 됩니다.연소를 시작하기 위해 활성화 에너지를 공급해야 하지만(예: 불을 붙이기 위해 불이 붙은 성냥을 사용하는 것), 불꽃의 열은 반응을 자생적으로 만들기에 충분한 에너지를 제공할 수 있습니다.
연소는 종종 기본적인 라디칼 반응의 복잡한 순서입니다.나무와 석탄과 같은 고체 연료는 먼저 가스 연료를 생산하기 위해 흡열 열분해 과정을 거치며, 연소를 통해 더 많은 연료를 생산하는 데 필요한 열을 공급합니다.연소는 종종 충분히 뜨거워서 발광 또는 불꽃 형태의 백열광이 생성됩니다.간단한 예는 수소와 산소를 수증기로 연소시키는 것에서 볼 수 있는데, 이것은 로켓 엔진에 연료를 공급하기 위해 흔히 사용되는 반응입니다.이 반응은 242kJ/mol의 열을 방출하고 엔탈피를 그에 따라 감소시킵니다(일정한 온도와 압력에서).
공기 중에서 촉매되지 않은 연소는 비교적 높은 온도를 필요로 합니다.완전 연소는 연료와 관련하여 화학양론적이며, 연료가 남아 있지 않고, 이상적으로 잔류 산화제가 없는 경우입니다.열역학적으로 공기 중 연소의 화학적 평형은 압도적으로 제품 측면에 있습니다.그러나 완전 연소는 화학적 평형에 도달할 필요가 없거나 일산화탄소, 수소 및 심지어 탄소(흡입 또는 회분)와 같은 미연소 생성물을 포함할 수 있기 때문에 거의 불가능합니다.따라서 생성된 연기는 일반적으로 독성이 있으며 연소되지 않았거나 부분적으로 산화된 제품을 포함합니다.질소의 연소는 높은 온도에서는 열역학적으로 선호되지만 낮은 온도에서는 선호되지 않기 때문에 78%의 질소인 대기 중의 고온에서의 연소는 또한 적은 양의 질소 산화물(NOx)을 생성합니다.연소가 거의 깨끗하지 않기 때문에 연료 가스 세척 또는 촉매 변환기가 법적으로 필요할 수 있습니다.
화재는 번개나 화산 생성물에 의해 점화되는 자연적으로 발생합니다.연소(불)는 캠프파이어와 모닥불의 형태로 인간에 의해 발견된 최초의 제어된 화학 반응이며, 인류를 위한 에너지를 생산하는 주요 방법입니다.일반적으로 연료는 탄소, 탄화수소 또는 부분적으로 산화된 탄화수소를 포함하는 목재와 같은 더 복잡한 혼합물입니다.석탄, 석유와 같은 화석 연료 또는 장작과 같은 재생 가능한 연료의 연소로부터 생성된 열 에너지는 요리, 전기 생산 또는 산업 또는 가정용 난방과 같은 다양한 용도로 수확됩니다.연소는 또한 현재 로켓에 동력을 공급하는 데 사용되는 유일한 반응입니다.연소는 유해하지 않은 폐기물과 유해한 폐기물을 파괴(소각)하는 데에도 사용됩니다.
연소를 위한 산화제는 높은 산화 전위를 가지며 대기 또는 순산소, 염소, 불소, 삼불화염소, 아산화질소 및 질산을 포함합니다.예를 들어, 수소는 염소 내에서 연소되어 열의 해방과 연소의 빛의 특성을 갖는 염화수소를 형성합니다.일반적으로 촉매가 되지는 않지만, 접촉 과정에서와 같이 백금이나 바나듐에 의해 연소가 촉매될 수 있습니다.
종류들
완전불완전
완성하다

완전 연소 시, 반응물은 산소에서 연소되며 제한된 수의 생성물을 생성합니다.탄화수소가 산소에서 연소할 때, 그 반응은 주로 이산화탄소와 물을 생산합니다.요소가 연소될 때 제품은 주로 가장 일반적인 산화물입니다.탄소는 이산화탄소를, 유황은 이산화황을, 철은 산화철을 생산할 것입니다.질소는 산소가 산화제인 경우 가연성 물질로 간주되지 않습니다.그러나 공기가 산화적일 때 소량의 다양한 질소 산화물(일반적으로 지정되는 NO종
x)이 형성됩니다.
연소가 반드시 최대 산화도에 유리한 것은 아니며 온도에 의존할 수 있습니다.예를 들어 삼산화황은 황의 연소에 의해 정량적으로 생성되지 않습니다.약 2,800 °F (1,540 °C) 이상의 상당한 양의 종이 나타나지x 않으며, 더 높은 온도에서 더 많은 종이 생성됩니다.NO의x 양은 산소 과잉의 함수이기도 합니다.[2]
대부분의 산업 응용 분야와 화재에서 공기는 산소(O
2)의 공급원입니다.공기 중에서, 각각의 산소 몰은 약 3.71 몰의 질소와 섞입니다.질소는 연소에 참여하지 않지만 고온에서는 일부 질소가 NO(대부분
x NO, 훨씬 적은 양의 NO
2)로 변환됩니다.반면, 연료를 완전히 연소시킬 만큼 산소가 부족할 경우, 일부 연료 탄소는 일산화탄소로 전환되고, 일부 수소는 미반응 상태로 남게 됩니다.따라서 공기 중의 탄화수소 연소를 위한 완전한 방정식 세트는 연료 중의 탄소와 수소 사이의 산소 분포에 대한 추가 계산을 필요로 합니다.
완전 연소에 필요한 공기량을 "이론적 공기" 또는 "양론적 공기"라고 합니다.[3]최적 연소에 실제로 필요한 이 값을 초과하는 공기의 양을 "과잉 공기"라고 하며, 천연 가스 보일러의 경우 5%, 무연탄 석탄의 경우 40%, 가스 터빈의 경우 300%까지 다양합니다.[4]
미완성
불완전 연소는 연료가 완전히 반응하여 이산화탄소와 물을 생성할 만큼 충분한 산소가 없을 때 발생합니다.또한 고체 표면이나 화염 트랩과 같은 히트 싱크에 의해 연소가 퀀칭될 때도 발생합니다.완전 연소의 경우와 마찬가지로 물은 불완전 연소에 의해 생성되지만 이산화탄소 대신 탄소와 일산화탄소가 생성됩니다.
디젤유, 석탄 또는 목재와 같은 대부분의 연료의 경우, 열분해는 연소 전에 발생합니다.불완전 연소 시 열분해 생성물은 연소되지 않은 상태로 남아 있으며 유해한 입자 물질과 가스로 연기를 오염시킵니다.부분적으로 산화된 화합물 또한 문제입니다. 에탄올의 부분적인 산화는 유해한 아세트알데히드를 생성할 수 있고, 탄소는 유독한 일산화탄소를 생성할 수 있습니다.
연소 장치의 설계는 버너 및 내연 기관과 같은 연소의 품질을 향상시킬 수 있습니다.촉매 애프터버닝 장치(촉매 변환기 등) 또는 배기 가스가 연소 프로세스로 단순하게 부분적으로 복귀함으로써 추가적인 개선이 가능합니다.이러한 장치는 대부분의 국가에서 자동차에 대한 환경 법규에 의해 요구됩니다.화력 발전소와 같은 대형 연소 장치가 합법적인 배출 기준에 도달할 수 있도록 하는 데 필요할 수 있습니다.
연소 정도는 시험 장비로 측정하고 분석할 수 있습니다.HVAC 계약자, 소방관 및 엔지니어는 연소 분석기를 사용하여 연소 과정 동안 버너의 효율성을 테스트합니다.또한 내연 기관의 효율성은 이러한 방법으로 측정할 수 있으며, 일부 미국 주와 지방 자치 단체에서는 연소 분석을 사용하여 오늘날 도로 위의 차량의 효율성을 정의하고 평가합니다.
일산화탄소는 불완전 연소로 인한 생성물 중 하나입니다.[5]일산화탄소의 형성은 이산화탄소의 형성보다 열을 적게 발생시키기 때문에 완전 연소가 특히 일산화탄소는 유독 가스이기 때문에 매우 선호됩니다.숨을 쉬면 일산화탄소가 산소를 대신해 혈액 속 헤모글로빈의 일부와 결합해 산소를 운반할 수 없게 됩니다.[6]
불완전 연소와 관련된 문제
환경문제
이 산화물들은 대기 중의 물과 산소와 결합하여 질산과 황산을 생성하는데, 이것들은 산성 침전물, 즉 "산성 비"로서 지구 표면으로 되돌아옵니다.산성침적은 수생생물에 해를 끼치고 나무를 죽입니다.칼슘과 인과 같은 식물이 덜 이용할 수 있는 특정한 영양소를 형성하기 때문에, 그것은 생태계와 농장의 생산성을 줄입니다.질소산화물과 관련된 추가적인 문제는 탄화수소 오염물질과 함께 스모그의 주요 성분인 지상 오존의 형성에 기여한다는 것입니다.[7]
인간건강문제
일산화탄소를 마시는 것은 두통, 어지러움, 구토, 메스꺼움을 일으킵니다.일산화탄소 수치가 충분히 높으면 인간은 의식을 잃거나 죽게 됩니다.중간 수준과 높은 수준의 일산화탄소에 장기간 노출되는 것은 심장병의 위험과 긍정적인 상관관계가 있습니다.심각한 일산화탄소 중독에서 살아남은 사람들은 장기적인 건강 문제를 겪을 수 있습니다.[8]공기에서 나온 일산화탄소는 폐에서 흡수되고 인간의 적혈구에서 헤모글로빈과 결합합니다.이것은 몸 전체에 산소를 운반하는 적혈구의 용량을 줄여줍니다.
스모킹
연소는 산소가 응축된 상 연료의 표면을 직접적으로 공격할 때 발생하는 열에 의해 지속되는 느리고 낮은 온도의 화염이 없는 연소 형태입니다.전형적으로 불완전 연소 반응입니다.연소 반응을 유지할 수 있는 고체 재료에는 석탄, 셀룰로오스, 목재, 면화, 담배, 토탄, 더프, 부식제, 합성 폼, 차링 폴리머(폴리우레탄 폼 포함) 및 먼지가 포함됩니다.연소 현상의 일반적인 예는 약한 열원(예: 담배, 합선 전선)에 의해 가림 가구에 주거용 화재가 시작되는 것과 산불의 불타는 전선 뒤에서 지속적으로 발생하는 바이오매스의 연소입니다.
래피드
이 부분의 사실적 정확성은 논란의 여지가 있습니다.(2016년 7월)(이 를 및 |
급속 연소는 연소의 한 형태로, 불이라고도 불리며, 많은 양의 열과 빛 에너지가 방출되어 종종 불꽃을 일으킵니다.이것은 내연기관과 같은 기계의 형태와 열탄화 무기에 사용됩니다.이러한 연소는 종종 급속 연소(Rapid combustion)라고 불리지만 내연 기관의 경우에는 정확하지 않습니다.[disputed ]내연 기관은 일반적으로 제어된 급속 연소로 작동합니다.내연기관에서 연료와 공기의 혼합물이 폭발할 때, 그것은 폭발이라고 알려져 있습니다.[disputed ]
자발성
자발연소는 자기가열(발열성 내부반응에 의한 온도상승)에 이어 열폭주(고온으로 급격히 가속하는 자기가열), 마지막으로 점화에 의해 발생하는 연소의 한 종류입니다.예를 들어, 인은 열을 가하지 않고 상온에서 스스로 발화합니다.박테리아 퇴비화를 거치는 유기 물질은 연소 지점에 도달할 만큼 충분한 열을 발생시킬 수 있습니다.[9]
터블런트
난류가 연료와 산화제의 혼합 과정을 돕기 때문에 난류 화염을 발생시키는 연소는 산업적 응용 분야(예: 가스 터빈, 가솔린 엔진 등)에 가장 많이 사용됩니다.
극미중력

'미중력'이라는 용어는 물리적 과정에 대한 부력의 영향이 정상 중력에 존재할 수 있는 다른 흐름 과정에 비해 상대적으로 작다고 간주될 수 있는 '낮음'(즉, '작음'의 의미에서 '미중력') 중력 상태를 말합니다.이러한 환경에서, 열 및 흐름 전달 역학은 정상 중력 조건에서와는 매우 다르게 작용할 수 있습니다(예를 들어, 촛불의 불꽃이 구의 형태를 띠는 경우).[10]극미중력 연소 연구는 우주선의 환경(예: 국제 우주 정거장의 승무원 안전과 관련된 화재 역학) 및 지상(지구 기반) 조건(예: 새로운 연료 혼합물 개발을 지원하는 액적 연소 역학)과 관련된 다양한 측면을 이해하는 데 기여합니다.또는 개선된 연소, 재료 제작 프로세스, 전자 시스템의 열 관리, 다상 흐름 비등 역학 등이 포함됩니다.
미소 연소
매우 작은 부피로 발생하는 연소 과정은 미소 연소로 간주됩니다.높은 표면 대 부피비는 비열 손실을 증가시킵니다.퀀칭 거리는 이러한 연소실의 화염을 안정화시키는 데 중요한 역할을 합니다.
화학 방정식
산소중 탄화수소의 화학양론적 연소
일반적으로 산소에서 탄화수소의 화학양론적 연소에 대한 화학 방정식은 다음과 같습니다.
여기서 = + = x +
예를 들어 산소에서 프로판의 화학양론적 연소는 다음과 같습니다.
공기중 탄화수소의 화학양론적 연소
공기를 산소 공급원으로 사용하여 화학양론적 연소가 이루어지는 경우 공기 중에 존재하는 질소(지구 대기)를 식에 추가하여 공기 중 연료의 화학양론적 조성과 생성된 연도 가스의 조성을 나타낼 수 있습니다.공기 중의 모든 비산소 성분을 질소로 처리하면 산소에 대한 '질소' 비율이 3.77, 즉 O2%가 20.95% vol인 경우 O2%가 됩니다.
여기서 = + z = x +
예를 들어, 프로판의 화학양론적 연소( H style 의 공기 중:
공기 중 프로판의 화학양론적 조성은 1 / (1 + 5 + 18.87) = 4.02% vol.
공기 중 CHO에αβγ 대한 화학양론적 연소 반응:
COS에αβγδ 대한 화학양론적 연소 반응:
CHONS에αβγδε 대한 화학양론적 연소 반응:
CHOF에αβγδ 대한 화학양론적 연소 반응:
연소 생성물 추적
화염 온도가 약 1600 K 이상일 때 연소 제품에서 다양한 다른 물질들이 상당한 양으로 나타나기 시작합니다.과잉 공기를 사용하면 질소는 NO로 산화되고 CO의2 불균형에 의해 CO가 형성되고
2 HO의2 불균형에
2 의해 H와 OH가 형성됩니다.
예를 들어, 프로판 1몰을 공기 28.6몰(화학량의 120%)로 연소시킬 때 연소 생성물은 3.3% O를
2 함유합니다. 1400 K에서 평형 연소 생성물은 0.03% NO와 0.002% OH를 함유합니다.1800 K에서 연소 생성물은 0.17% NO, 0.05% OH, 0.01% CO 및 0
2.004% H를 포함합니다.[11]
디젤 엔진은 화학량론적 양의 산소만으로 형성되는 경향이 있는 작은 입자를 연소시키기 위해 과량의 산소와 함께 작동되며 반드시 질소산화물 배출을 발생시킵니다.미국과 유럽 연합은 차량 질소 산화물 배출에 제한을 두고 있으며, 이를 위해서는 특수 촉매 컨버터를 사용하거나 요소로 배기를 처리해야 합니다(디젤 배기액 참조).
산소중 탄화수소의 불완전연소
탄화수소와 산소의 불완전한 (부분적인) 연소는 주로 CO
2, CO, HO2, 및 H를
2 포함하는 가스 혼합물을 생성합니다.이러한 가스 혼합물은 일반적으로 금속의 열처리 및 가스 탄화를 위한 보호 분위기로 사용하기 위해 준비됩니다.[12]산소 중 탄화수소 1몰의 불완전 연소에 대한 일반적인 반응 방정식은 다음과 같습니다.
z가 화학양론적 값의 약 50% 미만으로 떨어질 때 CH는
4 중요한 연소 생성물이 될 수 있습니다. z가 화학양론적 값의 약 35% 미만으로 떨어질 때 원소 탄소는 안정적이 될 수 있습니다.
불완전 연소 생성물은 물질 균형을 이용하여 계산할 수 있으며, 연소 생성물이 평형에 도달한다는 가정도 함께 계산할 수 있습니다.[13][14]예를 들어, O의
2 4 몰을 갖는 프로판(CH
3
8) 1 몰의 연소에서, 연소 가스는 7 몰이 형성되고, z는 화학량론적 값의 80%입니다.세 가지 요소 균형 방정식은 다음과 같습니다.
- 탄소: + = a + b =
- 수소 : + = + =
- 산소 : 2 + b+ = 8 + b + c =
이 세 개의 방정식은 연소 가스 조성을 계산하기에는 그 자체로 불충분합니다.그러나 평형 위치에서 물-가스 이동 반응은 또 다른 방정식을 제공합니다.
- + 2+ H + ->+ × b× }={\ d c
예를 들어, 1200 K에서 K의eq 값은 0.728입니다.[15]해결하면 연소 가스는 HO 422.4%, CO2 29.0%, H 14
2.7%, CO 13.9%로 구성됩니다.z가 화학양론적 값의 30% 미만일 때 탄소는 1200 K, 1 atm 압력에서 안정한 상이 되며, 이때 연소 생성물에는 98% 이상의 H와
2 CO, 약 0.5%의
4 CH가 포함됩니다.
연소를 겪는 물질이나 물질을 연료라고 부릅니다.가장 일반적인 예로는 천연 가스, 프로판, 등유, 디젤, 휘발유, 숯, 석탄, 목재 등이 있습니다.
액체연료
산화 분위기에서 액체 연료의 연소는 기체 상태에서 실제로 발생합니다.태우는 것은 액체가 아니라 증기입니다.따라서 액체는 일반적으로 특정 온도 이상에서만 불이 붙습니다. 즉, 인화점입니다.액체 연료의 인화점은 공기와 가연성 혼합물을 형성할 수 있는 최저 온도입니다.이것은 공기 중에 연소를 시작하기에 충분한 증발된 연료가 있는 최소 온도입니다.
기체연료
가스 연료의 연소는 확산 화염, 예혼합 화염, 자기 점화 반응 전방 또는 폭발의 네 가지 유형 중 하나를 통해 발생할 수 있습니다.[16]실제로 발생하는 연소 유형은 가열 전에 연료와 산화제가 혼합되는 정도에 따라 달라집니다. 예를 들어, 연료와 산화제가 처음에 분리되면 확산 불꽃이 형성되고, 그렇지 않으면 미리 혼합된 불꽃이 형성됩니다.마찬가지로 연소 유형도 압력에 따라 달라집니다. 예를 들어 폭발은 강한 충격파에 결합된 자동 반응 전선으로 특징적인 고압 피크와 높은 폭발 속도를 제공합니다.[16]
고체연료
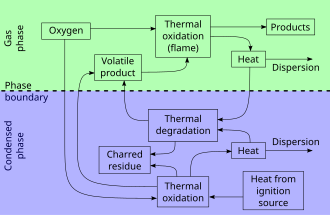
연소 작용은 비교적 뚜렷하지만 중복되는 세 단계로 구성됩니다.
- 예열 단계: 연소되지 않은 연료를 인화점까지 가열한 후 발화점까지 가열합니다.가연성 가스는 건식 증류와 비슷한 과정에서 발전하기 시작합니다.
- 진화된 가연성 가스와 산소의 혼합이 점화되는 증류상 또는 기체상.에너지는 열과 빛의 형태로 만들어집니다.불길은 종종 눈에 띕니다.연소에서 고체로의 열 전달은 가연성 증기의 진화를 유지합니다.
- 숯 상 또는 고체 상, 재료에서 가연성 가스의 출력이 너무 낮아서 불꽃이 지속적으로 발생하지 않고 그을린 연료가 빠르게 연소되지 않고 나중에는 연기만 발생합니다.
연소관리
효율적인 프로세스 가열을 위해서는 연료의 연소열 중 가장 큰 부분을 처리 중인 물질로 회수해야 합니다.[17][18]가열 공정의 작동에는 여러 가지 손실이 있습니다.일반적으로 주된 손실은 오프 가스(즉, 연도 가스)와 함께 떠나는 현열입니다.오프가스의 온도와 양은 열 함량(엔탈피)을 나타내므로 양을 낮게 유지하면 열 손실이 최소화됩니다.
완벽한 용광로에서 연소 공기 흐름은 연료 흐름과 일치되어 각 연료 분자가 완전 연소를 일으키는 데 필요한 정확한 산소량을 제공합니다.하지만 실제 세계에서는 연소가 완벽한 방식으로 진행되지는 않습니다.시스템에서 배출되는 연소되지 않은 연료(일반적으로 CO 및 H
2)는 가열 값 손실(안전 위험)을 나타냅니다.가연성은 오프 가스에서 바람직하지 않지만 반응하지 않은 산소가 있으면 안전 및 환경 문제가 최소화되므로 연소 관리의 첫 번째 원칙은 모든 연료가 연소되도록 하기 위해 이론적으로 필요한 것보다 더 많은 산소를 공급하는 것입니다.예를 들어 메탄(CH
4) 연소의 경우 산소 분자가 2개보다 약간 더 많이 필요합니다.
그러나 연소 관리의 두 번째 원칙은 산소를 너무 많이 사용하지 않는 것입니다.정확한 산소량은 세 가지 측정이 필요합니다. 첫째, 공기 및 연료 흐름의 능동적 제어, 둘째, 오프가스 산소 측정, 셋째, 오프가스 가연물 측정입니다.각 가열 프로세스에서 허용 가능한 수준의 가연성 농도와 함께 오프가스 열 손실을 최소화하는 최적 조건이 있습니다.과잉 산소를 최소화하는 것은 추가적인 이점을 제공합니다. 주어진 오프 가스 온도의 경우, 과잉 산소를 최저로 유지할 때 NOx 레벨이 가장 낮습니다.[2]
연소 프로세스에서 재료와 열 균형을 유지함으로써 이 두 가지 원칙을 더욱 준수할 수 있습니다.[19][20][21][22]재료 균형은 공기/연료 비율과 연소 가스의 O 비율을
2 직접적으로 연관시킵니다.열 균형은 충전에 사용할 수 있는 열과 연료 연소에 의해 생성되는 전체 순열 사이의 관계를 나타냅니다.[23][24]연소 공기를 예열하거나 [25][26]산소에서 농축함으로써 얻을 수 있는 열 이점을 정량화하기 위해 추가 재료와 열 균형을 만들 수 있습니다.[27][28]
반응 메커니즘
이 섹션은 검증을 위해 추가적인 인용이 필요합니다.(2017년 1월)(이를 제거하는 및 알아보기 |
산소에서의 연소는 많은 상이한 라디칼 중간체가 참여하는 연쇄 반응입니다.개시에 필요한 높은 에너지는 다이옥시겐 분자의 특이한 구조로 설명됩니다.다이옥시겐 분자의 가장 낮은 에너지 구성은 삼중항 스핀 상태에서 안정적이고 상대적으로 반응성이 없는 디라디칼입니다.결합은 분자가 0이 아닌 총 각운동량을 갖도록 스핀이 정렬된 세 개의 결합 전자 쌍과 두 개의 반결합 전자로 설명될 수 있습니다.반면에 대부분의 연료는 쌍을 이루는 스핀과 총 각운동량이 0인 싱글릿 상태입니다.양자 간의 상호작용은 역학적으로 "금지된 전이", 즉 매우 낮은 확률로 가능합니다.연소를 시작하기 위해서는 다이옥시겐을 스핀 쌍 상태 또는 단일 산소 상태로 만들기 위한 에너지가 필요합니다.이 중간체는 반응성이 매우 높습니다.에너지는 열로 공급되고, 그 반응은 추가적인 열을 생성하여 지속적으로 유지됩니다.
탄화수소의 연소는 연료에서 산소로의 수소 원자 추상화(양성자 추상화가 아닌)에 의해 시작되어 과산화수소 라디칼(HOO)을 생성하는 것으로 생각됩니다.이것은 추가로 반응하여 수산화물을 만들고, 이것은 분해되어 하이드록실 라디칼을 만듭니다.연료 라디칼 및 산화 라디칼을 생성하는 이러한 공정은 매우 다양합니다.산화하는 종에는 단일 산소, 하이드록실, 단원자 산소, 히드로페록실 등이 있습니다.이러한 중간체는 수명이 짧기 때문에 분리할 수 없습니다.그러나 비 라디칼 중간체는 안정적이며 불완전 연소에서 생성됩니다.에탄올의 연소에서 생성되는 아세트알데히드가 그 예입니다.탄소와 탄화수소의 연소에서 중간체인 일산화탄소는 유독 가스이기 때문에 특히 중요하지만 합성가스 생산에 경제적으로 유용합니다.
고체 및 무거운 액체 연료는 또한 더 쉽게 산화되고 가스 연료를 제공하는 많은 열분해 반응을 겪습니다.이러한 반응은 흡열성이며, 진행 중인 연소 반응에서 일정한 에너지가 투입되어야 합니다.산소 부족이나 기타 부적절하게 설계된 조건으로 인해 유해하고 발암성이 있는 열분해 제품이 짙은 검은 연기로 배출됩니다.
연소 속도는 일정 기간 동안 연소되는 물질의 양입니다.초당 그램(g/s) 또는 초당 킬로그램(kg/s)으로 표현할 수 있습니다.
화학 동역학적 관점에서 연소 과정에 대한 상세한 설명은 크고 복잡한 기본 반응의 거미줄의 공식화를 필요로 합니다.[29]예를 들어, 탄화수소 연료의 연소는 일반적으로 수천 개의 반응에 따라 반응하는 수백 종의 화학 물질을 포함합니다.
계산 흐름 해결사에 이러한 메커니즘을 포함시키는 것은 여전히 두 가지 측면에서 상당히 어려운 작업입니다.첫째, 자유도의 수(화학종의 수에 비례)가 극적으로 클 수 있습니다. 둘째, 반응으로 인한 소스 항은 시간 척도의 상이한 수를 도입하여 전체 동적 시스템을 경직시킵니다.결과적으로, 무거운 연료를 사용하는 난류 반응성 흐름의 직접 수치 시뮬레이션은 현대의 슈퍼컴퓨터에서도 곧 다루기 어렵게 됩니다.[30]
따라서, 높은 세부 수준에 의존하지 않고 연소 메커니즘의 복잡성을 줄이기 위한 수많은 방법론이 고안되었습니다.예는 다음과 같습니다.
- 완화재분배법 (RRM)[31][32][33][34]
- 고유 저차원 다양체의 개발 및 개발[35][36][37]
- 불변-제약 평형 에지 [38]역상 곡선 방법
- 몇 가지 변형적 접근법[39][40]
- 계산 단수 섭동(CSP)[41][42] 방법 및 추가 개발
- RCCE(Rate Controlled Constrainted Equalibrium)와 QEM(Quasi Equalibrium Manifold)[43][44] 접근법
- G-Scheme.[45]
- MIG(Method of Uniment Grids).[46][47][48]
동역학 모델링
운동 모델링은 예를 들어 열중량 분석을 사용하여 다양한 물질의 연소에서 열분해의 반응 메커니즘에 대한 통찰력을 위해 탐색될 수 있습니다.[49]
온도

단열 조건에서 완전 연소(즉, 열 손실 또는 이득 없음)와 같은 완벽한 연소 조건을 가정할 때 단열 연소 온도를 결정할 수 있습니다.이 온도를 산출하는 공식은 열역학 제1법칙에 기초하고 있으며, 연소열은 연료, 연소 공기 또는 산소, 연소 생성 가스(일반적으로 연도 가스라고 함)를 가열하는 데 전적으로 사용된다는 사실에 주목합니다.
공기 중에서 연소되는 화석 연료의 경우 연소 온도는 다음 모두에 따라 달라집니다.
단열 연소 온도(단열 화염 온도라고도 함)는 난방 값이 높을수록, 입구 공기 및 연료 온도가 높을수록, 그리고 화학량론 공기비가 1에 가까울수록 증가합니다.
일반적으로 석탄의 단열 연소 온도는 약 2,200°C(3,992°F)(주변 온도의 입구 공기 및 연료 및 λ = \lambda = 오일의 경우 약 2,150°C(3,902°F), 천연 가스의 경우 약 2,632°F(3,632°F)입니다.
산업용 연소식 히터, 발전소 증기 발생기 및 대형 가스 연소식 터빈에서 화학량론적 연소 공기 이상의 사용을 표현하는 가장 일반적인 방법은 퍼센트 초과 연소 공기입니다.예를 들어, 연소 공기가 15% 초과되면 필요한 화학양론적 공기보다 15% 더 많이 사용되고 있음을 의미합니다.
인스
연소 불안정은 일반적으로 연소실에서 발생하는 격렬한 압력 진동입니다.이러한 압력 진동은 최대 180dB에 이를 수 있으며, 이러한 주기적인 압력 및 열 부하에 장기간 노출되면 엔진 구성 요소의 수명이 단축됩니다.새턴 V 프로그램에 사용된 F1과 같은 로켓의 불안정성은 연소실과 주변 부품에 막대한 손상을 입혔습니다.이 문제는 연료 주입기를 재설계함으로써 해결되었습니다.액체 제트 엔진에서 액적 크기와 분포는 불안정성을 약화시키는 데 사용될 수 있습니다.배출x 가스가 없기 때문에 연소 불안정은 지상 기반 가스 터빈 엔진의 주요 관심사입니다.당량비가 1보다 작은 린을 실행하여 연소 온도를 낮추고 NOx 배출을 줄이는 경향이 있지만, 연소 린을 실행하면 연소 불안정에 매우 취약합니다.
Rayleigh Criteria는 열음향 연소 불안정 분석의 기초가 되며, 불안정 1주기에[52] 걸쳐 Rayleigh Index를 사용하여 평가됩니다.
여기서 q'는 열 방출 속도 섭동이고 p'는 압력 변동입니다.[53][54]열 방출 진동이 압력 진동과 같은 위상일 때 레일리 지수는 양수이고 열음향 불안정성의 크기는 최대화됩니다.반면, 레일리 지수가 음이면 열음향 감쇠가 발생합니다.레일리 기준은 열 방출 진동을 동일한 주파수의 압력 진동으로 위상에서 180도 벗어나면 열음향 불안정성을 최적으로 제어할 수 있음을 암시합니다.[55][56]이것은 레일리 지수를 최소화합니다.
참고 항목
| 관련개념
| 기계 및 장비 과학 및 공학회 다른.
|
참고문헌
- ^ 불타는 것의 구어적인 의미는 화염을 동반한 연소입니다.
- ^ a b NOx의 형성.Alentecinc.com .2010-09-28에 검색되었습니다.
- ^ Central Boiler Plants (Report). US Department of the Army. 1989. p. Glossary 26. TM 5-650.
- ^ "Engineering Toolbox: Optimal Combustion Processes - Fuel vs. Excess Air". 2003. Retrieved 15 May 2023.
- ^ "Incomplete combustion process".
- ^ "Burning showing incomplete combustion".
- ^ "Environmental Problems associated with incomplete combustion".
- ^ "Carbon Monoxide Poisoning". 8 December 2020.
- ^ "A Perfect Storm: Mulch Fire Dynamics and Prevention". Soilandmulchproducernews.com. Retrieved 2018-07-12.
- ^ 우주왕복선-미르 역사/과학/미중력/미중력의 촛불 불꽃(CFM) – MGBX.Spaceflight.nasa.gov (1999-07-16).2010-09-28에 검색되었습니다.
- ^ Bale, Christopher W.; Bélisle, Eve (8 March 2022). "Equilib-Web". Centre for Research in Computational Thermochemistry, Polytechnique Montreal. Retrieved 15 May 2023.
- ^ 용광로 대기, 용광로 대기 및 탄소 제어에 관한 ASM 위원회, Metals Park, OH [1964].
- ^ "Exothermic atmospheres". Industrial Heating: 22. June 2013. Retrieved 5 July 2013.
- ^ [1]엑소칼크
- ^ "Reaction-Web". Crct.polymtl.ca. Retrieved 2018-07-12.
- ^ a b Bradley, D (2009-06-25). "Combustion and the design of future engine fuels". Proceedings of the Institution of Mechanical Engineers, Part C: Journal of Mechanical Engineering Science. 223 (12): 2751–2765. doi:10.1243/09544062jmes1519. S2CID 97218733.
- ^ "Calculating the heat of combustion for natural gas". Industrial Heating: 28. September 2012. Retrieved 5 July 2013.
- ^ [2]히트캘크
- ^ "Making a material balance". Industrial Heating: 20. November 2012. Retrieved 5 July 2013.
- ^ [3]맛발칼크
- ^ "Making a heat balance". Industrial Heating: 22. December 2012. Retrieved 5 July 2013.
- ^ [4]열발칼크
- ^ "Available combustion heat". Industrial Heating: 22. April 2013. Retrieved 5 July 2013.
- ^ [5]AvailHeatCalc
- ^ "Making a system balance (Part 2)". Industrial Heating: 24. March 2012. Retrieved 5 July 2013.
- ^ [6]SysBalCalc2
- ^ "Making a system balance (Part 1)". Industrial Heating: 22. February 2012. Retrieved 5 July 2013.
- ^ [7]SysBalCalc
- ^ Law, C.K. (2006). Combustion Physics. Cambridge, UK: Cambridge University Press. ISBN 9780521154215.
- ^ Goussis, D.; Maas, U. (2011). Turbulent Combustion Modeling. Springer Science. pp. 193–220.
- ^ Chiavazzo, Eliodoro; Karlin, Ilya (2011). "Adaptive simplification of complex multiscale systems". Phys. Rev. E. 83 (3): 036706. arXiv:1011.1618. Bibcode:2011PhRvE..83c6706C. doi:10.1103/PhysRevE.83.036706. PMID 21517624. S2CID 7458232.
- ^ Chiavazzo, Eliodoro; Asinari, Pietro; Visconti, Filippo (2011). "Fast computation of multi-scale combustion systems". Phil. Trans. Roy. Soc. A. 369 (1945): 2396–2404. arXiv:1011.3828. Bibcode:2011RSPTA.369.2396C. doi:10.1098/rsta.2011.0026. PMID 21576153. S2CID 14998597.
- ^ Chiavazzo, Eliodoro (2012). "Approximation of slow and fast dynamics in multiscale dynamical systems by the linearized Relaxation Redistribution Method". Journal of Computational Physics. 231 (4): 1751–1765. arXiv:1102.0730. Bibcode:2012JCoPh.231.1751C. doi:10.1016/j.jcp.2011.11.007. S2CID 16979409.
- ^ Kooshkbaghi, Mahdi; Frouzakis, E. Christos; Chiavazzo, Eliodoro; Boulouchos, Konstantinos; Karlin, Ilya (2014). "The global relaxation redistribution method for reduction of combustion kinetics" (PDF). The Journal of Chemical Physics. 141 (4): 044102. Bibcode:2014JChPh.141d4102K. doi:10.1063/1.4890368. PMID 25084876. S2CID 1784716. Archived (PDF) from the original on 2022-10-09.
- ^ Maas, U.; Pope, S.B. (1992). "Simplifying chemical kinetics: intrinsic low-dimensional manifolds in composition space". Combust. Flame. 88 (3–4): 239–264. doi:10.1016/0010-2180(92)90034-m.
- ^ Bykov, V.; Maas, U (2007). "The extension of the ILDM concept to reaction–diffusion manifolds". Combust. Theory Model. 11 (6): 839–862. Bibcode:2007CTM....11..839B. doi:10.1080/13647830701242531. S2CID 120624915.
- ^ Nafe, J.; Maas, U. (2002). "A general algorithm for improving ILDMs". Combust. Theory Model. 6 (4): 697–709. Bibcode:2002CTM.....6..697N. doi:10.1088/1364-7830/6/4/308. S2CID 120269918.
- ^ Ren, Z.; Pope, S.B.; Vladimirsky, A.; Guckenheimer, J.M. (2006). "The invariant constrained equilibrium edge preimage curve method for the dimension reduction of chemical kinetics". J. Chem. Phys. 124 (11): 114111. Bibcode:2006JChPh.124k4111R. doi:10.1063/1.2177243. PMID 16555878.
- ^ Lebiedz, D (2010). "Entropy-related extremum principles for model reduction of dissipative dynamical systems". Entropy. 12 (4): 706–719. Bibcode:2010Entrp..12..706L. doi:10.3390/e12040706.
- ^ Reinhardt, V.; Winckler, M.; Lebiedz, D. (112). "Approximation of slow attracting manifolds in chemical kinetics by tra trjectory-based optimization approaches" (PDF). J. Phys. Chem. A. 112 (8): 1712–1718. Bibcode:2008JPCA..112.1712R. doi:10.1021/jp0739925. PMID 18247506. Archived (PDF) from the original on 2022-10-09.
- ^ Lam, S.H.; Goussis, D. (1991). Conventional Asymptotic and Computational Singular Perturbation for Symplified Kinetics Modelling. Berlin: Springer.
- ^ Valorani, M.; Goussis, D.; Najm, H.N. (2005). "Higher order corrections in the approximation of low-dimensional manifolds and the construction of simplified problems with the csp method". J. Comput. Phys. 209 (2): 754–786. Bibcode:2005JCoPh.209..754V. doi:10.1016/j.jcp.2005.03.033.
- ^ Keck, J.C.; Gillespie, D. (1971). "Rate-controlled partial-equilibrium method for treating reacting gas mixtures". Combust. Flame. 17 (2): 237–241. doi:10.1016/S0010-2180(71)80166-9.
- ^ Chiavazzo, Eliodoro; Karlin, Ilya (2008). "Quasi-equilibrium grid algorithm: geometric construction for model reduction". J. Comput. Phys. 227 (11): 5535–5560. arXiv:0704.2317. Bibcode:2008JCoPh.227.5535C. doi:10.1016/j.jcp.2008.02.006. S2CID 973322.
- ^ Valorani, M.; Paolucci, S. (2009). "The G-Scheme: a framework for multi-scale adaptive model reduction". J. Comput. Phys. 228 (13): 4665–4701. Bibcode:2009JCoPh.228.4665V. doi:10.1016/j.jcp.2009.03.011.
- ^ Chiavazzo, Eliodoro; Karlin, Ilya; Gorban, Alexander (2010). "The role of thermodynamics in model reduction when using invariant grids" (PDF). Commun. Comput. Phys. 8 (4): 701–734. Bibcode:2010CCoPh...8..701C. CiteSeerX 10.1.1.302.9316. doi:10.4208/cicp.030709.210110a. Archived (PDF) from the original on 2022-10-09.
- ^ Chiavazzo, Eliodoro; Karlin, Ilya; Frouzakis, Christos E.; Boulouchos, Konstantinos (2009). "Method of invariant grid for model reduction of hydrogen combustion". Proceedings of the Combustion Institute. 32: 519–526. arXiv:0712.2386. doi:10.1016/j.proci.2008.05.014. S2CID 118484479.
- ^ Chiavazzo, Eliodoro; Karlin, Ilya; Gorban, Alexander; Boulouchos, Konstantinos (2010). "Coupling of the model reduction technique with the lattice Boltzmann method for combustion simulations". Combust. Flame. 157 (10): 1833–1849. doi:10.1016/j.combustflame.2010.06.009.
- ^ Reyes, J.A.; Conesa, J.A.; Marcilla, A. (2001). "Pyrolysis and combustion of polycoated cartons recycling. kinetic model and ms analysis". Journal of Analytical and Applied Pyrolysis. 58–59: 747–763. doi:10.1016/S0165-2370(00)00123-6.
- ^ "Adiabatic flame temperature". Industrial Heating: 20. May 2013. Retrieved 5 July 2013.
- ^ [8]AFT칼크
- ^ 존 윌리엄 스트럿(John William Strutt), 제3대 레일리 남작, F.R.S., 케임브리지 트리니티 칼리지 명예 연구원; "소리의 이론", §322h, 1878:
- ^ A. A. Putnam and W. C. Dennis (1953) "불꽃으로 채워진 관에서 기관-파이프 진동", 연소에 관한 제4차 심포지엄 (국제), 연소 연구소, pp. 566-574.
- ^ E. C. 페르난데스와 M. V. 하이터, F.에서 "불안정한 화염과 레일리 기준"Culick, M. V. Heitor, J. H. Whiteaw, ed.s, 불안정 연소(Dordrecht, 네덜란드: Kluwer Academic Publishers, 1996), p. 4
- ^ 다울링, A. P. (2000a)"승리, 소리, 불꽃 – 피해를 주는 조합."The Aeronautical Journal of the RaeS
- ^ Chrystie, Robin S. M.; Burns, Iain S.; Kaminski, Clemens F. (2013). "Temperature Response of an Acoustically Forced Turbulent Lean Premixed Flame: A Quantitative Experimental Determination". Combustion Science and Technology. 185: 180–199. doi:10.1080/00102202.2012.714020. S2CID 46039754.
추가열람
- Poinsot, Thierry; Veynante, Denis (2012). Theoretical and Numerical Combustion (3rd ed.). European Centre for Research and Advanced Training in Scientific Computation.
- Lackner, Maximilian; Winter, Franz; Agarwal, Avinash K., eds. (2010). Handbook of Combustion, 5 volume set. Wiley-VCH. ISBN 978-3-527-32449-1.
- Baukal, Charles E., ed. (1998). Oxygen-Enhanced Combustion. CRC Press.
- Glassman, Irvin; Yetter, Richard. Combustion (Fourth ed.).
- Turns, Stephen (2011). An Introduction to Combustion: Concepts and Applications.
- Ragland, Kenneth W; Bryden, Kenneth M. (2011). Combustion Engineering (Second ed.).
- Baukal, Charles E. Jr, ed. (2013). "Industrial Combustion". The John Zink Hamworthy Combustion Handbook: Three-Volume Set (Second ed.).
- Gardiner, W. C. Jr (2000). Gas-Phase Combustion Chemistry (Revised ed.).














