불꽃
Flame불꽃은 (라틴 플라마의) 눈에 보이는 가스 부분이에요.그것은 얇은 [1]구역에서 일어나는 높은 발열성 화학 반응에 의해 발생한다.불꽃이 충분한 밀도의 가스 성분을 이온화할 수 있을 정도로 뜨거우면 [vague][2]플라즈마로 간주됩니다.
메커니즘
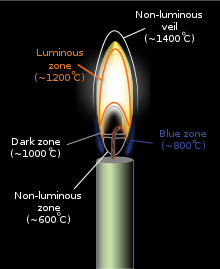
불꽃의 색상과 온도는 연소에 관련된 연료의 종류에 따라 달라집니다. 예를 들어 라이터를 촛불에 고정하는 경우입니다.적용된 열은 촛불 왁스의 연료 분자를 증발시킵니다(이 과정이 산화제가 없는 비활성 대기에서 발생하는 경우 열분해라고 합니다).이 상태에서 공기 중의 산소와 쉽게 반응할 수 있으며, 이는 후속 발열 반응에서 충분한 열을 방출하여 더 많은 연료를 증발시켜 일관된 불꽃을 유지합니다.화염의 고온으로 인해 기화된 연료 분자가 분해되어 다양한 불완전 연소 생성물 및 유리기가 형성되고, 이러한 생성물은 서로 반응하며, 다음 화염(불)의 반응과 관련된 산화제와 반응합니다.차가운 금속 [4]스푼을 사용하여 촛불에서 불꽃의 모든 다른 부분을 조사할 수 있습니다.더 높은 부분은 연소의 결과인 수증기이고, 가운데 노란색 부분은 그을음이며, 촛불 심지 바로 옆에는 타지 않은 왁스가 있습니다.금세공인들은 금과 은을 녹이기 위해 금속 송풍관이 있는 불꽃의 높은 부분을 사용한다.화염의 충분한 에너지는 메틸리딘 라디칼(CH)과 이원자 탄소(C2)와 같은 일부 과도 반응 중간체의 전자를 자극할 것이며, 이러한 물질들이 과도한 에너지를 방출할 때 가시광선의 방출을 초래합니다(아래의 특정 라디칼 종에 대한 설명은 스펙트럼 참조).특정 색상)을 클릭합니다.불꽃의 연소 온도가 상승함에 따라(불꽃에 미연소 탄소 또는 기타 물질의 작은 입자가 포함된 경우), 불꽃에 의해 발생하는 전자파 방사선의 평균 에너지도 상승합니다(검은색 본체 참조).
불꽃을 일으키기 위해 산소 외에 다른 산화제를 사용할 수 있다.염소에서 수소를 연소시키면 불꽃이 발생하며, 이 과정에서 연소 [5]생성물로 염화수소(HCl)가 방출된다.다른 가능한 화학 조합 중 하나는 히드라진과 사산화질소인데, 이것은 과당량이고 로켓 엔진에 일반적으로 사용된다.불소고분자는 예를 들어 마그네슘/테프론/비톤 조성물에서 금속 연료의 산화제로 불소를 공급하기 위해 사용될 수 있다.
화염에서 발생하는 화학 동력은 매우 복잡하고 전형적으로 많은 화학 반응과 중간 종(대부분 라디칼)을 포함합니다.예를 들어, 잘 알려진 화학 동역학 체계인 GRI-Mech는 [6]바이오가스의 연소를 설명하기 위해 53종과 325개의 기본 반응을 사용한다.
연소에 필요한 구성 요소를 화염에 분배하는 방법은 여러 가지가 있습니다.확산 불꽃에서는 산소와 연료가 서로 확산됩니다. 불꽃은 서로 만나는 곳에서 발생합니다.미리 혼합된 불꽃에서는 산소와 연료가 미리 혼합되어 다른 유형의 불꽃이 발생합니다.촛불 불꽃(확산 불꽃)은 연료의 증발을 통해 작동하며, 연료는 뜨거운 가스의 층류에서 상승한 다음 주변 산소와 혼합되어 연소됩니다.
색.
불꽃 색상은 여러 요인에 따라 달라지며, 가장 중요한 것은 일반적으로 흑체 방사선과 스펙트럼 대역 방출이며, 스펙트럼 라인 방출과 스펙트럼 라인 흡수는 작은 역할을 한다.가장 일반적인 유형의 불꽃인 탄화수소 불꽃에서 색을 결정하는 가장 중요한 요소는 산소 공급과 연료-산소 사전 혼합 범위이며, 연소 속도를 결정하여 온도 및 반응 경로를 결정하여 다른 색조를 생성합니다.
정상 중력 조건의 실험실에서 공기 흡입구가 닫힌 상태에서 분젠 버너는 약 2,000K(3,100°F)의 피크 온도에서 노란색 불꽃(안전 불꽃이라고도 함)으로 연소됩니다.노란색은 화염에서 생성되는 매우 미세한 그을음 입자의 발화로 인해 발생합니다.또한 일산화탄소가 생성되어 불꽃이 닿는 표면에서 산소를 흡수하는 경향이 있습니다.공기 흡입구를 열면 그을음과 일산화탄소가 적게 생성됩니다.충분한 공기가 공급되면 그을음이나 일산화탄소가 발생하지 않고 불꽃이 파란색으로 변합니다.(이 파란색의 대부분은 이전에는 밝은 노란색의 방출로 인해 가려져 있었습니다.)오른쪽의 미리 혼합된(완전 연소) 부탄 불꽃의 스펙트럼은 특히 파란색이 가시 스펙트럼의 파란색과 녹색 영역에서 565나노미터 이하의 들뜬 분자 라디칼을 방출하기 때문에 발생한다는 것을 보여준다.
확산(불완전 연소) 불꽃의 차가운 부분은 적색이며, 온도가 상승함에 따라 주황색, 노란색 및 흰색으로 바뀝니다. 이는 흑체 방사선 스펙트럼의 변화로 입증됩니다.특정 불꽃 영역의 경우 이 눈금이 흰색에 가까울수록 불꽃의 단면이 더 뜨겁습니다.이러한 변화는 종종 연료에 가장 가까운 곳에서 방출되는 색이 흰색이고 그 위에 주황색 부분이 있고 무엇보다도 [7]붉은 불꽃이 가장 높은 화재에서 두드러집니다.푸른 빛깔의 불꽃은 그을음의 양이 감소하고 들뜬 분자 라디칼에서 나오는 푸른빛의 방출이 지배적일 때만 나타나지만, 공기 중의 그을음이 [8]덜 집중된 촛불의 밑부분 근처에서는 종종 파란색을 볼 수 있다.
발광 스펙트럼 라인이 밝은 들뜨기 쉬운 종을 도입함으로써 불꽃에 특정 색을 부여할 수 있다.분석 화학에서 이 효과는 일부 금속 이온의 존재를 확인하기 위해 불꽃 테스트에 사용됩니다.폭약학에서는 폭약 착색제가 밝은 색상의 불꽃을 만드는 데 사용됩니다.
온도
불꽃의 온도를 볼 때 변화하거나 적용할 수 있는 많은 요인이 있습니다.중요한 것은 불꽃의 색이 반드시 온도 비교를 결정하는 것은 아니라는 것입니다. 왜냐하면 흑체 복사가 보이는 색을 생성하거나 결정하는 유일한 것이 아니기 때문입니다. 따라서 그것은 단지 온도의 추정일 뿐입니다.온도를 결정하는 다른 요인은 다음과 같습니다.
- 단열 불꽃, 즉 대기에 대한 열 손실이 없음(특정 부분에 따라 다를 수 있음)
- 기압
- 대기 중 산소 함량 백분율
- 사용되는 연료의 종류(즉, 프로세스가 얼마나 빨리 발생하는지, 연소가 얼마나 격렬한지에 따라 다름)
- 연료의 산화
- 대기 온도는 단열 화염 온도로 연결됨(즉, 열이 더 차가운 대기로 더 빨리 전달됨)
- 연소 프로세스가 얼마나 화학적으로 측정되는지(1:1 화학적으로 측정) 분해가 가장 높은 화염 온도를 가지지 않는다고 가정합니다. 과도한 공기/산소는 연소 프로세스를 낮추어 공기/산소가 부족할 것입니다.
- 화염원으로부터의 거리(즉, 화염원으로부터 멀어질수록 온도가 낮아짐)
화재(특히 주택 화재)에서, 차가운 불은 종종 붉은색을 띠며 가장 많은 연기를 발생시킨다.여기서 불꽃의 전형적인 노란색에 비해 붉은색은 온도가 낮다는 것을 암시한다.이는 실내에 산소가 부족하여 불완전 연소가 발생하고 화염 온도가 600~850°C(1,112~1,562°F)에 불과한 경우가 많기 때문입니다.즉, 많은 일산화탄소(인화성 가스)가 형성되어 역류 위험이 가장 큽니다.이 경우 자연 연소의 섬광점 이상의 가연성 가스가 산소에 노출되고 일산화탄소 및 과열된 탄화수소가 연소하며 최대 2,000°C(3,630°F)의 일시적인 온도가 발생합니다.[citation needed]
공통 온도
이 문서는 1atm에서 다양한 일반적인 물질(20°C(68°F) 공기 내)의 화염 온도에 대한 대략적인 안내서입니다.압력):
| 재료 연소 | 화염 온도 |
|---|---|
| 부탄 | 300°C(~600°F)까지 [저중력 [9]시 시원한 불꽃] |
| 숯불 | 750~1,200 °C (1,382~2,192 °F) |
| 메탄(천연가스) | 900 ~ 1,500 °C (1,652 ~2,732 °F) |
| 분젠 버너 불꽃 | 900~1,600°C(1,652~2,912°F) [공기 밸브에 따라 열림 또는 닫힘] |
| 촛불의 불꽃 | 1,100 °C (2 2,012 °F)[주요] 핫스팟은 1,300 ~ 1,400 °C (2,372 ~ 2,552 °F)일 수 있습니다. |
| 프로판 블로우토치 | 1,200 ~ 1,700 °C (2,192 ~3,092 °F) |
| 역류 화염 피크 | 1,700 ~ 1,950 °C (3,092 ~3,542 °F) |
| 마그네슘 | 1,900 ~ 2,300 °C (3,452 ~4,172 °F ) |
| 수소 토치 | 최대 2,000 °C (최대 3,632 °F) |
| MAPP 가스 | 2,020°C(3,668°F) |
| 아세틸렌 블로우 램프/블로우토치 | 최대 2,300 °C (최대 4,172 °F) |
| 옥시아세틸렌 | 최대 3,300 °C (5,972 °F) |
| 재료 연소 | 최대 화염 온도(공기 중, 확산 화염)[7] |
|---|---|
| 동물성 지방 | 800~900°C(1,472~1,652°F) |
| 등유 | 990 °C (1,814 °F) |
| 휘발유. | 1,026 °C (1,878.8 °F) |
| 나무 | 1,027 °C (1,880.6 °F) |
| 메탄올 | 1,200 °C (2,192 °F) |
| 숯(강제 드래프트) | 1,390 °C (2,534 °F) |
최고 온도
디시아노아세틸렌은 화학식42 CN을 가진 탄소와 질소의 화합물로서 5,260K(4,990°C;9010°F)의 온도와 최대 6000K(5,730°C;10,340°F)의 [10]오존에서 밝은 청백색 불꽃과 함께 산소에서 연소합니다.이러한 높은 화염 온도는 부분적으로 연료에 수소가 없기 때문에(디시아노아세틸렌은 탄화수소가 아니다) 연소 생성물 사이에 물이 없기 때문이다.
시안화합물(CN)2은 산소 [11][12]속에서 연소할 때 4,525°C(8,177°F) 이상의 온도에서 두 번째로 뜨거운 천연 불꽃을 생성합니다.
시원한 불꽃
120°C(248°F)의 낮은 온도에서 연료-공기 혼합물은 화학적으로 반응하여 차가운 불꽃이라고 불리는 매우 약한 불꽃을 만들 수 있습니다.이 현상은 1817년 험프리 데이비에 의해 발견되었다.프로세스는 온도와 반응 혼합물의 농도의 미세한 균형에 따라 달라지며, 조건이 적절할 경우 외부 점화원 없이도 시작할 수 있습니다.화학 물질의 균형, 특히 반응하는 중간 제품의 주기적 변화는 불꽃에서 약 100°C(212°F)의 일반적인 온도 변화 또는 "냉각"과 완전 점화 사이의 진동을 일으킨다.때때로 그 변화는 [9][13]폭발로 이어질 수 있다.
미소 중력 중

2000년, NASA의 실험은 중력이 불꽃 형성과 [14]구성에 간접적인 역할을 한다는 것을 확인했다.정상 중력 조건 하에서 불꽃의 일반적인 분포는 대류에 의존합니다. 그을음은 불꽃의 꼭대기까지 올라가고(정상 중력 조건의 촛불 등) 노란색이 되기 때문입니다.미중력 또는 무중력 환경(예: 궤도)에서는 자연 대류가 더 이상 발생하지 않고 불꽃이 구형이 되어 더 푸르고 효율적인 경향이 있습니다.이 차이에 대한 몇 가지 가능한 설명이 있는데, 그 중 가장 가능성이 높은 것은 온도가 충분히 균일하게 분포되어 그을음이 형성되지 않고 완전한 연소가 [15]일어난다는 가설입니다.NASA의 실험에 따르면, 미세 중력에서의 확산 불꽃은 지구에서의 확산 불꽃보다 생성된 후에 더 많은 그을음이 완전히 산화되는 것을 허용하는데, 이는 일반 중력 [16]조건과 비교했을 때 미세 중력에서의 작용이 다른 일련의 메커니즘 때문이다.이러한 발견은 응용 과학 및 민간 산업, 특히 연료 효율과 관련하여 잠재적으로 적용될 수 있다.
열핵 화염
불꽃은 화학 에너지 방출에 의해서만 구동될 필요는 없습니다.별의 경우, 가벼운 핵(탄소나 헬륨 등)을 태워서 무거운 핵(철족까지)을 태우는 아음속 연소 전선은 화염으로 전파됩니다.이것은 Ia형 초신성의 일부 모델에서 중요합니다.열핵 화염에서는 열전도가 종의 확산을 지배하기 때문에 불꽃의 속도와 두께는 열핵 에너지 방출과 열전도율에 의해 결정됩니다(종종 퇴화 [17]전자의 형태로).
「 」를 참조해 주세요.
레퍼런스
- ^ Law, C. K. (2006). "Laminar premixed flames". Combustion physics. Cambridge, England: Cambridge University Press. p. 300. ISBN 0-521-87052-6.
- ^ "Do flames contain plasma?". Science Questions with Surprising Answers. Retrieved 26 June 2022.
- ^ 슈정가, 리니, 화웨이류, 화이춘저우의 초분광 이미징 기법을 이용한 촛불의 온도분포 및 방사율 측정
- ^ Ghostarchive 및 Wayback Machine에서 아카이브:
- ^ "Reaction of Chlorine with Hydrogen". Archived from the original on 20 August 2008.
- ^ Gregory P. Smith; David M. Golden; Michael Frenklach; Nigel W. Moriarty; Boris Eiteneer; Mikhail Goldenberg; C. Thomas Bowman; Ronald K. Hanson; Soonho Song; William C. Gardiner Jr.; Vitali V. Lissianski; Zhiwei Qin. "GRI-Mech 3.0". Archived from the original on 29 October 2007. Retrieved 8 November 2007.
- ^ a b Christopher W. Schmidt; Steve A. Symes (2008). The analysis of burned human remains. Academic Press. pp. 2–4. ISBN 978-0-12-372510-3.
- ^ Jozef Jarosinski; Bernard Veyssiere (2009). Combustion Phenomena: Selected Mechanisms of Flame Formation, Propagation and Extinction. CRC Press. p. 172. ISBN 978-0-8493-8408-0.
- ^ a b Pearlman, Howard; Chapek, Richard M. (24 April 2000). "Cool Flames and Autoignition in Microgravity". NASA. Archived from the original on 1 May 2010. Retrieved 13 May 2010.
- ^ Kirshenbaum, A. D.; A. V. Grosse (May 1956). "The Combustion of Carbon Subnitride, NC4N, and a Chemical Method for the Production of Continuous Temperatures in the Range of 5000–6000°K". Journal of the American Chemical Society. 78 (9): 2020. doi:10.1021/ja01590a075.
- ^ Thomas, N.; Gaydon, A. G.; Brewer, L. (1952). "Cyanogen Flames and the Dissociation Energy of N2". The Journal of Chemical Physics. 20 (3): 369–374. Bibcode:1952JChPh..20..369T. doi:10.1063/1.1700426.
- ^ J. B. Conway; R. H. Wilson Jr.; A. V. Grosse (1953). "The Temperature of the Cyanogen-Oxygen Flame". Journal of the American Chemical Society. 75 (2): 499. doi:10.1021/ja01098a517.
- ^ Jones, John Clifford (September 2003). "Low temperature oxidation". Hydrocarbon process safety: a text for students and professionals. Tulsa, OK: PennWell. pp. 32–33. ISBN 978-1-59370-004-1.
- ^ 극미중력의 소용돌이 불꽃 2010년 3월 19일 미국항공우주국 웨이백 머신에 보관, 2000년.
- ^ 초중력의 촛불 2011년 10월 26일 웨이백 머신에 보관.NASA
- ^ C. H. 김 외층상 그을음 프로세스 실험 화염 방사선에 대한 조명 2014년 1월 11일 웨이백 머신에 보관.NASA, HTML, Wayback Machine에 2012년 7월 20일 아카이브 완료
- ^ Timmes, F. X.; Woosley, S. E. (1 September 1992). "The conductive propagation of nuclear flames. I - Degenerate C + O and O + Ne + Mg white dwarfs". The Astrophysical Journal. 396: 649–667. Bibcode:1992ApJ...396..649T. doi:10.1086/171746.
외부 링크
- 이온을 가진 불꽃에 의해 전계의 영향을 강하게 받아 이동하는 촛불 불꽃.
- 초저배출 저스월 버너
- 7가지 불의 그림자
- Licence, Peter. "Coloured Flames". The Periodic Table of Videos. University of Nottingham.