토고토바이러스
Thogotovirus| 토고토바이러스 | |
|---|---|
 | |
| 부르봉 바이러스의 전자 마이크로그래프(척도 막대: 100nm) | |
| 바이러스 분류 | |
| (랭킹되지 않음): | 바이러스 |
| 영역: | 리보비리아 |
| 킹덤: | 오르토나비라과 |
| 망울: | 네가나비리코타 |
| 클래스: | 인스토비리케테스속 |
| 순서: | 아르쿨라비르목 |
| 패밀리: | 오르토믹소비루스과 |
| 속: | 토고토바이러스 |
| 종 | |
| 동의어[1] | |
| 토고토 유사 바이러스 | |
토고토바이러스는 포획된 RNA 바이러스의 속성으로, 바이러스 계열의 7개 제네라 중 하나이다.그들의 단일 가닥의 음의 RNA 게놈은 6, 7개의 세그먼트를 가지고 있다.족토피루스(togorotovirus)는 관절염에 의해 전염되는 바이러스인 아르보바이루스(arbovirus)로 대부분의 다른 정형외과바이러스와는[3] 구별된다. 이 경우 보통 진드기가 발생한다.투고토피루스는 진드기 세포와 척추동물 세포 모두에서 복제할 수 있다. 한 가지 아형은 모기와도 격리되어 있다.혈액을 빨아들이는 벡터에 의해 전염되는 결과는, 호흡기 방울에 의해 전염되고 보통 호흡기에 국한되는 인플루엔자 바이러스와 달리, 바이러스가 척추동물 숙주에 시스템적으로 퍼져야 한다는 것이다.[4]
The genus contains the species Thogoto thogotovirus and Dhori virus (DHOV), and the latter's subtype Batken virus, as well as the species or strains Araguari virus, Aransas Bay virus (ABV), Bourbon virus, Jos virus (JOSV) and Upolu virus (UPOV), which have yet to be confirmed by the International Committee on Taxonomy of Viruses (ICTV).광범위한 포유류들은 그 속의 구성원들에 의해 감염된다; 어떤 종류들은 또한 새들을 감염시킨다.THOV는 가축에게 질병을 일으킨다.THOV, DHOV, 부르봉 바이러스는 인간을 감염시킬 수 있으며, 때때로 인간의 질병과 연관되어 왔다.
역사
THOV와 DHOV는 1960년대 초 케냐와 인도에서 각각 확인되었다.[5][6]1966년 THOV와 관련된 2건의 인간 질병이 발생했고, 1980년대 러시아 실험실 사고는 DHOV도 인간에게 질병을 일으킬 수 있다는 것을 보여주었다.[7][8]이 두 바이러스는 원래 번야비루스로 여겨졌으나 1980년대와 1990년대 초반의 특성화로 인플루엔자 바이러스와 유사성이 드러났다.[9][10]Orthomyxovirdae 내의 "토고토 유사 바이러스"의 속은 1995년에 제안되었고, 이듬해 ICTV에 의해 Togotovirus라는 이름으로 인식되었다.[11][12]이 이름은 THOV가 처음 발견된 케냐의 토고토 숲에서 유래되었다.[13]그 이후 1960~70년대에 발견되었으나 분야비르과에 분류되지 않거나 잠정적으로 할당된 5개의 바이러스에 대한 시퀀스 분석은 그들이 속종의 추가 구성원으로 제안되는 결과를 가져왔다.[2][9][14][15]2014년 차세대 염기서열 분석에서 추가로 제안된 속 구성원이 특징지어졌다.[7]
바이러스학
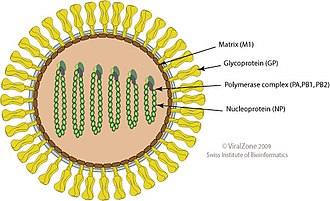
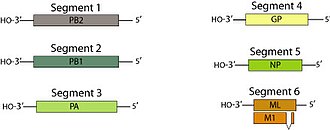
바이러스 입자가 감춰져 있다.일반적으로 구면 또는 난형이며, 직경은 80-120nm 범위에 있다.[16]일부 필라멘트 형태는 THOV, Batken 및 Bourbon 바이러스에서 관찰된다.[7][9][17]단일 가닥의 –RNA 게놈은 선형적이고 세분화되어 있으며, 6개 또는 7개의 세그먼트가 0.9–2.3kb이고 총 크기는 약 10kb이다.[16][18]한 개 이상의 토고토바이러스에 실험적으로 감염된 진드기와 포유류 모두에서 균주 사이의 세그먼트 재배치가 관찰되었지만, 자연 감염에서 그 중요성은 알려져 있지 않다.[19]
바이러스성 단백질
게놈은 바이러스 게놈을 묶는 트리메릭 RNA 폴리머아제 효소(PA, PB1, PB2)와 구조 단백질 뉴클레오프로틴(NP), 봉투에 선을 긋는 매트릭스 단백질(M1)과 바이러스 수용체 역할을 하는 봉투 당단백질(GP) 등 7~9개 단백질을 암호화하고 있다.[15][16]
토고토바이러스 당코프로틴은 인플루엔자 바이러스 당코프로틴(해마그글루틴, 뉴라미디아제)과 비슷하지 않고, 대신 곤충을 감염시키는 바쿨로비루스의 gp64 당코프로틴과 일부 유사성을 보인다.[4][15][20]또한 진드기 전이된 정형외과바이러스 콰르만자바이러스의 관련 속 콰르만필 바이러스의 해마글루틴과 어느 정도 유사하다.[21]도토피루스가 바쿨로바이러스 같은 당단백질을 얻은 메커니즘은 알려져 있지 않다.Pat Nuttall과 동료들은 이번 인수로 인해 이러한 바이러스들이 진드기를 감염시킬 수 있었다고 추측했다.[22]절지동물 세포에 대한 이러한 명백한 수용체 특이성은 대부분의 혈우토피루스가 척추동물을 감염시키는 것을 막지는 못한다.[15]투고토바이러스 글리코프로틴은 인플루엔자 헤마글루틴(lass I 또는 α 침투렌)에 존재하는 융복합 펩타이드 성분이 결핍된 3등급 또는 γ 침투렌으로 분류된다.[23]
THOV와 JOSV도[2] 특히 인터페론의 생성을 억제하여 숙주의 선천적 면역력에 대항하는 단백질 M-롱(ML)을 인코딩한다.이 면역 회피는 척추동물에서 바이러스가 조직적으로 감염되려면 중요하지만 인터페론 반응이 부족한 절지동물에서는 불필요하다.ML의 작용 메커니즘은 인플루엔자 바이러스(NS1)에서 동등한 단백질과 완전히 다르다.[15][16][24][25]
모든 Orthomyxovirus에서와 같이, 가장 큰 3개 세그먼트(1–3)는 RNA 중합효소의 3개 서브유닛을 인코딩한다.Togotovirus에서, 세그먼트 4는 당단백질을 암호화하고 세그먼트 5는 뉴클레오프로틴을 암호화한다.세그먼트 6의 메신저 RNA(mRNA)는 분할하여 매트릭스 단백질을 인코딩하거나 미채취하여 ML을 인코딩할 수 있으며, ML은 C-terminus에 38개의 추가 아미노산이 있다.[4][15][16][18]DHOV에서 관찰된 7번째 세그먼트에 대해 아직 어떤 제품도 식별되지 않았다.[18]
라이프 사이클
척추동물 숙주세포의 수용체는 바이러스 당단백질에 의해 결합되는 시알산이다.입구는 내분비증에 의해 이루어지며, 일단 베실체가 산성화되면 바이러스 및 세포막의 융합이 일어난다.다른 정형외과와 마찬가지로 바이러스 전사와 복제는 모두 세포핵에서 발생한다.[15][16]일부 속에서는 복제가 생쥐와 인간에게 인터페론에 반응하여 유도되는 Mx1/MxA 단백질에 민감한 것으로 나타났다.[9][26]한 연구에서, 이러한 억제 효과는 MxA가 THOV 게놈의 핵으로의 이동을 방해하여 발생하는 것으로 나타났다.[27]
정형외과수술은 캡핑 효소를 인코딩하지 않기 때문에, 전사의 시작은 바이러스가 호스트 mRNA의 5인치 끝에서 캡을 자르는 것을 포함하므로, mRNA는 호스트 번역 기계에 의해 인식된다.유사한 "캡처 스매칭" 과정이 다른 정형외과에서 사용되지만 훨씬 더 긴 호스트 RNA 시퀀스는 캡과 함께 분해되어 바이러스성 mRNA에 통합된다.[28][29]
그 바이러스는 세포막에 의해 조립되고 싹이 트면서 세포를 떠난다.[16]아기 햄스터 신장 세포에서 자란 THOV의 경우 바이러스 입자가 감염 후 6~8시간 후에 방출되기 시작하며, 감염 후 24시간 후에도 상당한 양이 여전히 생산된다.이 증가율은 인플루엔자 바이러스에 비해 느리고, 퀘탄필 바이러스와 더 비슷하다.[17][21]
역학
대부분의 토오도토피루스는 일반적으로 딱딱하거나 부드러운 진드기인 절지동물을 감염시키는 것으로 나타났지만,[7] 한 경우에는 곤충인 모기가 감염되었다.[9]회원들은 또한 새들과[15][30] 유대류,[14] 설치류,[4] 토끼,[31] 몽구스,[32] 말,[6] 낙타, 염소, 양, 소를 포함한 야생 및 가축의 광범위한 포유동물들을 감염시킨다.[2][32]THOV, DHOV, 부르봉 바이러스 등 세 가지 유형이 인간을 감염시키는 것으로 나타났다.[7]그들은 지리적 범위가 넓다.[7]
척추동물로의 전염은 보통 눈금 벡터를 통해 일어난다.THOV는 진드기에 지속되며, 발달 단계를 거치는 동안 유기체에 남아있다. 이것을 성간전송이라고 한다.[17]바이러스는 호스트에 첨부된 후 하루 이내에 다른 호스트로 전송될 수 있다.[33]THOV는 혈액에서 검출 가능한 수준의 바이러스가 없는 상태에서 감염되지 않은 기니피그를 동시에 먹었을 때 진드기 사이에서 전염될 수 있다.[34][35]이러한 비균질 전송은 블루통구, 크림-콩고 출혈열, 루핑병, 진드기 매개 뇌염, 복소성 구내염 바이러스, 웨스트 나일 바이러스 등 다른 주로 진드기 전달 RNA 바이러스에서도 관찰되었다.[26]호흡기 에어로졸에 의한 DHOV의 전달도 관찰되었다.[6]
숙주 상호작용 및 질병
눈금
THOV에 감염된 Ripicephalus addiculatus 틱에서는 어떠한 주요 병리학적 변화도 관찰되지 않는다.[17]이 바이러스는 수유 과정에서 초기에 승랑글리온(진드기 뇌)에 집중되는데, 수유 말기에 침샘에 위치한 바이러스 비율이 증가한다.[17][33]낮은 수준의 바이러스는 기관, 소화관, 여성 성기관에서 발견되지만 남성의 성기관이나 배설 시스템에서는 발견되지 않는다.승랑글리온에 존재하는 높은 수준의 바이러스는 신경계가 다른 시스템에 비해 리모델링을 덜 받기 때문에 진드기의 변형을 통해 바이러스가 지속되도록 하기 위해 제안되었다.[17]
척추동물
실험실 환경에서, 여러 종의 속은 쥐와 햄스터에 심각한 질병을 일으킨다.[5][6]바이러스의 전신 확산이 일어나며, 뇌, 간, 림프계, 때로는 폐와 소장을 포함한 여러 기관과 시스템에 병리학적 영향이 나타난다.[5][6]림프구는 DHOV의 주요 표적 세포. [6]쥐의 DHOV 감염은 인간의 치명적인 H5N1 인플루엔자 감염뿐만 아니라 쥐와 페렛의 실험 인플루엔자 감염과 유사하며, 이 질병의 모델로 제안되어 왔다.[6]
포유류에서 토고토피루스를 가진 자연적인 감염은 일반적으로 증상을 일으키지 않는 것으로 보인다.예를 들어, THOV는 양에게 열병과 낙태를 유발하는 중요한 수의학적 병원체다.[5][36][37][38][39]2015년 2월 현재, 투고토바이러스와 관련된 인간 질병은 오직 8건만 보고되었다. 2건은 THOV, 5건은 DHOV, 1건은 부르봉 바이러스였다.[7]THOV의 잠복기는 4~5일이다.[39]세 가지 바이러스 모두 발열과 관련이 있었다.또한 THOV와 DHOV는 신경학적 증상을 유발했다:[7][8][13][39] THOV의 경우 뇌막염과 신경근막염 옵티카, DHOV의 경우 뇌염.간염은 THOV와 함께 관찰되었다.[39]부르봉 바이러스에 감염된 사람의 질병은 혈소판과 백혈구의 감소와 관련이 있었다. 신경학적 증상은 관찰되지 않았다.[7]인플루엔자 같은 호흡기 증상은 보고되지 않았다.[7][8]
치료 및 예방
2015년 2월 현재, 투고토비루스에 대한 특별한 치료나 백신은 없다.일부 다른 정형외과를 포함하는 광범위한 활동 스펙트럼을 가진 항바이러스제 리바비린은 단일 연구에서 시험관내 DHOV 복제를 억제하는 것으로 나타났다.[40][41]지지요법은 THOV 질환에 사용되며,[39] 미국 질병통제예방센터(Centers for Disease Control and Prevention for Disease Control and Prevention for Bourbon virus)로부터 버번 바이러스 감염을 권고받았다.다른 아르보바이러스와 마찬가지로 벡터와의 접촉을 피하는 것이 예방의 핵심이다.[42]
종과 변종
ICTV, THOV, DHOV에 의해 두 종이 확인되었다.[43]두 바이러스는 염기서열 정체성이 낮으며(핵세포의 경우 37%, 봉투 당단백질 31%) 항체는 교차반응하지 않는다.[13]Batken 바이러스는 DHOV의 하위 유형이다.[13]2015년 2월 현재 추가로 5종이나 변종이 속주로 제안되었다.[7]
| 종/스트레인 | RNA 세그먼트 | 지름(nm) | 벡터 | 척추동물호주 | 분배 |
|---|---|---|---|---|---|
| 아라과리 | 6 | 105 | 알 수 없는 | 회색네눈주머니쥐 | S. 아메리카 |
| 아란자스 만 | 6 | 75–140 | 오르니토도로스 진드기 | 마우스 | N. 아메리카 |
| 배트켄 | 50–100 | 히알로마 진드기, 에이드, 쿠렉스 모기 | 치킨, 햄스터, 쥐 | 아시아 | |
| 부르봉 | ≥6 | ~100–130 | 알 수 없는 | 인간 | N. 아메리카 |
| 도리 | 7 | 히알로마 진드기 | 새, 토끼, 말, 인간, 쥐, 반추동물 | 아프리카, 아시아, 유럽 | |
| Jos. | ≥6 | 85–120 | 암블료마와 리피체팔루스는 간지럼을 탄다. | 쥐, 제부 | 아프리카 |
| 토고토 | 6 | 100 | 암블료마, 히알로마, 리피체팔루스가 간지럼을 탄다. | 붕대를 감은 몽구스, 당나귀, 인간, 설치류, 반추동물 | 아프리카, 아시아, 유럽 |
| 우폴루 | 6 | 75–120 | 오르니토도로스 진드기 | 마우스 | 호주. |
THOV 유사 바이러스
토고토 바이러스(TOV)
THOV는 1960년 나이로비 인근 케냐의 토고토 숲 지역에서 소에서 채취한 진드기로부터 처음 격리되어 현재는 아프리카 대륙에 분포하고 있으며,[5] 유럽에서는 이탈리아와 포르투갈, 중동에서는 이란에서도 발견되고 있다.[19][31][44]이 넓은 지리적 범위에도 불구하고, 바이러스는 제한된 변화만을 보여준다.[44]그것의 벡터에는 암블료마, 히알로마, 히피체팔루스를 포함한 다양한 단단한 진드기가 포함되어 있다.[5][13][19][31][45]
쥐와 염소, 양, 당나귀, 낙타, 소, 버팔로 등 많은 가축에서 THOV에 항체가 발견되었으며, 이 바이러스는 야생 띠의 몽구스(몽고스 멍고)로부터 격리되었다.[13][32]그것은 열병과 양의 낙태를 포함한 중요한 가축 질병의 원인이 된다.[5][36][37][38]인공실험실 감염에서는 햄스터에 고병원성이 있으며 쥐도 감염시킨다.[5]이 바이러스는 자연 환경에서 인간을 감염시키는 것으로 알려져 있다.[7][31]
바이러스 입자는 일반적으로 어떤 필라멘트의 형태를 가진 구형이다; 지름은 약 100 nm이다.[17]게놈은 6개의 RNA 세그먼트를 가지고 있다.[4]
아라과리바이러스
아라과리 바이러스는 1969년 브라질 아마파 주 세라도 나비오에 있는 회색 네눈 오포섬(필란더 오포섬)에서 처음 격리됐다.[14]그것의 전송 방법은 알려져 있지 않다.[6]실험실 감염에서는 쥐에게 병원성이 있다.처녀자리 지름은 약 105 nm이다.게놈은 6개의 RNA 세그먼트를 가지고 있다.부분 시퀀스 데이터를 바탕으로 그 바이러스는 THOV와 가장 밀접한 관련이 있는 것으로 밝혀졌다.[14]
아칸소 베이 바이러스(ABV)
ABV는 1975년 미국 텍사스 남부의 바닷새 둥지에 있는 부드러운 몸체의 진드기속 오르니토도로스에서 발견되었는데, 북아메리카에서 발견된 최초의 속이다.[7][15]천연 척추동물 숙주는 확인되지 않았지만, 이 바이러스는 실험실 감염에서 쥐에게 고병원성이다.바이러스 입자는 75nm × 85nm ~ 120nm × 140nm의 크기의 구면 또는 난형이다.게놈은 6개의 RNA 세그먼트를 가지고 있다.그것은 UPOV와 가장 유사하며, THOV와 JOSV와 약간 유사하다.[15]
조스 바이러스(JOSV)
JOSV는 1967년 나이지리아 조스의 제부(보스 인디쿠스)로부터 처음으로 고립되었다.이후 아프리카 여러 나라에서 암블료마(Amblyomma)와 리피체팔루스(Rhipicephalus)가 단단한 진드기를 감염시킨 것으로 밝혀졌다.실험실에서 그것은 쥐에게 심각한 병리학을 유발한다.바이러스 입자는 지름이 85–120nm인 변종, 대개 난형, 형태학을 가지고 있다.게놈은 최소 6개의 RNA 세그먼트를 포함하고 있다.[2]UPOV 및 ABV와 몇 가지 시퀀스 유사성이 있다.[15]
우폴루 바이러스(UPOV)
UPOV는 1966년 호주의 그레이트 배리어 리프의 우폴루 케이에서 처음으로 소오티테른(Onychoprion fuscatus)과 연관된 오르니토도로스 카펜시스 종의 부드러운 몸집의 진드기로부터 격리되었다.천연 척추동물 숙주는 확인되지 않았지만, 이 바이러스는 실험실 감염에서 쥐에게 고병원성이다.처녀막은 75~95nm 범위의 직경을 가진 구형 또는 약간 난형일 수 있으며 75nm × 85nm ~ 105nm × 120nm의 치수 범위를 가질 수 있다.게놈은 6개의 RNA 세그먼트를 가지고 있다.그것은 ABV와 가장 유사하며, THOV와 JOSV와 약간 유사하다.[15]
DHOV 유사 바이러스
도리바이러스(DHOV)
DHOV는 1961년 인도 구자라트에서 낙타를 자극하는 히알로마 드로메다리 경질 진드기로부터 처음 격리되었다.[6]이후 러시아 동부, 파키스탄, 이집트, 사우디아라비아, 케냐, 포르투갈 남부에서 관측되었다.벡터는 보통 H. marinatum과 같은 Hyalomma의 한 종이다.[6][13][31][46][47]
DHOV가 널리 퍼져 있는 곳에서는 낙타, 염소, 말, 소, 인간에게서 바이러스에 대한 항체가 기록되어 왔다.[6][13]그 바이러스는 야생 토끼인 레푸스 에우로페우스로부터 격리되었다.[31][48]DHOV는 실수로 실험실 노출 후 에어로졸 경로로 사람을 감염시켜 열병과 뇌염을 유발할 수 있다.[6][8][31]실험실 조건 하에서는 쥐의 고병원성이며, 고병원성 인플루엔자의 모델 시스템으로 제안되어 왔다.[6]또한 바이러스가 가마우지에서 격리되고 [49]물새에서 항체가 관찰되는 등 조류에 감염되는 것으로 나타났다.[13][15]
DHOV는 7개의 RNA 세그먼트를 가지고 있다.[13]
바트켄바이러스
바트켄 바이러스는 1970년 현재 키르기스스탄에 있는 키르기스스탄의 바트켄 마을 근처에서 양을 괴롭히는 히알로마 매실베움 종의 딱딱한 진드기에서 처음 격리되었다.[9][30]키르기스스탄에서도 에이데스 카스피우스 팔라스, 쿠렉스 호텐시스 피칼비 종 모기를 감염시킨 것으로 밝혀졌다.[50]지리적 범위는 중앙아시아, 트랜스사카시아, 카스피해 북쪽에 한정되어 있다.[50]실험실에서 쥐, 햄스터, 닭은 고병원성이다.[30]처녀막은 모양이 가변적이며 구형과 필라멘트의 형태를 관찰하고 있으며 지름이 50-100nm이다.[9]Batken은 DHOV 하위 유형으로 간주된다;[13][50] 바이러스는 높은 시퀀스 정체성(외부 당단백질에서 90%, 다른 단백질에서 96~98%)과 항체가 교차한다.
부르봉바이러스
부르봉 바이러스는 2014년 미국 캔자스주 부르봉카운티 출신의 남성이 여러 개의 진드기에 물린 지 며칠 만에 병에 걸렸고, 이후 사망하는 혈액 샘플을 차세대 염기서열로 분류해 확인했다.서반구에서 인간 질병과 연관된 것으로 알려진 유일한 토고토바이러스다.2015년 2월 현재 부르봉 바이러스는 진드기, 곤충 또는 비인간 척추동물로부터 격리되지 않고 있다.이 바이러스는 구형뿐만 아니라 필라멘트 형태로도 형태가 다양하다. 바이러스의 지름은 100-130nm의 범위에서 광범위하게 존재한다.게놈은 최소 6개의 RNA 세그먼트를 포함하고 있다.그것은 DHOV와 Batken 바이러스와 가장 비슷하다.[7]
참고 및 참조
- ^ Pringle, C. R. (1996). "Virus Taxonomy 1996 - A Bulletin from the Xth International Congress of Virology in Jerusalem" (PDF). Arch Virol. 141 (11): 2251–2256. doi:10.1007/BF01718231. PMC 7086844. PMID 8992952. Retrieved 4 June 2019.
- ^ a b c d e Bussetti AV, Palacios G, Travassos da Rosa A, et al. (2012), "Genomic and antigenic characterization of Jos virus", Journal of General Virology, 93 (2): 293–98, doi:10.1099/vir.0.035121-0, PMC 3352346, PMID 21994326
- ^ 최근 비준된 콰르만자바이러스의 구성원들도 진드기를 통해 전염된다.[2]
- ^ a b c d e Kochs G, Bauer S, Vogt C, et al. (2010), "Thogoto virus infection induces sustained type I interferon responses that depend on RIG-I-like helicase signaling of conventional dendritic cells", Journal of Virology, 84 (23): 12344–50, doi:10.1128/jvi.00931-10, PMC 2976394, PMID 20861272
- ^ a b c d e f g h Haig DA, Woodall JP, Danskin D (1965), "Thogoto virus: a hitherto undescribed agent isolated from ticks in Kenya" (PDF), Journal of General Microbiology, 38 (3): 389–94, doi:10.1099/00221287-38-3-389, PMID 14329965
- ^ a b c d e f g h i j k l m Mateo RI, Xiao SY, Lei H, DA Rosa AP, Tesh RB (2007), "Dhori virus (Orthomyxoviridae: Thogotovirus) infection in mice: a model of the pathogenesis of severe orthomyxovirus infection", American Journal of Tropical Medicine and Hygiene, 76 (4): 785–90, doi:10.4269/ajtmh.2007.76.785, PMID 17426188
- ^ a b c d e f g h i j k l m n Kosoy OI, Lambert AJ, Hawkinson DJ, Pastula DM, Goldsmith CS, Hunt DC, Staples JE (May 2015). "Novel thogotovirus associated with febrile illness and death, United States, 2014". Emerging Infect. Dis. 21 (5): 760–4. doi:10.3201/eid2105.150150. PMC 4412252. PMID 25899080.
- ^ a b c d Butenko AM, Leshchinskaia EV, Semashko IV, Donets MA, Mart'ianova LI (1987), "[Dhori virus—a causative agent of human disease. 5 cases of laboratory infection]", Voprosy Virusologii (in Russian), 32: 724–29
- ^ a b c d e f g Frese M, Weeber M, Weber F, Speth V, Haller O (1997), "Mx1 sensitivity: Batken virus is an orthomyxovirus closely related to Dhori virus", Journal of General Virology, 78 (10): 2453–58, doi:10.1099/0022-1317-78-10-2453, PMID 9349464
- ^ Clerx JP, Fuller F, Bishop DH (May 1983). "Tick-borne viruses structurally similar to Orthomyxoviruses". Virology. 127 (1): 205–19. doi:10.1016/0042-6822(83)90384-7. PMID 6858001.
- ^ ICTV 6th report (PDF), International Committee on Taxonomy of Viruses, retrieved 9 March 2015
- ^ Pringle CR, Virus Taxonomy 1996 - A Bulletin from the Xth International Congress of Virology in Jerusalem (PDF), International Committee on Taxonomy of Viruses, retrieved 9 March 2015
- ^ a b c d e f g h i j k Büchen-Osmond C, ed. (2006), "Index of Viruses - Orthomyxoviridae", ICTVdB - The Universal Virus Database, version 4, Columbia University, archived from the original on 2 April 2015, retrieved 3 July 2020
- ^ a b c d Da Silva EV, Da Rosa AP, Nunes MR, Diniz JA, Tesh RB, Cruz AC, et al. (December 2005). "Araguari virus, a new member of the family Orthomyxoviridae: serologic, ultrastructural, and molecular characterization". Am. J. Trop. Med. Hyg. 73 (6): 1050–58. doi:10.4269/ajtmh.2005.73.1050. PMID 16354811.
- ^ a b c d e f g h i j k l m Briese T, Chowdhary R, Travassos da Rosa A, et al. (2014), "Upolu virus and Aransas Bay virus, two presumptive bunyaviruses, are novel members of the family Orthomyxoviridae", Journal of Virology, 88 (10): 5298–09, doi:10.1128/jvi.03391-13, PMC 4019087, PMID 24574415
- ^ a b c d e f g "Thogotovirus", ViralZone, Swiss Institute of Bioinformatics, retrieved 6 March 2015
- ^ a b c d e f g Booth TF, Davies CR, Jones LD, Staunton D, Nuttall PA (May 1989). "Anatomical basis of Thogoto virus infection in BHK cell culture and in the ixodid tick vector, Rhipicephalus appendiculatus". J. Gen. Virol. 70 ( Pt 5) (5): 1093–104. doi:10.1099/0022-1317-70-5-1093. PMID 2543769.
- ^ a b c King AM, Adams MJ, Carstens EB, Lefkowitz EJ, eds. (2011), Virus Taxonomy: Ninth Report of the International Committee on Taxonomy of Viruses, Academic Press, p. 757
- ^ a b c Davies CR, Jones LD, Green BM, Nuttall PA (1987), "In vivo reassortment of Thogoto virus (a tick-borne influenza-like virus) following oral infection of Rhipicephalus appendiculatus ticks" (PDF), Journal of General Virology, 68 (9): 2331–38, doi:10.1099/0022-1317-68-9-2331, PMID 3655743
- ^ Morse MA, Marriott AC, Nuttall PA (1992), "The glycoprotein of Thogoto virus (a tick-borne orthomyxo-like virus) is related to the baculovirus glycoprotein GP64", Virology, 186 (2): 640–46, doi:10.1016/0042-6822(92)90030-s, PMID 1733105
- ^ a b Presti RM, Zhao G, Beatty WL, Mihindukulasuriya KA, Travassos da Rosa APA (2009), "Quaranfil, Johnston Atoll, and Lake Chad viruses are novel members of the family Orthomyxoviridae", Journal of Virology, 83 (22): 11599–606, doi:10.1128/jvi.00677-09, PMC 2772707, PMID 19726499
- ^ Allison AB, Ballard JR, Tesh RB, Brown JD, Ruder MG, Keel MK, et al. (January 2015). "Cyclic avian mass mortality in the northeastern United States is associated with a novel orthomyxovirus". J. Virol. 89 (2): 1389–403. doi:10.1128/JVI.02019-14. PMC 4300652. PMID 25392223.
- ^ Garry CE, Garry RF (2008), "Proteomics computational analyses suggest that baculovirus GP64 superfamily proteins are class III penetrenes", Virology Journal, 5: 28, doi:10.1186/1743-422x-5-28, PMC 2288602, PMID 18282283
- ^ Haller O, Kochs G, Weber F (2006), "The interferon response circuit: Induction and suppression by pathogenic viruses", Virology, 344 (1): 119–30, doi:10.1016/j.virol.2005.09.024, PMC 7125643, PMID 16364743
- ^ Thogoto virus: Molecular biology of a tick-transmitted Orthomyxovirus, Universitäts Klinikum Freiburg, retrieved 7 March 2015
- ^ a b Kuno G, Chang GJ (2005), "Biological Transmission of Arboviruses: Reexamination of and New Insights into Components, Mechanisms, and Unique Traits as Well as Their Evolutionary Trends", Clinical Microbiology Reviews, 18 (4): 608–37, doi:10.1128/cmr.18.4.608-637.2005, PMC 1265912, PMID 16223950
- ^ Kochs G, Haller O (1999), "Interferon-induced human MxA GTPase blocks nuclear import of Thogoto virus nucleocapsids", Proceedings of the National Academy of Sciences of the USA, 96 (5): 2082–86, Bibcode:1999PNAS...96.2082K, doi:10.1073/pnas.96.5.2082, PMC 26740, PMID 10051598
- ^ Leahy MB, Dessens JT, Nuttall PA (1997), "In vitro polymerase activity of Thogoto virus: evidence for a unique cap-snatching mechanism in a tick-borne orthomyxovirus.", Journal of Virology, 71 (11): 8347–51, doi:10.1128/JVI.71.11.8347-8351.1997, PMC 192294, PMID 9343188
- ^ Guilligay D, Kadlec J, Crépin T, Lunardi T, Bouvier D, et al. (2014), "Comparative structural and functional analysis of orthomyxovirus polymerase cap-snatching domains", PLOS ONE, 9 (1): e84973, Bibcode:2014PLoSO...984973G, doi:10.1371/journal.pone.0084973, PMC 3893164, PMID 24454773
- ^ a b c Lvov DK, Karas FR, Tsyrkin YM, Vargina SG, Timofeev EM, et al. (1974), "Batken virus, a new arbovirus isolated from ticks and mosquitoes in Kirghiz S.S.R.", Archiv für die gesamte Virusforschung, 44 (1): 70–73, doi:10.1007/bf01242183, PMID 4150914, S2CID 33344597
- ^ a b c d e f g Gratz N (2006), Vector- and Rodent-Borne Diseases in Europe and North America: Distribution, Public Health Burden, and Control, Cambridge University Press, pp. 108–9
- ^ a b c Ogen-Odoi A, Miller BR, Happ CM, Maupin GO, Burkot TR (March 1999), "Isolation of thogoto virus (Orthomyxoviridae) from the banded mongoose, Mongos mungo (Herpestidae), in Uganda", American Journal of Tropical Medicine and Hygiene, 60 (3): 439–40, doi:10.4269/ajtmh.1999.60.439, PMID 10466973
- ^ a b Kaufman WR, Nuttall PA (2003), "Rhipicephalus appendiculatus (Acari: Ixodidae): dynamics of Thogoto virus infection in female ticks during feeding on guinea pigs", Experimental Parasitology, 104 (1–2): 20–25, doi:10.1016/s0014-4894(03)00113-9, PMID 12932755
- ^ Jones LD, Davies CR, Steele GM, Nuttall PA (August 1987). "A novel mode of arbovirus transmission involving a nonviremic host". Science. 237 (4816): 775–7. Bibcode:1987Sci...237..775J. doi:10.1126/science.3616608. PMID 3616608.
- ^ Jones LD, Nuttall PA (1989). "Non-viraemic transmission of Thogoto virus: influence of time and distance". Trans. R. Soc. Trop. Med. Hyg. 83 (5): 712–24. doi:10.1016/0035-9203(89)90405-7. PMID 2617637.
- ^ a b Duncanson GR (2013), Farm Animal Medicine and Surgery: For Small Animal Veterinarians, CABI, p. 110
- ^ a b Maramorosch K, McIntosh AH (1994), Arthropod Cell Culture Systems, CRC Press, p. 165
- ^ a b Frese M, Kochs G, Meier-Dieter U, Siebler J, Haller O (1995), "Human MxA protein inhibits tick-borne Thogoto virus but not Dhori virus", Journal of Virology, 69 (6): 3904–09, doi:10.1128/jvi.69.6.3904-3909.1995, PMC 189115, PMID 7745744
- ^ a b c d e Berger SA, Calisher CH, Keystone JS (2003), Exotic Viral Diseases: A Global Guide, BC Decker, pp. 179–80
- ^ Sidwell RW, Huffman JH, Khare GP, Allen LB, Witkowski JT, Robins RK (August 1972), "Broad-spectrum antiviral activity of Virazole: 1-f8- D-ribofuranosyl-1,2,4-triazole-3-carboxamide", Science, 177 (4050): 705–6, Bibcode:1972Sci...177..705S, doi:10.1126/science.177.4050.705, JSTOR 1734763, PMID 4340949, S2CID 43106875
- ^ Belov AV, Larichev VF, Galkina IA, Khutoretskaia NV, Butenko AM, et al. (2008), "[In vitro activity of Russian ribavirin on the models of Crimean-Congo hemorrhagic fever virus, Rift Valley fever virus, and Tahyna and Dhori viruses]", Voprosy virusologii (in Russian), 53 (1): 34–35, PMID 18318134
- ^ "Bourbon virus", CDC website, Division of Vector-Borne Diseases, CDC, retrieved 4 March 2015
- ^ ICTV Master Species List 2014 v2, International Committee on Taxonomy of Viruses, 2014, retrieved 7 March 2015
- ^ a b Calisher CH, Karabatsos N, Filipe AR (1987), "Antigenic uniformity of topotype strains of Thogoto virus from Africa, Europe, and Asia", American Journal of Tropical Medicine and Hygiene, 37 (3): 670–73, doi:10.4269/ajtmh.1987.37.670, PMID 3688319
- ^ Sang R, Onyango C, Gachoya J, Mabinda E, Konongoi S, et al. (2006), "Tickborne arbovirus surveillance in market livestock, Nairobi, Kenya", Emerging Infectious Diseases, 12 (7): 1074–1080, doi:10.3201/eid1207.060253, PMC 3291068, PMID 16836823
- ^ Darwish MA, Hoogstraal H, Roberts TJ, Ghazi R, Amer T (1983), "A sero-epidemiological survey for Bunyaviridae and certain other arboviruses in Pakistan", Transactions of the Royal Society of Tropical Medicine and Hygiene, 77 (4): 446–50, doi:10.1016/0035-9203(83)90108-6, PMID 6415873
- ^ Al-Khalifa MS, Diab FM, Khalil GM (2007), "Man-threatening viruses isolated from ticks in Saudi Arabia", Saudi Medical Journal, 28 (12): 1864–67, PMID 18060218
- ^ L'vov DN, Dzharkenov AF, Aristova VA, Kovtunov AI, Gromashevskiĭ VL (2002), "[The isolation of Dhori viruses (Orthomyxoviridae, Thogotovirus) and Crimean-Congo hemorrhagic fever virus (Bunyaviridae, Nairovirus) from the hare (Lepus europaeus) and its ticks Hyalomma marginatum in the middle zone of the Volga delta, Astrakhan region, 2001]", Voprosy virusologii (in Russian), 47: 32–36
- ^ Iashkulov KB; Shchelkanov MIu; L'vov SS; Dzhambinov SD; Galkina IV; et al. (2008), "[Isolation of influenza virus A (Orthomyxoviridae, Influenza A virus), Dhori virus (Orthomyxoviridae, Thogotovirus), and Newcastle's disease virus (Paromyxoviridae, Avulavirus) on the Malyi Zhemchuzhnyi Island in the north-western area of the Caspian Sea]", Voprosy virusologii (in Russian), 53: 34–38
- ^ a b c Al'khovskiĭ SV; L'vov DK; Shchelkanov MIu; Shchetinin AM; Deriabin PG; et al. (2014), "[Genetic characterization of the Batken virus (BKNV) (Orthomyxoviridae, Thogotovirus) isolated from the Ixodidae ticks Hyalomma marginatum Koch, 1844 and the mosquitoes Aedes caspius Pallas, 1771, as well as the Culex hortensis Ficalbi, 1889 in the Central Asia]", Voprosy virusologii (in Russian), 59 (2): 33–37, PMID 25069283
외부 링크
| 위키피아는 토고토바이러스와 관련된 정보를 가지고 있다. |