아지드
AzideAzide는 N이라는−
3 공식을 가진 음이온이다. 하이드라조산(HN3)의 결합 베이스로, N은−
32 CO, NCO−, NO2, NO+
2, NCF가 있는 등전자의 선형 음이온이다. 발란스 본드 이론에 따르면 아지드는 여러 공명 구조로 설명할 수 있다; 한 것은 N-= += N- 아지드는 유기화학 RN의3 기능 그룹이기도 하다.[1]
아지드화물을 주로 사용하는 것은 에어백에 추진제 역할을 한다.
역사
페닐 아지드("diazoamidobenzol")는 1864년 피터 그리스에 의해 암모니아와 페닐디아조늄의 반응에 의해 준비되었다.[2][3] 1890년대에 히드라조산(HN)을3 발견한 테오도르 커티우스는 이소시아네이트에 대한 아킬 아지드화물의 재배치를 기술했고, 그 후 커티우스 재배열이라는 이름을 붙였다.[4] Rolf Huisgen은 1,3-dipolar cycloaddition을 묘사했다.[5][6]
유기화학자들 사이에서 아지드에 대한 관심은 이러한 화합물의 불안정성이 보고되었기 때문에 상대적으로 미미했다.[7] 쿠-카탈리세드(3+2)의 샤플리스 외 연구원이 유기 아지드와 말단 알키네스 사이에 사이클로아드가 검출되면서 상황은 크게 달라졌다.[8][9] 아지도-와 알카인 집단은 "생물직통적"으로, 이는 그들이 살아 있는 시스템과 상호작용하지 않는다는 것을 의미하며, 동시에 그들은 인상적으로 빠르고 선택적인 결합을 겪는다. 이러한 형식 1,3극 사이클로어데이션은 소위 '클릭 케미스트리'([10][11]아마도 비전문가에게만 알려진 화학)의 가장 유명한 예가 되었고, 유기 아지드화 분야가 폭발했다.
준비
무기 아지드화
아지드화나트륨은 산화 아산화질소의 반응에 의해 산업적으로 만들어지며, 용매로서 액체 암모니아에 아미드 나트륨을 함유한 NO2:[12]
- NO2 + 2 NaNH2 → NaN3 + NaOH + NH3
많은 무기질 아지드화물은 아지드화나트륨으로부터 직간접적으로 준비될 수 있다. 예를 들어, 기폭기에 사용되는 납 아지드는 납 질산염과 아지드화나트륨 사이의 메타텍스 반응으로부터 준비될 수 있다. 다른 방법은 액체 암모니아에 용해된 은 아지드화 금속과 직접 반응하는 것이다.[13] 일부 아지드화물은 탄산염에 하이드라조산을 넣어 처리함으로써 생성된다.
유기농 아지드
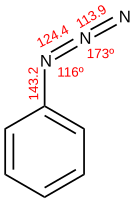
유사알라이드로서, 아지드는 일반적으로 많은 이탈 그룹(예: Br-, I-, OTs-)을 대체하여 아지도 화합물을 준다. 아릴 아지드화물은 아지드화나 트리메틸실릴 아지드화 나트륨과 함께 적절한 디아조늄 소금의 변위를 통해 준비될 수 있다. 염화물에도 불구하고 핵포질 방향족 치환도 가능하다. 아닐아민과 방향족 하이드라진은 알킬아민과 하이드라진처럼 디아조트화 과정을 거친다.[1]
적절하게 기능화된 아지드화합물은 아지드화나트륨과 핵소피질 대체를 거친다. 알리파틱 알코올은 히드라조산을 사용하면서 미쓰노부 반응의 변종을 통해 아지드를 낸다.[1] 히드라진은 또한 아질산나트륨과의 반응에 의해 아지드를 형성할 수 있다.[16]
- PhNH2 + NaNO2 → PhN3
알킬 또는 아릴 아킬 염소이드는 수용액에서 아질화 나트륨과 반응하여 아킬 아지드를 주고, [17][18]아킬 아지드화물은 커티우스 재배열에서 이소시아네이트를 준다.
아조 전달 화합물인 트리플루오로메탄에술포닐아지드 및 이미다졸-1-술포닐아지드화물은 아지드화나트륨에서도 제조된다. 그들은 아민과 반응하여 그에 상응하는 아지드화물을 준다.
- RNH2 → RN3
알킬 아지드 합성을 위한 몇 가지 일반적인 방법은 다음 계획에 설명되어 있다.[7][19][20][21][22][23][24][25] 의심할 여지 없이, 아지드 음이온을 가진 적절한 이탈 집단의 단순한 핵소독성 대체는 선택의 방법으로 남아있다. 떠나는 집단은 할로겐화,[26] 설폰산염 [27][28]등이 될 수 있다. 아지드 소스는 리튬아지드(LiN3), 트리메틸실릴아지드(TMSN3), 트리부틸틴아지드(BuSnN33) 등이 모두 사용됐지만 아지드 소스는 아지드 나트륨(NaN3)이 가장 많다.[7] 전자레인지와[29] 항정신병적[30] 반응변형도 알려져 있다. 알코올은 2-azido-1,3-dimethylimidazolinium 헥사플루오로인산염(ADMP)[31]을 사용하거나 디페닐인스포릴 아지드(DPA)가 있는 미쓰노부 조건 하에서[32] 한 번에 아지드로 변환할 수 있다. 히드록시와 아미노 아지드화물은 에폭시드와 아지리딘 고리 갈라짐으로 각각 접근할 수 있다.[33][34] 디아조가 트리플루오로메탄네술포닐아지드 TFN과3 토실아지드(TsN3)를 이용해 아민에 전이된 것으로 보고됐다.[35] 최근 몇 년 동안, 알케인의 직접 가수 분해는 점점 더 인기를 끌고 있다.[36]
더트-위몰 반응
아지드 합성을 위한 고전적인 방법은 디아조아미노황산염에 디아조아미노황산염에 먼저 디아조늄아미드와 반응한 다음 아지드화물과 설피닌산을 가수 분해하는 Dutt-Wormall 반응이다[37].[38]
반응
무기 아지드화
아지드염은 질소 가스의 방출로 분해될 수 있다. 알칼리 금속 아지드의 분해 온도는 NaN3 (275 °C), KN3 (355 °C), RbN3 (395 °C), CsN3 (390 °C)이다. 이 방법은 초순도 알칼리 금속을 생산하는 데 사용된다.[39]
아지드염의 양성자는 강한 산이 있는 곳에서 유독성 히드라조산을 생성한다.
- H+−
3 + N → HN3
아지드염은 해당 아지드화물을 주기 위해 중금속이나 중금속 화합물과 반응할 수 있으며, 아지드화 나트륨에만 비해 충격 민감도가 높다. 그들은 산성화되면 아질산나트륨으로 분해된다. 이것은 폐기 전에 잔류 아지드화물을 파괴하는 방법이다.[40]
- 2 NaN3 + 2 HNO2 → 3 N2 + 2 NO + 2 Na오호
많은 무기질 공동발효 아지드(예: 염소, 브로민, 요오드 아지드)가 설명되어 왔다.[41]
아지드 음이온은 핵종으로서 작용한다; 그것은 탈핵계와 방향족계 둘 다의 핵종대체를 거친다. 그것은 에폭시드와 반응하여 고리 개방을 야기한다; 그것은 1,4-불포화 카보닐 화합물에 Michael과 같은 결합을 거친다.[1]
아지드화물은 N을2 방출하도록 유도하여 비정상적인 산화 상태에서 금속 단지를 생성함으로써 금속 질도 복합체의 전구체로 사용할 수 있다(고밸런트 철 참조).
유기농 아지드
유기 아지드는 유용한 유기적 반응을 일으킨다. 말단질소는 가벼운 핵성질이다. 아지데스는 쉽게 이원자 질소를 돌출시키는 경향이 있는데, 이는 스타우딩거의 교란이나 커티우스 재배열과 같은 많은 반응에 이용된다.[42]
아지드화물은 스테오딩거 반응에서 수소 분해[43] 또는 인산염(예: 트리페닐인산)으로 아민으로 환원될 수 있다. 이러한 반응은 1,1,1-트리스(aminomethyl)에탄의 합성에 의해 예시된 바와 같이 아지드화물이 보호되는 -NH2 신톤으로 기능할 수 있도록 한다.
- 3H2 + CHC3(CHN23)3 → CHC3(CHNH22)3 + 3N2
아지드 알키네 후이스겐 사이클로어데이션에서 유기 아지드는 1,2,3-트리올을 대체하기 위해 알키네스와 반응하면서 1,3-디폴로 반응한다.
또 다른 아지드화 일반은 질소 삽입 반응에서 노르보르나디엔과 반응하는 토실 아지드화다.[44]
적용들
연간 약 250톤의 아지드화합물이 생산되는데, 그 주산물은 아지드화나트륨이다.[45]
기폭장치 및 추진체
아지드화 나트륨은 자동차 에어백의 추진제다. 이것은 가열로 분해되어 질소 가스를 공급하는데, 이것은 에어백을 빠르게 확장하는데 사용된다.[45]
- 2 NaN3 → 2 Na + 3N2
납 아지드, Pb(N3)2와 같은 헤비메탈 염은 해당 금속과 질소로 분해되는 충격에 민감한 기폭제로서,[46] 예를 들어 다음과 같다.
- Pb(N3)2 → Pb + 3N2
은염과 바륨염은 유사하게 사용된다. 일부 유기 아지드화물은 잠재적 로켓 추진제로서, 예를 들어 2-디메틸아미노에틸아지드(DMAZ)가 있다.
기타
아지드 사용과 관련된 위험 때문에, 연구자들에게 흥미로운 반응성을 보이기는 하지만 상업적으로 사용되는 아지드는 거의 없다. 낮은 분자량 아지드화물은 특히 위험한 것으로 간주되어 피한다. 연구실에서 아지드는 아민의 전구체다. 이들은 '클릭 리액션'과 스토우딩거 레인지에도 참여해 인기를 끌고 있다. 이 두 가지 반응은 일반적으로 상당히 신뢰할 수 있는 것으로서 결합 화학에 의존하고 있다.
일부 아지드화물은 생체 직교 화학 리포터로서, 살아있는 시스템 안에서 그것이 걸어온 신진대사 경로를 보기 위해 "클릭"할 수 있는 분자로 가치가 있다.
항바이러스제 지도부딘(AZT)에는 아지도 그룹이 들어 있다.
아지드화 나트륨은 실험실 실험에서 섭동과 활성제가 통제되지 않는 미생물의 성장을 방지하기 위해 생체화물로 사용된다(수액, 정지, 슬러리...).
안전
- 아지드화물은 폭발성 물질과 독소다.
- 아지드화 나트륨은 (쥐의 경구50 LD 27mg/kg) 독성이며 피부를 통해 흡수될 수 있다. 275℃ 이상으로 가열하면 폭발적으로 분해되며 CS2, 브롬, 질산, 황산 디메틸, 구리, 납 등 중금속과 격렬하게 반응한다. 브뢰네스트산과의 반응으로 매우 독성이 강한 폭발성 수소 아지드가 방출된다.
- 납 아지드와 같은 중금속 아지드는 가열되거나 흔들릴 때 폭발할 수 있는 일차적인 높은 폭발물이다. 헤비메탈 아지드화물은 아지드화나 HN3 증기의 용액이 중금속이나 그 염분과 접촉할 때 형성된다. 헤비메탈 아지드는 예를 들어 금속 파이프라인과 다양한 장비의 금속 구성품(회전 증발기, 냉동 건조 장비, 냉각 트랩, 물 욕조, 폐기물 파이프)에 축적되어 격렬한 폭발로 이어질 수 있다.
- 일부 유기물과 다른 공동발효 아지드화물은 폭발성이 높고 독성이 강한 것으로 분류된다: 무기질 아지드화물은 신경독성 물질로서, 시안화 이온과 같은 아지드화 이온은 시토크롬 c 산화효소 억제제로 작용한다.
- 아지드화나트륨과 폴리머 결합 아지드화 시약은 디할로메탄과 트리할로메탄과 반응해 각각 디알로메탄과 트리알로메탄을 형성하고 있는데, 이 두 가지 모두 용액으로 취급하지 않고 불안정한 상태라고 한다. 회전식 증발기에서 반응 혼합물이 농축되는 동안 다양한 폭발이 보고되었다. diazidomethane (및 triazidomethane)의 위험은 잘 입증되었다.[47][48]
- 고체 할로겐 아지드화물은 폭발성이 매우 높으므로 용제가 없을 때는 준비하면 안 된다.[49]
참고 항목
참조
![]() 이 글에는 CC BY 2.5 면허에 따라 이용할 수 있는 Oleksandr Zhurakovski의 텍스트가 포함되어 있다.
이 글에는 CC BY 2.5 면허에 따라 이용할 수 있는 Oleksandr Zhurakovski의 텍스트가 포함되어 있다.
- ^ Jump up to: a b c d S. Bräse; C. Gil; K. Knepper; V. Zimmermann (2005). "Organic Azides: An Exploding Diversity of a Unique Class of Compounds". Angewandte Chemie International Edition. 44 (33): 5188–5240. doi:10.1002/anie.200400657. PMID 16100733.
- ^ Griess, John Peter; Hofmann, August Wilhelm Von (1864-01-01). "XX. On a new class of compounds in which nitrogen is substituted for hydrogen". Proceedings of the Royal Society of London. 13: 375–384. doi:10.1098/rspl.1863.0082. S2CID 94746575.
- ^ Griess, Peter (1866). "Ueber eine neue Klasse organischer Verbindungen, in denen Wasserstoff durch Stickstoff vertreten ist". Annalen der Chemie und Pharmacie (in German). 137 (1): 39–91. doi:10.1002/jlac.18661370105.
- ^ Jay, R.; Curtius, Th. (January 1894). "Zur Reduction des Diazoessigesters". Berichte der Deutschen Chemischen Gesellschaft (in German). 27 (1): 775–778. doi:10.1002/cber.189402701151.
- ^ Huisgen, Rolf (October 1963). "1,3-Dipolar Cycloadditions. Past and Future". Angewandte Chemie International Edition in English. 2 (10): 565–598. doi:10.1002/anie.196305651. ISSN 0570-0833.
- ^ Huisgen, R. (November 1963). "Kinetics and Mechanism of 1,3-Dipolr Cycloadditions". Angewandte Chemie International Edition in English. 2 (11): 633–645. doi:10.1002/anie.196306331. ISSN 0570-0833.
- ^ Jump up to: a b c Organic azides: syntheses and applications. Stefan Bräse, Klaus Banert. Chichester, West Sussex, U.K.: John Wiley. 2010. ISBN 978-0-470-68252-4. OCLC 587390490.CS1 maint: 기타(링크)
- ^ Demko, Zachary P.; Sharpless, K. Barry (November 2001). "Preparation of 5-Substituted 1 H -Tetrazoles from Nitriles in Water †". The Journal of Organic Chemistry. 66 (24): 7945–7950. doi:10.1021/jo010635w. ISSN 0022-3263. PMID 11722189.
- ^ Kolb, Hartmuth C.; Finn, M. G.; Sharpless, K. Barry (2001). "Click Chemistry: Diverse Chemical Function from a Few Good Reactions". Angewandte Chemie International Edition. 40 (11): 2004–2021. doi:10.1002/1521-3773(20010601)40:11<2004::AID-ANIE2004>3.0.CO;2-5. ISSN 1521-3773. PMID 11433435.
- ^ Binder, Wolfgang; Kluger, Christian (2006-09-01). "Azide/Alkyne-"Click" Reactions: Applications in Material Science and Organic Synthesis". Current Organic Chemistry. 10 (14): 1791–1815. doi:10.2174/138527206778249838.
- ^ Rostovtsev, Vsevolod V.; Green, Luke G.; Fokin, Valery V.; Sharpless, K. Barry (2002). "A Stepwise Huisgen Cycloaddition Process: Copper(I)-Catalyzed Regioselective "Ligation" of Azides and Terminal Alkynes". Angewandte Chemie International Edition. 41 (14): 2596–2599. doi:10.1002/1521-3773(20020715)41:14<2596::AID-ANIE2596>3.0.CO;2-4. ISSN 1521-3773. PMID 12203546.
- ^ Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (2nd ed.). Butterworth-Heinemann. p. 433. ISBN 978-0-08-037941-8.
- ^ Müller, Thomas G.; Karau, Friedrich; Schnick, Wolfgang; Kraus, Florian (2014). "A New Route to Metal Azides". Angewandte Chemie. 53 (50): 13695–13697. doi:10.1002/anie.201404561. PMID 24924913.
- ^ I. Bernal, J. Cetrullo, W. G. Jackson (1993). "The phenomenon of conglomerate crystallization in coordination compounds. XXIII: The crystallization behavior of [cis-Co(en)2(N3)(SO3)]·2H2O (I) and of [cis-Co(en)2(NO2)(SO3)]·H2O (II)". Struct.Chem. 4: 235. doi:10.1007/BF00673698. S2CID 94847897.CS1 maint: 작성자 매개변수 사용(링크)
- ^ . doi:10.1021/ol901122h. Cite 저널은 필요로 한다.
journal=(도움말); 누락 또는 비어 있음title=(도움말) - ^ R. O. Lindsay and C. F. H. Allen (1942). "Phenyl azide". Organic Syntheses. 22: 96. doi:10.15227/orgsyn.022.0096.
- ^ C. F. H. Allen; Alan Bell. "Undecyl isocyanate". Organic Syntheses.; Collective Volume, 3, p. 846
- ^ Jon Munch-Petersen (1963). "m-Nitrobenzazide". Organic Syntheses.; Collective Volume, 4, p. 715
- ^ Patai, Saul, ed. (1971-01-01). The Azido Group (1971). Chichester, UK: John Wiley & Sons, Ltd. p. 626. doi:10.1002/9780470771266. ISBN 978-0-470-77126-6.
- ^ Scriven, Eric F. Azides and Nitrenes: Reactivity and Utility. Academic Press. p. 542. ISBN 9780124143074.
- ^ Padwa, Albert; Pearson, William H., eds. (2002-04-05). Synthetic Applications of 1,3-Dipolar Cycloaddition Chemistry Toward Heterocycles and Natural Products: Padwa/Dipolar Cycloaddition E-Bk. Chemistry of Heterocyclic Compounds: A Series Of Monographs. New York, USA: John Wiley & Sons, Inc. doi:10.1002/0471221902. ISBN 978-0-471-38726-8.
- ^ 울프, H.Org. 반응하라 1946, 3,337–349.
- ^ Boyer, J. H.; Canter, F. C. (1954-02-01). "Alkyl and Aryl Azides". Chemical Reviews. 54 (1): 1–57. doi:10.1021/cr60167a001. ISSN 0009-2665.
- ^ Scriven, Eric F. V.; Turnbull, Kenneth (March 1988). "Azides: their preparation and synthetic uses". Chemical Reviews. 88 (2): 297–368. doi:10.1021/cr00084a001. ISSN 0009-2665.
- ^ Bräse, Stefan; Gil, Carmen; Knepper, Kerstin; Zimmermann, Viktor (2005-08-19). "Organic Azides: An Exploding Diversity of a Unique Class of Compounds". Angewandte Chemie International Edition. 44 (33): 5188–5240. doi:10.1002/anie.200400657. ISSN 1433-7851. PMID 16100733.
- ^ Righi, Giuliana; D'Achille, Claudia; Pescatore, Giovanna; Bonini, Carlo (September 2003). "New stereoselective synthesis of the peptidic aminopeptidase inhibitors bestatin, phebestin and probestin". Tetrahedron Letters. 44 (37): 6999–7002. doi:10.1016/S0040-4039(03)01799-4.
- ^ Baran, Phil S.; Zografos, Alexandros L.; O'Malley, Daniel P. (March 2004). "Short Total Synthesis of (±)-Sceptrin". Journal of the American Chemical Society. 126 (12): 3726–3727. doi:10.1021/ja049648s. ISSN 0002-7863. PMID 15038721.
- ^ Shaffer, Karl J.; Taylor, Carol M. (2006-08-01). "β-Glycosides of Hydroxyproline via an Umpolung Approach". Organic Letters. 8 (18): 3959–3962. doi:10.1021/ol061424m. ISSN 1523-7060. PMID 16928048.
- ^ Singh, Pradeep N.D.; Muthukrishnan, Sivaramakrishnan; Murthy, Rajesh S.; Klima, Rodney F.; Mandel, Sarah M.; Hawk, Michael; Yarbrough, Nina; Gudmundsdóttir, Anna D. (December 2003). "A simple and fast procedure for efficient synthesis of β- and γ-azidoarylketones". Tetrahedron Letters. 44 (51): 9169–9171. doi:10.1016/j.tetlet.2003.10.033.
- ^ Martinez, Luis E.; Leighton, James L.; Carsten, Douglas H.; Jacobsen, Eric N. (May 1995). "Highly Enantioselective Ring Opening of Epoxides Catalyzed by (salen)Cr(III) Complexes". Journal of the American Chemical Society. 117 (21): 5897–5898. doi:10.1021/ja00126a048. ISSN 0002-7863.
- ^ Kitamura, Mitsuru; Koga, Tatsuya; Yano, Masakazu; Okauchi, Tatsuo (June 2012). "Direct Synthesis of Organic Azides from Alcohols Using 2-Azido-1,3-dimethylimidazolinium Hexafluorophosphate". Synlett. 23 (9): 1335–1338. doi:10.1055/s-0031-1290958. ISSN 0936-5214.
- ^ Lee, Sang-Hyeup; Yoon, Juyoung; Chung, Seung-Hwan; Lee, Yoon-Sik (March 2001). "Efficient asymmetric synthesis of 2,3-diamino-3-phenylpropanoic acid derivatives". Tetrahedron. 57 (11): 2139–2145. doi:10.1016/S0040-4020(01)00090-4.
- ^ Sabitha, Gowravaram; Babu, R. Satheesh; Rajkumar, M.; Yadav, J. S. (February 2002). "Cerium(III) Chloride Promoted Highly Regioselective Ring Opening of Epoxides and Aziridines Using NaN 3 in Acetonitrile: A Facile Synthesis of 1,2-Azidoalcohols and 1,2-Azidoamines †". Organic Letters. 4 (3): 343–345. doi:10.1021/ol016979q. ISSN 1523-7060. PMID 11820875.
- ^ Saito, Seiki; Bunya, Norio; Inaba, Masami; Moriwake, Toshio; Torii, Sigeru (January 1985). "A facile cleavage of oxirane with hydrazoic acid in dmf A new route to chiral β-hydroxy-α-amino acids". Tetrahedron Letters. 26 (43): 5309–5312. doi:10.1016/S0040-4039(00)95024-X.
- ^ Titz, Alexander; Radic, Zorana; Schwardt, Oliver; Ernst, Beat (April 2006). "A safe and convenient method for the preparation of triflyl azide, and its use in diazo transfer reactions to primary amines". Tetrahedron Letters. 47 (14): 2383–2385. doi:10.1016/j.tetlet.2006.01.157.
- ^ Waser, Jérôme; Gaspar, Boris; Nambu, Hisanori; Carreira, Erick M. (2006-09-01). "Hydrazines and Azides via the Metal-Catalyzed Hydrohydrazination and Hydroazidation of Olefins". Journal of the American Chemical Society. 128 (35): 11693–11712. doi:10.1021/ja062355+. ISSN 0002-7863. PMID 16939295.
- ^ Pavitra Kumar Dutt; Hugh Robinson Whitehead & Arthur Wormall (1921). "CCXLI.—The action of diazo-salts on aromatic sulphonamides. Part I". J. Chem. Soc., Trans. 119: 2088–2094. doi:10.1039/CT9211902088.
- ^ 이름 반응: Jee Jack Li의 상세한 반응 메커니즘 모음 2003 스프링거 ISBN 3-540-40203-9
- ^ E. Dönges "Alkali Metals" 준비 무기 화학 핸드북, 2차 Ed. G. Brauer 편집, Academic Press, 1963년, NY. 1. 페이지 475.
- ^ Committee on Prudent Practices for Handling, Storage, and Disposal of Chemicals in Laboratories, Board on Chemical Sciences and Technology, Commission on Physical Sciences, Mathematics, and Applications, National Research Council (1995). Prudent practices in the laboratory: handling and disposal of chemicals. Washington, D.C.: National Academy Press. ISBN 0-309-05229-7.CS1 maint: 여러 이름: 작성자 목록(링크)
- ^ I. C. Tornieporth-Oetting & T. M. Klapötke (1995). "Covalent Inorganic Azides". Angewandte Chemie International Edition in English. 34 (5): 511–520. doi:10.1002/anie.199505111.
- ^ Saul Patai, ed. (1971). The Azido Group. PATAI'S Chemistry of Functional Groups. doi:10.1002/9780470771266.
- ^ "Amine synthesis by azide reduction".
- ^ Damon D. Reed & Stephen C. Bergmeier (2007). "A Facile Synthesis of a Polyhydroxylated 2-Azabicyclo[3.2.1]octane". J. Org. Chem. 72 (3): 1024–6. doi:10.1021/jo0619231. PMID 17253828.
- ^ Jump up to: a b 호르스트 H. 조벨리우스, 한스-디터 샤르프 2005년 웨일리-VCH 웨인하임 산업 화학 백과사전 "히드라조산과 아지데스" doi:10.1002/14356007.a13_message
- ^ 슈라이버와 앳킨스. 무기 화학 (제5판) W. H. Freeman and Company, New York, pp 382.
- ^ M. S. Alfred Hassner (1986). "Synthesis of Alkyl Azides with a Polymeric Reagent". Angewandte Chemie International Edition in English. 25 (5): 478–479. doi:10.1002/anie.198604781.
- ^ A. Hassner; M. Stern; H. E. Gottlieb; F. Frolow (1990). "Synthetic methods. 33. Utility of a polymeric azide reagent in the formation of di- and triazidomethane. Their NMR spectra and the x-ray structure of derived triazoles". J. Org. Chem. 55 (8): 2304–2306. doi:10.1021/jo00295a014.
- ^ L. Marinescu; J. Thinggaard; I. B. Thomsen; M. Bols (2003). "Radical Azidonation of Aldehydes". J. Org. Chem. 68 (24): 9453–9455. doi:10.1021/jo035163v. PMID 14629171.
외부 링크
| 위키미디어 커먼스는 아지데스 관련 매체를 보유하고 있다. |
- 유기 아지드 합성, 최근 방법
- 유기 아지드 합성, 정화 및 취급









