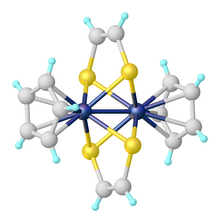
금속디티올렌복합체
Metal dithiolene complexDithiolene 금속 단지 있는 종합 1,2-dithiolene ligands되어 있다. 1,2-Dithiolene ligands, 1,2-dichalcogenolene species,[1]의 특별한 경우 불포화 두 자리 리간드는 두개의 기증자 있는 황이에요. 1,2-Dithiolene 금속 단지는 종종"금속 dithiolenes","metallodithiolenes"또는"dithiolene 단지"이라 한다..[2] 대부분의 몰리브데넘과 텅스텐 함유 단백질은 활성 부지에 디티올렌과 같은 모이에티를 가지고 있는데, Mo나 W에 묶인 이른바 몰리브도프테린 공동 인자(molybdopterin coactor)를 특징으로 한다.[3]
디티올렌 금속단지는 게르하르트 N에 의해 처음 대중화된 1960년대부터 연구되어 왔다. 슈라우저와 볼커 P. 니켈황화 니켈과 디페닐아세틸렌의 반응으로 니켈 bis(stilbene-1,2-dithiolate) (Ni(SCPh222))2를 준비한 메이웨그.[4] 많은 관련 단지의 구조, 분광, 전기화학적 특성이 설명되어 왔다.
구조 및 본딩
디티올렌 금속 단지는 금속 중심이 하나, 둘 또는 세 개의 디티올렌 리간드로 조정되는 곳에서 찾을 수 있다. 트리스(dithiolene) 콤플렉스는 조정 화학에서 삼각 프리즘 기하학의 첫 번째 예였다. 그 예로는 Mo(SCPh222)가 있다.3 유사한 구조물이 몇몇 다른 금속들에 대해 관찰되었다.[5]

디티올렌의 특이한 리독스와 강렬한 광학적 특성 때문에 디티올렌 콤플렉스의 전자구조는 강렬한 연구의 대상이 되어 왔다. 1,2-디티올렌 리간드는 다이니오닉 "ene-1,2-디티올레이트", 중성 "1,2-디티오케톤" 그리고 이들 트위오키온 중간 래디칼의 세 가지 산화상태로 존재할 수 있다.o.[6] 후자 두 개가 금속 중심부로 복잡해지면 리간드(따라서 금속 중심)의 산화 상태를 쉽게 정의할 수 없다. 따라서 그러한 리간드를 비침습성이라고 한다. 디티올렌 리간드의 등뼈에 있는 대체물인 R과 R'은 결과 금속 복합체의 특성에 예상 방식으로 영향을 미친다. 긴 사슬은 극성이 적은 용매에 용해성을 부여한다. 전자 수용기(예: CN, COMe2)는 감소 및 음이온 복합체를 안정화한다. 대체물이 동일하고 대칭적인 디티올렌(R = R')이 비대칭보다 더 일반적인 경우 파생상품이 알려져 있다.
그들의 전자적 구조로 인해 1,2-디티올렌 단지들은 되돌릴 수 있는 리독스 반응을 겪는다. 산화하면 디티올렌 콤플렉스는 1,2디티오케톤 캐릭터가 더 크다. 축소된 복합체에서, 리간드는 더 많은 ene-1,2-dithiolate 특성을 가정한다. 이러한 설명은 C-C와 C-S 결합 거리의 차이를 조사하여 평가한다. 진정한 구조는 이 공명 구조들 사이에 있다. 구조에 대한 명확한 설명을 제공하는 것이 불가능하다는 것을 반영하여, 맥클레니지는 특정한 산화 상태를 명시하지 않는 리간드의 일반적인 이름을 주기 위해 '디티올렌'이라는 용어를 도입했다. 이 제안은 일반적으로 받아들여졌고, '디티올렌'은 현재 보편적으로 받아들여진 용어다. 보다 최근에 와서야 모노anionic 1,2-디티올렌 리간드의 급진적인 성질이 지적되었다.[6] 실제 디티올렌 활성산소의 예는 거의 보고되지 않았지만, 중성 bis(1,2-dithiolene) 복합체에서의 분극 전환 금속 이온의 직경화는 두 급진적 리간드 사이의 끈 반소성 결합의 결과로 간주되어야 한다.
신청 및 발생
1,2-디티올렌 금속 복합체는 몰리브도프테인 결합 Mo와 W 함유 효소의 형태로 자연에서 광범위하게 발생한다.
1,2-디티올렌 복합 애플리케이션은 수두룩하며, 초전도성부터 선형 및 비선형 광학, 생화학에 이르기까지 다양하다. 12개 디티올렌 단지의 상업적 적용은 제한적이다. 레이저 어플리케이션(Q-스위치, 모드 잠금)에서 염료로서 몇 가지 디티올렌 콤플렉스가 상용화되었다(Q-스위치, 모드 잠금). 1,2-디티올렌 콤플렉스는 전도성, 자력, 비선형 광학 등의 맥락에서 논의되었다. 산업 올레핀(alkene) 정화 작업을 위해 황 센터에 불포화 탄화수소를 묶는 디티올렌 금속 단지를 사용할 것을 제안했다.[8] 그러나, 그러한 시스템 내의 복잡성은 나중에 명백해졌고, 알켄 정화에서 금속 디티올렌 복합체를 사용하기 전에 더 많은 연구가 필요할 것이라는 주장이 제기되었다.[9]
준비
알켄디티올레이트로부터
대부분의 디티올렌 콤플렉스는 금속 할리드를 함유한 1,2알케네디티올레이트의 알칼리 금속염의 반응에 의해 준비된다. 티올레이트(tiolate)는 티올의 결합 기반이므로 알켄디티올레이트(alkenedithiolate)는 공식적으로 알켄디티올의 결합 기반이다. 일반적인 알켄디티올레이트는 1,3-디티올레-2-티오네-4,5-디티올레이트[10] 및 말레오니트라일디톨레이트(mnt2−):[11]
- Ni2+ + 2 (NC)2CS222− → Ni[SC22(CN)]222−
일부 알켄디티올레이트는 복잡한 유기 반응에 의해 현장에서 생성된다.
- cis-HC22(SCHPh2)2 + 4 Na → cis-HC22(SNA)2 + 2 NaCHPh2
음이온이 생성되면 다음과 같이 리간드로 배치된다.
- NiCl2 + 2 cis-HC22(SNA)2 → Na2[Ni(SH222)]2 + 2 NaCl
초기에 형성된 전자가 풍부한 복합체는 종종 자연적인 공기 산소를 겪는다.
- [Ni(SH222)]22− + 2 H+ + 1/22 O → Ni(SH222)2 + HO2
from acyloins
디티올렌의 합성을 위한 초기적이고도 여전히 강력한 방법은 PS와410 함께 α-히드록시케톤, 아실로인의 반응을 수반하며, 이어서 가수분해와 금속염으로 혼합물을 처리한다. 이 방법은 Ni[SCAr222] (Ar = aryl)2를 준비하는 데 사용된다.
From dithietes.
비록 1,2-디티온은 드물고 따라서 유용한 전구체는 아니지만, 그들의 용맹성 등소체, 1,2-디티엣이 가끔 사용된다. 더 흔한 디티에트 중 하나는 원소 황과 육불화탄소-2-부티네의 반응으로 제조된 증류성(CF3)2CS이다22. 이 전기 시약은 산화적으로 많은 낮은 발렌타인 금속을 첨가하여 bis와 tris(dithiolene) 콤플렉스를 부여한다.
- Mo(CO)6 + 3(CF3)2CS22 → [(CF3)2CS22]3Mo + 6 CO
- Ni(CO)4 + 2(CF3)2CS22 → [(CF3)2CS22]2Ni + 4 CO
금속 황화물과 알킨스의 반응에 의해
Ni[SCAr222]2 유형의 종은 처음에 디페닐라세틸렌과 함께 황화 니켈의 반응에 의해 준비되었다. 이 방법의 보다 현대적인 버전은 잘 정의된 폴리설피도 복합체를 가진 디메틸 아세틸렌디카르복시산염과 같은 전기영양 아세틸렌의 반응을 수반한다.
역사와 명명법
1960년대까지는 그 이름으로 불리지 않았지만 디티올렌 리간드에 대한 초기 연구는 몇 개의 금속 중심부로 밝은 색상의 침전물을 형성하는 키녹살린-2,3 디티올레이트와 3,4 톨루엔디올레이트에 초점을 맞췄다.[13]: 58 [14] 그러한 종은 원래 분석 화학에 관심이 있었다. 벤젠 등뼈가 결핍된 디티올렌은 이 지역의 중요한 발전을 나타냈는데, 특히 말레니트리엘-1,2-디티올레이트("mnt"), (NC)2CS222−, 에틸렌디틸렌디톨렌(HCS2222−)이 특히 그러했다.
참조
- ^ Arca M, Aragoni MC, Pintus A (2013-07-25). "CHAPTER 11.3:1,2‐Dichalcogenolene Ligands and Related Metal Complexes". Handbook of Chalcogen Chemistry. pp. 127–179. Retrieved 2021-03-17.
- ^ Karlin KD, Stiefel EI, eds. (2003). Progress in Inorganic Chemistry, Dithiolene Chemistry: Synthesis, Properties, and Applications. New York: Wiley-Interscience. ISBN 978-0-471-37829-7.
- ^ Romão MJ, Archer M, Moura I, Moura JJ, LeGall J, Engh R, et al. (November 1995). "Crystal structure of the xanthine oxidase-related aldehyde oxido-reductase from D. gigas". Science. 270 (5239): 1170–6. Bibcode:1995Sci...270.1170R. doi:10.1126/science.270.5239.1170. PMID 7502041. S2CID 34922450.
- ^ Schrauzer GN, Mayweg V (1962). "Reaction of Diphenylacetylene with Ni Sulfides". J. Am. Chem. Soc. 84: 3221. doi:10.1021/ja00875a061.
- ^ Eisenberg R, Gray HB (1967). "Trigonal-prismatic coordination. Crystal and Molecular Structure of Tris (cis-1,2-diphenylethylene-1,2-dithiolato)vanadium". Inorg. Chem. 6 (10): 1844–9. doi:10.1021/ic50056a018.
- ^ a b Aragoni MC, Caltagirone C, Lippolis V, Podda E, Slawin AM, Woollins JD, et al. (December 2020). "Diradical Character of Neutral Heteroleptic Bis(1,2-dithiolene) Metal Complexes: Case Study of [Pd(Me2timdt)(mnt)] (Me2timdt = 1,3-Dimethyl-2,4,5-trithioxoimidazolidine; mnt2- = 1,2-Dicyano-1,2-ethylenedithiolate)". Inorganic Chemistry. 59 (23): 17385–17401. doi:10.1021/acs.inorgchem.0c02696. PMC 7735710. PMID 33185438.
- ^ McEwan AG, Ridge JP, McDevitt CA, Hugenholtz P (2002). "The DMSO Reductase Family of Microbial Molybdenum Enzymes; Molecular Properties and Role in the Dissimilatory Reduction of Toxic Elements". Geomicrobiology Journal. 19 (1): 3–21. doi:10.1080/014904502317246138. S2CID 85091949.
- ^ Wang K, Stiefel EI (January 2001). "Toward separation and purification of olefins using dithiolene complexes: an electrochemical approach". Science. 291 (5501): 106–9. Bibcode:2001Sci...291..106W. doi:10.1126/science.291.5501.106. PMID 11141557.
- ^ Harrison DJ, Nguyen N, Lough AJ, Fekl U (August 2006). "New insight into reactions of Ni(S2C2(CF3)2)2 with simple alkenes: alkene adduct versus dihydrodithiin product selectivity is controlled by [Ni(S2C2(CF3)2)2]- anion". Journal of the American Chemical Society. 128 (34): 11026–7. doi:10.1021/ja063030w. PMID 16925411.
- ^ Dietzsch W, Strauch P, Hoyer E (1992). "Thio-oxalates: Their Ligand Properties and Coordination Chemistry". Coord. Chem. Rev. 121: 43–130. doi:10.1016/0010-8545(92)80065-Y.
- ^ Holm RH, Davison A (1967). "Metal Complexes Derived fromcis-1,2-dicyano-1,2-ethylenedithiolate and Bis(Trifluoromethyl)-1,2-dithiete". Metal Complexes Derived from cis-1,2-Dicyano-1,2-Ethylenedithiolate and Bis(trifluoromethyl)-1,2-Dithiete. Inorg. Synth. Inorganic Syntheses. Vol. 10. pp. 8–26. doi:10.1002/9780470132418.ch3. ISBN 978-0-470-13241-8.
- ^ Miller WK, Haltiwanger RC, VanDerveer MC, DuBois MR (1983). "Syntheses and structures of new molybdenum complexes with dithiobenzoate and dimercaptotoluene ligands. Structural Comparisons in a Series of Dithiolate-Bridged Dimers of Molybdenum(III)". Inorganic Chemistry. 22 (21): 2973–2979. doi:10.1021/ic00163a001.
- ^ McCleverty J (1968). "Metal 1,2-Dithiolene and Related Complexes". Progress in Inorganic Chemistry. Progress Inorganic Chemistry. Progress in Inorganic Chemistry. Vol. 10. pp. 49–221. doi:10.1002/9780470166116.ch2. ISBN 978-0-470-16611-6.
- ^ Arca M, Aragoni MC (2007). "1,2-Dithiolene Ligands and Related Selenium and Tellurium Compounds". Handbook of Chalcogen Chemistry: 797–830. doi:10.1039/9781847557575-00797.