티오황산탈수소효소
Thiosulfate dehydrogenase| 티오황산탈수소효소 | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 활성 부위에 티오황산염 기질이 존재하는 티오황산탈수소효소의 3D 구조(RCSB 코드 4V2K) | |||||||||
| 식별자 | |||||||||
| EC 번호 | 1.8.2.2 | ||||||||
| CAS 번호 | 9076-88-4 | ||||||||
| 데이터베이스 | |||||||||
| 인텐츠 | IntEnz 뷰 | ||||||||
| 브렌다 | 브렌다 엔트리 | ||||||||
| ExPASy | NiceZyme 뷰 | ||||||||
| 케그 | KEGG 엔트리 | ||||||||
| 메타사이크 | 대사 경로 | ||||||||
| 프라이머리 | 프로필 | ||||||||
| PDB 구조 | RCSB PDB PDBe PDBum | ||||||||
| 진 온톨로지 | AmiGO / QuickGO | ||||||||
| |||||||||
티오황산탈수소효소(약칭 TsdA)(EC 1.8.2.2)는 화학 [1]반응을 촉매하는 효소이다.
- 티오황산 2개 + 페리시토크롬 2개 { \ 테트라시온산염 + 페로시토크롬 2개
따라서 이 효소의 두 가지 기질은 티오황산염과 페리시토크롬c이며, 그 두 가지 생성물은 테트라티온산과 페로시토크롬c이다.
티오황산탈수소효소 호몰로지는 수많은 세균종에서 분리되고 구조가 약간 다르지만 황산화 기능과 메커니즘은 유사하다.이 효소는 Sox 황산화 [2]경로의 일부 효소와 기능과 구조 면에서 유사합니다.
명명법
이 효소는 산화환원효소 계열, 특히 시토크롬을 수용체로 하는 공여자의 황 그룹에 작용합니다.이 효소 클래스의 계통명은 티오황산:페리시토크롬-c 산화환원효소이다.일반적으로 사용되는 다른 명칭으로는 테트라시온산합성효소, 티오황산산화효소, 티오황산산화효소 및 티오황산수용체산화환원효소가 있다.
구조.
주목할 만한 연구가 이루어진 박테리아 균주 알로크로마튬 비노섬(Allochromatium vinosum, 25.8kDa)에서 분리된 티오황산탈수소효소는 각각 시토크롬 c와 유사한 2개의 촉매 도메인으로 구성되며, 긴 비구조화 펩타이드 [3]사슬에 의해 결합된다.N 말단 도메인은 구조적으로 SoxA 계열의 시토크롬 효소와 상동성이 있는 반면, C 말단 도메인은 표준 미토콘드리아 시토크롬 c 계열의 대표이며, P.[4] 할로플랑크티스의 아질산 환원 효소와 높은 유사성을 가진다.각 도메인은 8.1Ω의 짧은 거리로 분리된 공유 결합 철 함유 헴 분자를 포함하고 있어 빠른 전자 [5]전달을 돕는다.N 말단 도메인과 C 말단 도메인은 모두 4개의 α 나선형(해당 도메인에서 헴을 둘러싸고 있음)과 2가닥 반병렬 β 시트를 포함하며, 이는 유전자 복제 [6]이벤트에 의해 효소가 발생했음을 시사한다.
효소의 단일 활성 부위는 중심 철 헴 근처의 두 도메인(C 말단 도메인에 가까운) 사이에 위치한다.
메커니즘
효소가 발생을 가능하게 하는 정확한 메커니즘에 대해서는 논란이 있기 때문에 그 과정은 여전히 모호하다.또한 박테리아 종 중 티오황산탈수소효소 효소의 다양성은 몇 가지 가능한 [5]활성 메커니즘을 암시한다.단, 티오황산탈수소효소 도메인이 유황담체단백질 SoxYZ 및 시토크롬 SoxAX와 현저하게 유사하기 때문에 A. 비노섬에서 티오황산탈수소효소 촉매반응에 대한 관련 메커니즘을 도출할 수 있다.티오황산탈수소효소의 제안된 메커니즘에 대한 전반적인 개요는 다음의 두 가지 가역적 산화환원 반응으로 요약할 수 있다.
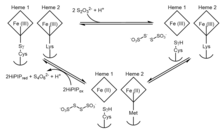
1단계는 티오황산염이 특이하고 반응성이 높은 시스테인 S-설판 부가물에 초기 결합하여 S-티오황산염 부가물을 형성함을 나타낸다.2단계는 이어서 티오황산염이 추가되어 테트라티온을 형성하면서 양쪽 헴을 환원하고 전형적인 시스테인 잔기를 남긴다.활성부위에서는 촉매철 헴에 결합된 시스테인 잔기가 효소 활성에 필수적이며, 이는 티오황산염과 [7]테트라티온산염의 양쪽 모두를 산화시키는 효소의 능력을 완전히 제거했기 때문이다.A. vinosum은 가역적이지만 전위가 +198mV인 [8]티오황산염으로 테트라티온산염이 환원되어도 2개의 티오황산염 이온을 형성하는 반응은 테트라티온산염의 생성보다 훨씬 느리다.
효소의 감소는 두 번째 헴에서 Lys208에서 Met209로 리간드 전환을 일으킨다.Met209를 아스파라긴 또는 글리신으로 대체하는 돌연변이 단백질은 야생형 변종과 유사한 기질 친화성을 가지지만 훨씬 낮은 특이 활성을 가지며,[9] 이는 헴2가 메커니즘의 마지막 단계에서 전자 출구점임을 시사한다.헴2 및 리간드 스위치가 환원되면 레독스 전위가 증가하여 역반응을 저해하여 티오황산염을 형성한다.여기에서 고전위 철황단백질(HiPIP)이 양 헴의 초기상태로 산화될 때 전자수용체로서 기능하는 것이 제안된다.
기능.
티오황산염이 테트라시온산염으로 산화되는 것은 티오황산염과 테트라시온산이 [10]많은 세균종에서 전자공여체 및 전자수용체 역할을 하기 때문에 여러 티오바실리, 광영양 및 헤테로시온에서 관찰된다.두 화합물 모두 황화물과 [11]황산염의 전환 과정인 생물 지구 화학적 황 순환의 중간체이며 중요한 역할을 합니다.따라서 티오황산탈수소효소는 [12]유황회로에서 중간체 간의 전환에 필수적이다.유황 사이클은 다양한 박테리아가 생성된 티오황산염을 호기성 성장을 위한 전자공여체 및 광합성을 위한 혐기성 이산화탄소 고정체로서 이용할 수 있게 한다.티오황산탈수소효소를 이용하여 보충 에너지원으로서 티오황산으로부터 [13]에너지를 얻는 많은 티오박테리아는 의사모나스와 할로모나스이다.테트라시온산염은 테트라시온산염 환원에 의해 혐기성 호흡 중에 호흡 전자수용체 역할을 할 수 있다.
산업용 응용 프로그램
아세티오바실루스 페록시단스 등 티오박테리아는 철황광물로부터 철과 황을 에너지원으로 산화시켜 철과 황산을 [14]생성하면서 자기영양성장을 지원함으로써 산업용 바이오 침출에 필수불가결해졌다.따라서 광상으로부터 세균을 분리하여 내화금 및 철광석 처리 및 산업폐기물, 하수, 중금속 [15]오염토양의 해독에 사용하였습니다.
레퍼런스
- ^ Lu WP, Kelly DP (1988). "Cellular Location and Partial Purification of the 'Thiosulphate-oxidizing Enzyme' and 'Trithionate Hydrolyase' from Thiobacillus tepidarius". Microbiology. 134 (4): 877–885. doi:10.1099/00221287-134-4-877.
- ^ Bamford, V. A. (2002). "Structural basis for the oxidation of thiosulfate by a sulfur cycle enzyme". The EMBO Journal. 21 (21): 5599–5610. doi:10.1093/emboj/cdf566. ISSN 1460-2075. PMC 131063. PMID 12411478.
- ^ PDB: 4V2K; Grabarczyk DB, Chappell PE, Eisel B, Johnson S, Lea SM, Berks BC (April 2015). "Mechanism of thiosulfate oxidation in the SoxA family of cysteine-ligated cytochromes". The Journal of Biological Chemistry. 290 (14): 9209–21. doi:10.1074/jbc.M114.618025. PMC 4423706. PMID 25673696.
- ^ Grabarczyk DB, Chappell PE, Eisel B, Johnson S, Lea SM, Berks BC (April 2015). "Mechanism of thiosulfate oxidation in the SoxA family of cysteine-ligated cytochromes". The Journal of Biological Chemistry. 290 (14): 9209–21. doi:10.1074/jbc.M114.618025. PMC 4423706. PMID 25673696.
- ^ a b Kurth JM, Brito JA, Reuter J, Flegler A, Koch T, Franke T, Klein EM, Rowe SF, Butt JN, Denkmann K, Pereira IA, Archer M, Dahl C (November 2016). "Electron Accepting Units of the Diheme Cytochrome c TsdA, a Bifunctional Thiosulfate Dehydrogenase/Tetrathionate Reductase". The Journal of Biological Chemistry. 291 (48): 24804–24818. doi:10.1074/jbc.M116.753863. PMC 5122753. PMID 27694441.
- ^ Brito JA, Denkmann K, Pereira IA, Archer M, Dahl C (April 2015). "Thiosulfate dehydrogenase (TsdA) from Allochromatium vinosum: structural and functional insights into thiosulfate oxidation". The Journal of Biological Chemistry. 290 (14): 9222–38. doi:10.1074/jbc.M114.623397. PMC 4423707. PMID 25673691.
- ^ Denkmann K, Grein F, Zigann R, Siemen A, Bergmann J, van Helmont S, Nicolai A, Pereira IA, Dahl C (October 2012). "Thiosulfate dehydrogenase: a widespread unusual acidophilic c-type cytochrome". Environmental Microbiology. 14 (10): 2673–88. doi:10.1111/j.1462-2920.2012.02820.x. PMID 22779704.
- ^ Kurth JM, Dahl C, Butt JN (October 2015). "Catalytic Protein Film Electrochemistry Provides a Direct Measure of the Tetrathionate/Thiosulfate Reduction Potential". Journal of the American Chemical Society. 137 (41): 13232–5. doi:10.1021/jacs.5b08291. PMID 26437022.
- ^ Brito JA, Gutierres A, Denkmann K, Dahl C, Archer M (October 2014). "Production, crystallization and preliminary crystallographic analysis of Allochromatium vinosum thiosulfate dehydrogenase TsdA, an unusual acidophilic c-type cytochrome". Acta Crystallographica Section F. 70 (Pt 10): 1424–7. doi:10.1107/S2053230X14019384. PMC 4188095. PMID 25286955.
- ^ Kelly DP, Wood AP (1994). "Chapter 36: Enzymes involved in microbiological oxidation of thiosulfate and polythionates". In Peck HD, LeGall J (eds.). Inorganic Microbial Sulfur Metabolism. Methods in Enzymology. Vol. 243. pp. 501–510. doi:10.1016/0076-6879(94)43038-1. ISBN 978-0-12-182144-9.
- ^ Zopfi J, Ferdelman TG, Fossing H (2004). "Distribution and fate of sulfur intermediates—sulfite, tetrathionate, thiosulfate, and elemental sulfur—in marine sediments". In Amend JP, Edwards KJ, Lyons TW (eds.). Sulfur Biogeochemistry - Past and Present. Vol. 379. Geological Society of America. pp. 97–116. doi:10.1130/0-8137-2379-5.97. ISBN 978-0-8137-2379-2.
- ^ Sievert S, Kiene R, Schulz-Vogt H (2007). "The Sulfur Cycle". Oceanography. 20 (2): 117–123. doi:10.5670/oceanog.2007.55.
- ^ Podgorsek L, Imhoff JF (1999). "Tetrathionate production by sulfur oxidizing bacteria and the role of tetrathionate in the sulfur cycle of Baltic Sea sediments" (PDF). Aquatic Microbial Ecology. 17: 255–265. doi:10.3354/ame017255.
- ^ Bosecker K (1997). "Bioleaching: metal solubilization by microorganisms". FEMS Microbiology Reviews. 20 (3–4): 591–604. doi:10.1111/j.1574-6976.1997.tb00340.x.
- ^ Rawlings DE (May 2005). "Characteristics and adaptability of iron- and sulfur-oxidizing microorganisms used for the recovery of metals from minerals and their concentrates". Microbial Cell Factories. 4 (1): 13. doi:10.1186/1475-2859-4-13. PMC 1142338. PMID 15877814.